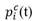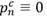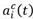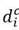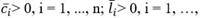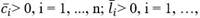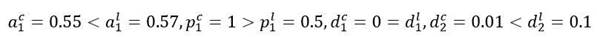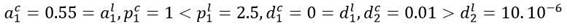Introducción
Las células madre adultas se caracterizan por el potencial de producir diferentes tipos de células y la capacidad de mantener el tamaño de su población mediante un proceso denominado autorrenovación. Las células madre adultas aseguran el mantenimiento y la regeneración de los tejidos.
La formación de las células especializadas maduras es un proceso de varios pasos a partir de las células madre que da lugar a una jerarquía de células progenitoras inmaduras que se convierten en células maduras. El sistema hematopoyético con células madre hematopoyéticas en la parte superior de la jerarquía es un ejemplo conocido de un sistema multietapas.1,2
Durante los últimos años, el concepto de tejido de células madre se ha extendido al concepto de células madre cancerosas (células iniciadoras del cáncer). Según esta hipótesis una pequeña población de células cancerosas da lugar al grueso de las células malignas,3 Las células madre cancerosas ya se han descrito en el contexto de diferentes tipos de cáncer.
Debido a la relativa facilidad de tomar muestras de sangre de la médula ósea, el sistema hematopoyético es adecuado para la modelación y la validación de la leucemogénesis y de la dinámica de las células madre cancerosas.
La hematopoyesis implica procesos complejos que pueden ser examinados al nivel de genes, proteínas de transducción de señales o de poblaciones de diversos tipos de células. Al ver la hematopoyesis como un sistema dinámico y el estrés y la enfermedad como una perturbación del sistema, el enfoque de biología de sistema puede contribuir a una mejor comprensión de la fisiología y de los estados patológicos de la hematopoyesis tales como las leucemias.
Este trabajo tuvo este enfoque y pretendió mostrar cómo los cambios en los parámetros que describen las tasas de proliferación y las propiedades de autorrenovación pueden influir en la dinámica de las poblaciones de células sanas y leucémicas. Para esta tarea, se utilizó un modelo matemático que es una extensión de los modelos de hematopoyesis sana. Aunque el modelo se centra en la biología del sistema hematopoyético, puede ser relevante para otros sistemas celulares, ya que los diferentes sistemas de células madre comparten rasgos comunes.
Métodos
Dependiendo de las cuestiones científicas específicas, diferentes modelos matemáticos se han desarrollado para estudiar la hematopoyesis. Un método establecido para modelar sistemas celulares de múltiples etapas es usar una colección discreta de ecuaciones diferenciales ordinarias, cada una de las cuales describe la dinámica de las células en una sola etapa de maduración.4
Otro grupo de modelos aborda los efectos de estocasticidad en las decisiones del destino celular o en la regulación de la quiescencia celular.
Estos modelos fueron diseñados específicamente para simular la dinámica temporal de la reconstitución de la sangre, la propagación del cáncer de células madre o perturbaciones en la dinámica de la sangre en enfermedades tales como las leucemias mieloides y para proporcionar explicaciones de una variedad de observaciones experimentales y clínicas.5,6,7,8,9,10
Breve descripción del modelo
El modelo es una extensión de los modelos para la hematopoyesis saludable.11 Basado en la comprensión clásica de la hematopoyesis, se supone que el sistema hematopoyético consiste en una secuencia ordenada de estados de maduración discretos, denominados compartimientos que son secuencialmente atravesados.
El modelo incluye un linaje de células leucémicas y un linaje de células sanas. Se supone que la línea celular hematopoyética sana consta de n compartimientos, donde el primer compartimiento es la población de células madre hematopoyéticas y el n-ésimo compartimiento es la población de células maduras postmitóticas, por ejemplo, glóbulos blancos maduros.
Del mismo modo, se supone que la línea celular leucémica consta de m compartimientos, donde las células iniciadoras de leucemia "células madre leucémicas" son el primer compartimiento. Se denota por ci(t), i = 1,...,n, la densidad de población de células en el compartimento i de la hematopoyesis sana en el tiempo t y por li(t), i = 1, ..., m, la densidad de población de células en el compartimiento i en el linaje leucémico. Estas son las variables de estado de este sistema biológico.
Las células sanas en el compartimento i se caracterizan por las siguientes propiedades:
: tasa de proliferación en el compartimiento i en el instante t, que describe con qué frecuencia se divide una célula por unidad de tiempo. Se asume que las células del compartimiento más maduro son post mitóticas, es decir,
: fracción de autorrenovación en el compartimento i en el instante t, es decir, la fracción de células hijas volviendo al compartimento ocupado por las células madre que les dio origen. Se supone que la fracción de autorrenovación está regulada por señales de retroalimentación.
: tasa de mortalidad en el compartimento i, que describe qué fracción de células muere por unidad de tiempo. Para simplificar, se supone que las tasas de mortalidad son cero o constantes en el tiempo.
Los parámetros correspondientes a la línea celular leucémica son denotados por p i l (t), a i l (t), d i l (t). Asumimos que p m l (t) es idénticamente igual a cero.
Señal de retroalimentación
La formación de células sanguíneas sanas está regulada por una retroalimentación negativa. Se acepta que la tasa de expansión de las células progenitoras aumenta, si aumentan la concentración de citoquinas, ya sea por un aumento de la proliferación o por reducción de la apoptosis.
Dado que la dinámica de las citoquinas es rápida en comparación a la duración del ciclo celular se aplica una aproximación de estado casi estacionario para obtener la concentración de la señal que se denota en el modelo por s (t) que es un valor entre cero y uno.
Centramos la atención en el impacto de la autorrenovación en la dinámica temporal de la leucemia, esto es, cómo varían en el tiempo los diferentes estados de maduración de la hematopoyesis como consecuencia de los cambios en las fracciones de autorrenovación. Se supone que las tasas de proliferación son constantes en el tiempo. Esto da como resultado un modelo matemático de la hematopoyesis saludable consistente en un sistema de ecuaciones diferenciales no lineales.
Línea celular leucémica
Hay evidencia de que la población de células leucémicas consiste en una secuencia ordenada de estados celulares, similar a las líneas celulares hematopoyéticas sanas. La llamada “célula madre leucémica” es la célula leucémica más primitiva y da lugar a todos los tipos de células leucémicas.
En el presente modelo, se supone que las células leucémicas son estimuladas por las mismas citoquinas que las células sanas. En otras palabras, se supone que las células sanas y las células leucémicas compiten por recursos del medio ambiente.
Modelo completo
Los supuestos enumerados anteriormente dan como resultado un modelo de población de células sanas y leucémicas acoplado por la señal s(t) consistente en un sistema de ecuaciones diferenciales no lineales cuyas incógnitas son las densidades de población en cada compartimiento, c1, c2 ,…, cn, l1, l2, …, lm.
Se trata de un sistema biológico cuyo estado en cada instante de tiempo está caracterizado por un número finito de variables de estado: c1, c2 ,…, cn, l1, l2, …, lm. Cada ecuación del sistema expresa la rapidez de variación o tasa de cambio en cada compartimiento, esto es, la rapidez de cambio de los diferentes estados de maduración de la hematopoyesis. En su conjunto el sistema anterior describe la rapidez de variación del sistema biológico.
Conociendo el estado del sistema en un instante inicial t0 (condiciones iniciales), se puede predecir el comportamiento del sistema en cualquier instante posterior resolviendo el correspondiente sistema de ecuaciones diferenciales.
En el caso del sistema objeto de estudio, el sistema hematopoyético, en cada estado posterior al instante inicial t0, la rapidez de cambio de las variables de estado depende solo del estado del sistema en ese momento. Estos sistemas se denominan autónomos.
Para estos sistemas se sabe que por cada punto del espacio de estados pasa una y solo una trayectoria de fase (solución del sistema). Por otra parte, si una trayectoria de fase se corta a sí misma entonces, o bien la trayectoria se reduce a un único punto, el cual se denomina punto de reposo o bien la trayectoria de fase es cerrada (los estados del sistema son cíclicos). Por último, existen trayectorias de fase que no se cortan a sí misma.
Son de extraordinario interés biológico aquellos estados del sistema en que la rapidez de cambio del sistema es cero, los llamados puntos de reposo, equilibrio o singulares del sistema, porque, como su nombre lo indica, en ellos la rapidez de cambio de las variables de estado es cero y por tanto, el sistema de mantiene en reposo o equilibrio.
En el caso del sistema hematopoyético significa que el flujo de entrada-salida en cada compartimiento es aproximadamente el mismo. En un individuo sano el sistema hematopoyético es un ejemplo de sistema en equilibrio. Es también de interés determinar el comportamiento del sistema biológico en una vecindad de los puntos de reposo. Si el sistema vuelve a este estado después de estar sujeto a pequeñas perturbaciones, el punto de reposo se denomina estable, y si no es así, se denomina inestable. Lo primero es altamente deseable en cualquier sistema biológico, significa que, independientemente del estado inicial del sistema, este se aproxima a un determinado régimen de equilibrio al cabo de un tiempo suficientemente grande. Lo segundo, evidentemente, es lo no deseable.
Se define la hematopoyesis saludable como la ausencia de células leucémicas y la existencia de un estado estacionario (de equilibrio) positivo de la línea celular no leucémica. Los valores del estado de equilibrio se denotan como
 respectivamente.
respectivamente.
Se consideran 3 tipos de estados estacionarios:
Definición 1: El estado del sistema de la forma
m, se conoce como estado estacionario saludable.Definición 2: El estado del sistema de la forma
m, se conoce como estado estacionario puramente leucémico.Definición 3: El estado del sistema de la forma
m, se conoce como estado estacionario compuesto.
En lo que sigue, el tipo celular más inmaduro de la línea celular leucémica se denomina célula madre leucémica. Este razonamiento no implica que las células madre leucémicas tengan que derivarse de células madre hematopoyéticas. En la mayoría de los casos presentados, la modificación leucomogénica ocurre en el nivel de precursores comprometidos.
Debido a la complejidad técnica de los sistemas grandes, nos centramos en el caso n = 2, m = 2 en el resto de este trabajo. Este es el conjunto mínimo de ecuaciones que describen la hematopoyesis saludable y leucémica. Para estos casos los compartimientos o estados de maduración corresponden a: células madre hematopoyéticas, células sanguíneas maduras, células madre leucémicas y células leucémicas no madre.
Consideramos cuatro escenarios clínicamente relevantes, a saber:
Estado de equilibrio puramente leucémico.
Restablecimiento del estado de equilibrio saludable.
Coexistencia de células sanas y leucémicas en equilibrio.
Coexistencia de células sanas y leucémicas en equilibrio sin un cambio medible en los conteos de células sanas.
Para obtener una idea más clara de la dinámica del sistema, el parámetro p1 c se ha reescalado a 1 y el número de células maduras sanas a valores entre 10 9 y 1010.
Resultados
Al imponer las condiciones iniciales y resolver matemáticamente el sistema se obtiene la evolución temporal de las variables de estado, c1, c2 , l1, l2 . Para ello se ha utilizado el método numérico conocido como método explícito de Runge-Kutta. Las soluciones se han comparado con las obtenidas utilizando el paquete profesional Wolfram Mathematica 11.0 y coinciden plenamente con los reportados11, (anexo 1). En los cuatro escenarios que siguen se investiga la evolución en el tiempo de los estados del sistema para determinar si se mantiene cercano al estado inicial o si cambia hacia otro estado. Para ello, se realizan numerosas simulaciones para diferentes intervalos de tiempo.
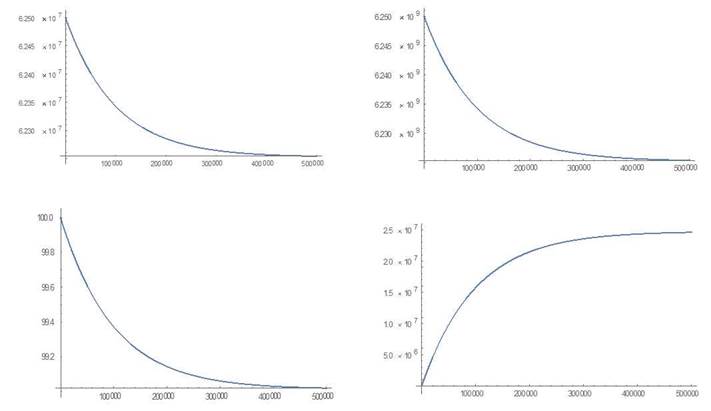
Escenario 1: Estado de equilibrio puramente leucémico
Este es el caso en el que las células madre leucémicas han mejorado el potencial de autorrenovación y disminuido la actividad proliferativa en comparación con las células madre sanas. Con la intención de comparar resultados,11 para las simulaciones en cada escenario se han elegido los mismos parámetros que en la referencia:
El sistema tiene, además del punto de reposo trivial, esto es,
 , otros dos puntos de reposo, uno correspondiente al estado saludable:
, otros dos puntos de reposo, uno correspondiente al estado saludable:
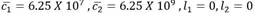 y el otro al estado puramente leucémico:
y el otro al estado puramente leucémico:
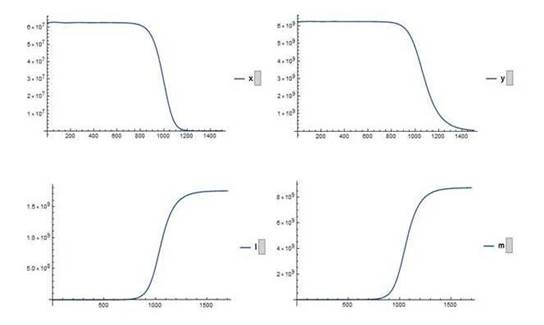
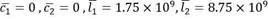 . Para la simulación se escogen, como condiciones iniciales para las células sanas los valores correspondientes al estado de equilibrio saludable, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0 . Esto corresponde a un estado inicial del sistema cercano al punto de equilibrio saludable.
. Para la simulación se escogen, como condiciones iniciales para las células sanas los valores correspondientes al estado de equilibrio saludable, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0 . Esto corresponde a un estado inicial del sistema cercano al punto de equilibrio saludable.
Se muestra el comportamiento de cada uno de los compartimientos después de 365 días (Fig. 1) y las simulaciones en el Anexo 1.
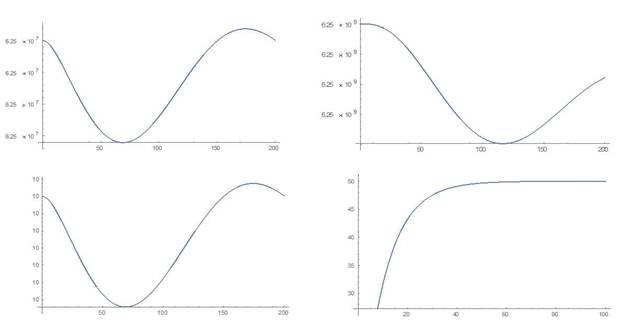
Escenario 2: Restablecimiento del estado de equilibrio saludable
Es un ejemplo de la extinción de un clon celular mutado. En comparación con las células madre sanas, las células mutadas (leucémicas) presentan una autorrenovación reducida y una proliferación mejorada. Por esto, para la simulación se han elegido los siguientes valores de los parámetros:
El sistema tiene, además del punto de reposo trivial, esto es,
 , otros dos puntos de equilibrio, uno correspondiente al estado saludable:
, otros dos puntos de equilibrio, uno correspondiente al estado saludable:
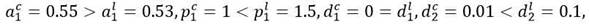 y el otro al estado puramente leucémico:
y el otro al estado puramente leucémico:
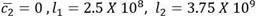 . Para la simulación se escogen, como condiciones iniciales para las células sanas, los valores correspondientes al estado de equilibrio saludable, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0 . Esto corresponde a un punto cercano al punto de equilibrio saludable. El comportamiento de los distintos compartimientos puede apreciarse en la Figura 2 y las simulaciones en el Anexo 1.
. Para la simulación se escogen, como condiciones iniciales para las células sanas, los valores correspondientes al estado de equilibrio saludable, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0 . Esto corresponde a un punto cercano al punto de equilibrio saludable. El comportamiento de los distintos compartimientos puede apreciarse en la Figura 2 y las simulaciones en el Anexo 1.
Escenario 3: Coexistencia. Estado de equilibrio compuesto 1
Representa la coexistencia de poblaciones de células sanas y leucémicas en equilibrio. Las células madre sanas y las leucémicas tienen la misma fracción de autorrenovación, pero diferentes tasas de proliferación, la de las células leucémicas mayor y diferentes tasas de muerte de las células posmitóticas.
Para la simulación se han elegido los siguientes valores de los parámetros:
El sistema tiene un punto de equilibrio en
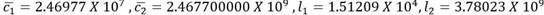 . Se trata de un estado de equilibrio compuesto. Para la simulación, como condiciones iniciales para las células sanas se escogen los valores correspondientes al estado de equilibrio saludable en el primer escenario, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 100, l2 (0)= 0. Esto no corresponde a un punto cercano al estado de equilobrio compuesto. El comportamiento de las curvas puede apreciarse en la Figura 3 y las simulaciones en el Anexo 1
. Se trata de un estado de equilibrio compuesto. Para la simulación, como condiciones iniciales para las células sanas se escogen los valores correspondientes al estado de equilibrio saludable en el primer escenario, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 100, l2 (0)= 0. Esto no corresponde a un punto cercano al estado de equilobrio compuesto. El comportamiento de las curvas puede apreciarse en la Figura 3 y las simulaciones en el Anexo 1
Escenario 4: Coexistencia. Estado de equilibrio compuesto 2
Se trata de la coexistencia de células leucémicas y sanas en equilibrio sin un cambio medible en los conteos celulares sanos. Este escenario puede describir la existencia de mutaciones sub clínicas en líneas celulares que pueden encontrarse en la médula ósea de individuos sanos.
Para la simulación se han elegido los siguientes valores de los parámetros:
Respecto al caso anterior ha disminuido la tasa de proliferación del primer compartimiento de células leucémicas, que es ahora menor que la tasa de proliferación del compartimiento de las células madre sanas. También disminuye la tasa de muerte del último compartimiento.
El sistema tiene un solo punto de equilibrio en
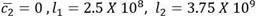 . Se trata de un estado de equilibrio compuesto. Para la simulación, como condiciones iniciales para las células sanas se escogen los valores correspondientes al estado de equilibrio saludable del primer escenario, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0.Este no corresponde a un punto cercano al estado de equilibrio compuesto. El comportamiento de las curvas puede verse en la Figura 4 y las simulaciones en el Anexo 1.
. Se trata de un estado de equilibrio compuesto. Para la simulación, como condiciones iniciales para las células sanas se escogen los valores correspondientes al estado de equilibrio saludable del primer escenario, esto es, c1 (0) = 6.25 por 107, c2(0)=6.25 por 109 y para las células leucémicas los valores l1 (0)= 10, l2 (0)= 0.Este no corresponde a un punto cercano al estado de equilibrio compuesto. El comportamiento de las curvas puede verse en la Figura 4 y las simulaciones en el Anexo 1.
En todas las simulaciones se ha escogido
 .
.
Discusión
En el caso del primer escenario, las soluciones numéricas muestran después de 365 días una fase clínicamente insignificante con recuentos normales de células sanas y recuentos bajos de células leucémica seguida por un aumento repentino de los conteos de células leucémicas y una reducción de los recuentos de células sanas como se reporta en referencia.11 Esto pone en evidencia la inestabilidad del punto de equilibrio saludable en la dirección del punto de equilibrio puramente leucémico, o sea, aunque el estado inicial está próximo al estado de equilibrio saludable, al pasar el tiempo el sistema se aleja de este estado, acercándose al estado de equilibrio puramente leucémico. Este comportamiento es comparable a lo visto en leucemias agudas.
En el caso del segundo escenario las simulaciones muestran que la proliferación mejorada no es suficiente para compensar el potencial reducido de autorrenovación. Después de 730 días el sistema se mantiene en la vecindad del punto de equilibrio saludable, lo cual muestra la estabilidad de este punto.
Incluso, simulando el proceso a partir de un punto cercano al punto de equilibrio del estado puramente leucémico, con el tiempo el sistema tiende al punto de equilibrio del estado saludable (Anexo 1). Esto demuestra la compleja interacción de diferentes propiedades celulares que es necesaria para la persistencia del clon mutante. La solución numérica muestra una disminución del clon de células mutantes en una escala de tiempo relativamente corta. Este escenario describe una mutación benigna. Los cambios de los recuentos celulares saludables son insignificantes en la escala clínicamente relevante.
En el caso del tercer escenario, las soluciones numéricas muestran un moderado y lento cambio de los conteos celulares sanos hacia un nuevo punto de equilibrio, un lento decrecimiento en el conteo de células madre leucémicas y un ligero incremento en el conteo de células leucémicas posmitóticas. Este escenario es comparable a los estados preleucémicos, mielodisplasias, gammapatía monoclonal de significado desconocido o los llamados mielomas latentes que pueden persistir durante años sin movimiento importante de la función sanguínea. La transformación a leucemia es posible si los parámetros cambian a favor de la población leucémica, por ejemplo, por mutación y selección. El restablecimiento del equilibrio saludable es posible si los parámetros cambian a favor de la población sana.
En el caso del cuarto escenario las simulaciones muestran una tendencia hacia un punto de reposo con muy pocos cambios en los conteos de células en los tres primeros compartimientos y un ligero incremento en el último compartimiento.
Consideraciones finales
Se ha discutido un modelo matemático que describe la evolución temporal de una línea celular leucémica que compite con la hematopoyesis saludable. El modelo se basa en propiedades de las células medibles como las fracciones de autorrenovación, las tasas de proliferación y las tasas de mortalidad de los tipos celulares considerados. La interaccion entre las líneas celulares competidoras se modela utilizando una señal de retroalimentación negativa no lineal.
Pueden aparecer diferentes tipos de estados de equilibrios en el modelo, dependiendo de los parámetros del modelo. En la mayoría de los casos existe un único estado de equilibrio saludable y un único estado de equilibrio puramente leucémico, pero no estados de equilibrios compuestos. En ausencia de estados de equilibrios compuestos, el estado de equilibrio leucémico es localmente estable si el estado de equilibrio sano se desestabiliza en la dirección de la población de células madre leucémicas, como sucede en el caso a).
El estado de equilibrio compuesto puede interpretarse como un estado preleucémico o una enfermedad crónica como el síndrome mielodisplásico. Si la tasa de proliferación de las células madre es lo suficientemente grande o la cantidad de células madre leucémicas son lo suficientemente pequeñas, los estados de equilibrios compuestos son linealmente estables. Este resultado podría dar pistas cualitativas para enfoques terapéuticos.
Diferentes escenarios son posibles, como la inducción de apoptosis o la autorrenovación mejorada. La tasa de autorrenovación mejorada puede compensar en parte la reducción de las tasas de proliferación de células malignas en comparación con las células sanas, como en a) y viceversa, como en b). El caso de la proliferación reducida y la autorrenovación mejorada es de gran importancia biológica ya que da una explicación pausible de la resistencia intrínseca de algunos cánceres a tratamientos citotóxicos.
Los síndromes mielodisplásicos son un ejemplo de este escenario. El avance de la autorrenovación permite establecer una población de células madre leucémicas que se dividen más lentamente que las células madre sanas y, por lo tanto, están protegidas de agentes citotóxicos. Esto también explica por qué la aceleración de la dosis de decitabina desde el modo de acción hipometilante al citotóxico conduce aun resultado reducido, especialmente porque la hipometilación parece interferir con la autorrenovación.
El modelo discutido proporciona un marco riguroso para una investigación sistemática de diferentes escenarios de iniciación del cáncer y dar respuestas pausibles a preguntas formuladas en el campo de las aplicaciones clínicas. La diversidad de escenarios descritos por el modelo propuesto refleja la heterogeneidad entre diferentes tipos de leucemias. Este es un primer paso para responder a la necesidad de desarrollar estrategias de tratamiento específicas que dependan de las propiedades de las células malignas.