My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
Print version ISSN 0864-0300
Rev Cubana Invest Bioméd vol.32 no.2 Ciudad de la Habana Apr.-June 2013
ARTÍCULO ORIGINAL
Identificación de fracciones electroforéticas de unión a IgE en extractos de Ascaris sp.
Identification of electrophoretic fractions of the IgE-binding in Ascaris sp. extracts
MSc. Dary Luz Mendoza Meza,I DrC. Gloria Garavito Lancheros,II MSc. Sonja Lozano Socarrás,II Jainy Navarro Meza,II MSc.Eduardo Egea BermejoII
IUniversidad del Atlántico. Barranquilla, Colombia.
IIUniversidad del Norte. Barranquilla, Colombia.
RESUMEN
Introducción: Ascaris lumbricoides infecta a una cuarta parte de la población mundial, constituyéndose en un problema de salud pública. La ascariosis humana está asociada con morbilidad crónica y aguda, especialmente en niños. Recientemente se ha planteado la existencia de anticuerpos IgE en el suero sanguíneo de pacientes alérgicos, que tienen reacción cruzada con alérgenos de artrópodos domésticos y antígenos de Ascaris sp., esto podría aumentar el número de muestras seropositivas a Ascaris sp, en poblaciones sensibilizadas a los ácaros del polvo intradomiciliario.
Objetivo: Producir extractos de cuerpo entero de A. lumbricoides y A. suum, evaluar sus propiedades antigénicas y capacidad de unión a la IgE de pacientes alérgicos al ácaro Dermatophagoides pteronyssinus.
Métodos: Los extractos fueron obtenidos por homogenización y lisis osmótica de las células en presencia de Tween-20 e inhibidores de proteasas. El perfil de proteínas de cada extracto fue identificado por electroforesis en geles de poliacrilamida con dodecilsulfato sódico (SDS-PAGE). La reactividad antigénica se determinó por Western blotting usando once sueros de pacientes alérgicos con diagnóstico de asma.
Resultados: SDS-PAGE reveló 20 fracciones electroforéticas mayoritarias (20-200 kDa). Western Blotting reveló diferencias en el perfil de proteínas de unión a la inmunoglobulina IgE de los extractos.
Conclusiones: Proteínas del cuerpo entero de A. lumbricoides y A. suum mostraron un perfil de unión a IgE diferente en el Western blotting, con sueros de pacientes alérgicos al ácaro D. pteronyssinus, sugiriendo la presencia de marcadores especie específicos entre los dos parásitos, los cuales podrían usarse en futuras investigaciones biomédicas.
Palabras clave: Helmintos, Ascaris lumbricoides, Ascaris suum, IgE.
ABSTRACT
Background: Ascaris lumbricoides infects a quarter of the world's population, thus becoming a public health problem. Human ascariasis is associated with chronic and acute morbidity, especially in children. Recently, it has been stated that the existence of IgE antibodies in the blood serum of allergic patients that have cross reactivity with domestic arthropods and antigens of Ascaris sp. could increase the number of samples seropositive for Ascaris sp. in populations who are sensitized to house dust mites.
Objective: To produce whole body extracts of both A. lumbricoides and A. suum, and to evaluate their antigenic properties and the IgE-binding capacity in patients allergic to the house dust mite (Dermatophagoides pteronyssinus).
Methods: The extracts were obtained by homogenization and osmotic lysis in the presence of Tween-20 and protease inhibitors. The protein profile of each extract was identified by sodium dodecyl sulphate-polyacrylamide gel elctrophoresis (SDS-PAGE). Antigen reactivity was determined by Western blotting, using eleven sera from allergic patients with the diagnosis of asthma.
Results: SDS-PAGE revealed 20 major electrophoretic fractions (20-200 kDa). Western Blotting revealed differences in the protein profile of the immunologlobulin IgE-binding of the extracts.
Conclusions: Whole body proteins of both A. lumbricoides and A. suum showed a different IgE-binding profile in the Western blotting, with sera from patients allergic to the D. pteronyssinus mite, suggesting the presence of species-specific markers between the two parasites, which could be used in further biomedical research.
Key words: Helminths, Ascaris lumbricoides, Ascaris suum, IgE.
INTRODUCCIÓN
La infección por geohelmintos y en especial el género Ascaris, constituye un problema mundial en medicina clínica.1 Se estima que Ascaris lumbricoides infecta a una cuarta parte de la población mundial, aproximadamente 1,2 billones de personas.2 Esta situación es relevante en regiones de clima tropical y subtropical, constituyéndose en un problema de salud pública.3 En la actualidad existe un interés creciente por identificar antígenos especie específicos de Ascaris sp., con propiedades inmunomoduladoras4 y que pudieran usarse en el serodiagnóstico de ascariosis.5 Los antígenos de Ascaris sp. que han sido aislados y purificados, como el ABA-1, muestran reactividad cruzada con antígenos de otros nematodos, lo cual limita su uso en pruebas serológicas diagnósticas.6 Adicionalmente se postula que pacientes alérgicos, sensibilizados a los antígenos de Ascaris sp. podrían presentar resultados falsos positivos en las pruebas serológicas, atribuido a la reactividad cruzada entre proteínas del Ascaris sp. y epítopes de alérgenos presentes en ácaros del polvo doméstico.7 Por lo anterior, es importante identificar otros antígenos que sean especie específicos.
El propósito del presente estudio fue producir y caracterizar extractos de cuerpo entero de A. lumbricoides y A. suum, para identificar y analizar patrones de unión a inmunoglobulina (IgE) especifica anti-Ascaris sp, presentes en sueros de pacientes alérgicos sufriendo de asma bronquial, sensibilizados al ácaro doméstico Dermatophagoides pteronyssinus, residentes en una zona endémica para las infecciones por helmintos en el Caribe Colombiano.
MÉTODOS
Los A. lumbricoides adultos se obtuvieron de personas infectadas, los A. suum se obtuvieron a partir de necropsias de cerdos parasitados. Cinco gramos de los Ascaris se lavaron con agua MQ estéril, se homogenizaron sobre hielo con 10 mL de tampón de lisis (NaCl 40 mM, Tris 20 mM, EDTA 4 mM, Brij 96 al 1,5 % v/v, pH 6.8) y 250 µL de una mezcla de inhibidores de proteasas (aprotinina 80 µM, bestatina 5 mM, E-64 1.5 mM, leupeptina 2 mM, pestatina 1 mM, AEBSF 100 mM). El homogenizado se centrifugó a 10.000 rpm durante 15 min a 4 ºC, el sobrenadante se dializó en membranas con tamaño de exclusión de 3500 Da. Los extractos dializados se liofilizaron y la concentración total de proteínas se determinó por el microensayo de Bradford8.
El perfil de proteínas se evaluó por electroforesis en gel de poliacrilamida con dodecil-sulfato de sodio (SDS-PAGE). Los geles fueron teñidos con azul de Coomassie R-250 y fotografiados en un equipo Universal Hood II (Bio-Rad). El tamaño de las bandas fue calculado con el Software Quantity One (Bio-Rad).
El Western blot se realizó con 11 sueros obtenidos de sendos individuos con diagnóstico de asma bronquial alérgica leve episódica, todos con niveles de IgE total > 150 UI/mL e identificación y semicuantificacion de IgE anti-D. pteronyssinus. Los controles negativos fueron 10 muestras de sueros de individuos clínicamente sanos, no asmáticos, no atópicos, sin infección activa por parásitos helmintos y con IgE total < 150 UI/mL e IgE anti-D. pteronyssinus negativa. Solo se incluyeron en el estudio las personas que firmaron consentimiento informado, previa explicación de los objetivos de la investigación, sus ventajas y exposición con riesgo mínimo, según lo establecido en la resolución 8430 de 1993 del Ministerio de la Protección Social de Colombia.
Para el Western blot, las proteínas de los extractos de Ascaris fueron transferidas a membranas nitrocelulosa, las cuales se bloquearon en tampón TBS-BSA (TBS 50 mM, BSA 3 % p/v, Tween 20 al 0,1 % v/v). Luego se incubaron con una dilución 1/5 de los sueros en tampón TBS-BSA. El exceso de suero se lavó con TBST (TBS 50 mM, Tween 20 al 0,1 % v/v) y las membranas se incubaron 1 h con una dilución 1/1 000 del conjugado (IgG anti-IgE humana unida a la fosfatasa alcalina), en TBS-BSA. El conjugado no unido se lavó con TBST y la membrana se reveló con NBT (Bitro Blue Tretrazolium) y BCIP (5-Bromo, 4-Cloro, 3-Indolfosfato) disuelto en tampón de la fosfatasa alcalina pH 9,5.
RESULTADOS
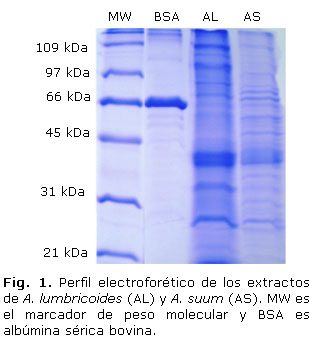
Se obtuvieron extractos de cuerpo entero de A. lumbricoides y A. suum, cuya concentración de proteína total fue de 1,4 y 2,2 mg/mL, respectivamente. SDS-PAGE mostró un perfil electroforético complejo en ambos extractos, se detectaron 20 fracciones mayoritarias y 12 bandas comunes de 34, 39, 42, 54, 65, 74, 85, 105, 127, 142 y 197 kDa. La figura 1 muestra la tinción con azul de Coomassie.
En la figura 2 se observan los resultados del Western blot. Anticuerpos IgE presentes en nueve de 11 sueros se unieron a proteínas en el extracto de A. suum, reconociendo bandas de alto peso molecular; 5 de 11 sueros reaccionaron con proteínas en el extracto de A. lumbricoides, y reconocieron 6 bandas con tamaños de 26, 31, 36, 42, 55 y 97 kDa.
DISCUSIÓN
La eficiencia de la extracción de proteínas totales de A. suum fue 2,31 mg % y de A. lumbricoides 1,63 mg %. Similitudes en el patrón de bandas electroforéticas de extractos de Ascaris sp. se habían informado previamente.9
El Western blotting reveló diferencias en el perfil de proteínas de unión a IgE presente en ambos extractos. Los sueros ensayados reconocieron bandas de unión a IgE de alto peso molecular en el extracto de A. suum; se ha propuesto que la actividad inmunosupresora de A. suum podría atribuirse a proteínas de alto peso molecular.10 En el extracto de A. lumbricoides los sueros reconocieron 6 bandas, por su intensidad se destacaron las bandas de 36 y 42 kDa, las cuales podrían ser isoformas de la tropomiosina de A. lumbricoides. En la literatura se han informado resultados similares con extractos alergénicos de la cucaracha Blatella germanica.11 Estudios recientes han demostrado la presencia de epítopes de unión a la IgE en la tropomiosina de Ascaris sp. lo cual indica que esta es capaz de inducir la respuesta del sistema inmune mediada por IgE en individuos infectados con A. lumbricoides.12,13 También se ha descrito la unión de IgE humana a tropomiosinas de artrópodos,7,14 lo que descartaría su uso como marcador antigénico para el serodiagnóstico de la ascariosis humana en poblaciones sensibilizadas a los ácaros.
Estos resultados contribuyen a la identificación de fracciones proteicas especificas de Ascaris sp. Las fracciones de unión a IgE identificadas en el extracto de A. lumbricoides requieren una mayor caracterización. El uso de extractos totales en el serodiagnóstico de ascariosis podría sobreestimar la exposición al A. lumbricoides, por efecto de la reactividad cruzada. Los resultados de nuestro trabajo fundamentan la necesidad de identificar y caracterizar las fracciones de proteínas principales de Ascaris sp. que pudieran ser aplicadas en medicina clínica.
REFERENCIAS BIBLIOGRÁFICAS
1. Scott E. Ascaris lumbricoides: a review of its epidemiology and relationship to other infections. Ann Nestlé. 2008;66:722.
2. Dold C, Holland CV. Ascaris and ascariasis. Microbes Infect. 2011;13(7):632-7.
3. Brooker S. Estimating the global distribution and disease burden of intestinal nematode infections: adding up the numbers-a review. Int J Parasitol. 2010;40(10):1137-44.
4. Pritchard DI, Blount DG, Schmid-Grendelmeier P, Till SJ. Parasitic worm therapy for allergy: is this incongruous or avant-garde medicine? Clin Exp Allergy. 2012;42(4):505-12.
5. Bhattacharyya T, Santra A, Guhamajumder DN, Chatterjee BP. Possible Approach for Serodiagnosis of Ascariasis by Evaluation of Immunoglobulin G4 Response Using Ascaris lumbricoides Somatic Antigen. Journal of Clinical Microbiology. 2001;39(8):2991-4.
6. Kennedy MW, Qureshi F, Haswell-Elkins M, Elkins DB. Homology and heterology between the secreted antigens of the parasitic larval stages of Ascaris lumbricoides and Ascaris suum. Clin Exp Immunol. 1987;67(1):20-30.
7. Acevedo N, Sánchez J, Erler A, Mercado D, Briza P, Kennedy M et al. IgE cross-reactivity between Ascaris and domestic mite allergens: the role of tropomyosin and the nematode polyprotein ABA-1. Allergy. 2009;64(11):1635-43.
8. Bradford M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Analytical Biochemistry. 1972;72:248-54.
9. Alba JE, Comia MN, Oyong G, Claveria F. Ascaris lumbricoides and Ascaris suum: A comparison of electrophoretic banding patterns of protein extracts from the reproductive organs and body wall. Vet. Arhiv. 2009;79:281-91.
10. Faquim-Mauro E, Macedo M. The immunesuppressive activity of Ascaris suum is due to high molecular weight components. Clin Exp Immunol. 1998;114:245-51.
11. Asturias JA, Gomez-Bayon N, Arilla MC, Martínez A, Palacios R, Sanchez-Gascon F. Molecular Characterization of American Cockroach Tropomyosin (Periplaneta americana Allergen 7), a Cross-Reactive Allergen. J Immunol. 1999;162(7):4342-8.
12. Acevedo N, Caraballo L. IgE cross-reactivity between Ascaris lumbricoides and mite allergens: possible influences on allergic sensitization and asthma. Parasite Immunol. 2011;33(6):309-21.
13. Valmonte GR, Cauyan GA, Ramos JD. IgE cross-reactivity between house dust mite allergens and Ascaris lumbricoides antigens. Asia Pac Allergy. 2012;2(1):35-44.
14. Santos AB, Rocha GM, Oliver C, Ferriani VP, Lima RC, Palma MS, et al. Cross-reactive IgE antibody responses to tropomyosins from Ascaris lumbricoides and cockroach. J Allergy Clin Immunol. 2008;121(4):1040-6.
Recibido: 14 de octubre de 2012.
Aprobado: 25 de abril de 2013.
Dary Luz Mendoza Meza. Universidad del Atlántico. Programa de Química, Km 7 vía Puerto Colombia, Barranquilla.Colombia. Correo electrónico: darymendoza@mail.uniatlantico.com dary_mendoza@yahoo.com