Introducción
El uso de plantas para el tratamiento de diferentes enfermedades ha sido reportado desde tiempos ancestrales y es parte del folklore y conocimiento tradicional alrededor del mundo. El Perú es reconocido por su diversidad de flora y la región andina posee un gran número de plantas medicinales.1,2)
Una de estas plantas es Minthostachys mollis (Griseb) L. conocida como “muña”, esta planta crece entre los 2500 y los 3500 metros de altura y es usada por sus propiedades antiinflamatorias, antibacterianas y antieméticas.3,4) Esta planta pertenece a la familia Lamiaceae, que consiste de más de 300 especies distribuidas en 200 géneros; dentro del género Minthostachys se han identificado 19 especies, de las cuales seis han sido reconocidas en Perú, incluidas M. mollis, M. gabresans, M. setosa, M. spicata, M. griseb y M. salicifolia.5
Los aceites esenciales (AE) son productos biológicos obtenidos de las plantas, que son empleados de manera frecuente por la industria farmacéutica.6 Las propiedades de los AE dependen de su composición y sus proporciones, aunque, en general, se tratan de metabolitos secundarios de alta volatilidad.7 Los principales compuestos químicos de los AE derivados del género Minthostachys son mentol, mentona, pulegona, carvacrol, eucaliptol y timol.8,9 Sin embargo, no existe evidencia de estudios que hayan evaluado la composición química de M. mollis proveniente de la zona andina sur del Perú, ya que se sabe que las propiedades farmacológicas de las plantas pueden variar debido a factores como el lugar de origen, el tiempo de cosecha, las características del suelo y las condiciones climáticas.6
Por otro lado, diferentes investigaciones han reportado las propiedades antimicrobianas de M. mollis o sus derivados, en diversos campos de la medicina, incluida la odontología.4,5,9,10 Se reconoce que en la cavidad oral existen más de 700 especies microbianas, cuya patogenicidad está relacionada con la pérdida de equilibrio de las interacciones ecológicas entre las especies.11
Las caries dentales afectan las estructuras del diente y se reconoce como la enfermedad oral más prevalente a nivel mundial, afectando a más del 80 % de la población.12,13Streptococcus mutans se reconoce como el agente patógeno más importante14 que coloniza los tejidos duros del diente y produce una alteración en el balance homeostático de la biopelícula dental, este fenómeno incluye la desmineralización de la superficie dentaria con la pérdida de iones calcio y fosfato, generando lesiones cariosas, tanto en fosas y fisuras, como en superficies planas del diente.15 Esta pérdida de equilibrio produce un incremento de bacterias acidogénicas como Lactobacillus acidophilus, que produce ácido láctico y subproductos a manera del ácido acético, producto de la fermentación de la sucrosa y promueve un ambiente con valores de pH críticos por debajo de 5,5. Todo ello facilita la desmineralización y la destrucción local de los tejidos duros del diente.16,17
El objetivo de este estudio fue identificar la composición química del aceite esencial de Minthostachys mollis (Griseb) L. y determinar su actividad antibacteriana frente a Streptococcus mutans ATCC 25175 y Lactobacillus acidophilus ATCC 4356.
Métodos
Tipo de estudio y muestra
Se realizó un estudio experimental in vitro de corte transversal, prospectivo y analítico. El estudio se llevó a cabo en los laboratorios de análisis de alimentos y de microbiología de la Universidad Privada de Tacna, durante los meses de septiembre del 2019 hasta abril del 2020. El número de repeticiones de los ensayos se calculó con el programa EPiInfoTM al comparar la media de estudios previos. Se establecieron ocho repeticiones para la actividad antibacteriana por medio de método de difusión de disco y tres repeticiones para la concentración mínima inhibitoria y concentración mínima bactericida. Al tratarse de un estudio in vitro fue exonerado por el comité de ética institucional y aprobado con resolución rectoral Nro. 959-2019-UPT-R.
Recolección de la planta
Se recolectaron 10 kg de M. mollis de la provincia de Tarata en la región altoandina de Tacna, Perú. La cosecha se realizó durante la estación primaveral (septiembre del 2019). Una muestra de la planta fue derivada al Departamento de Botánica de la Facultad de Ciencias de la Universidad Nacional Jorge Basadre Grohmann para su identificación taxonómica, bajo el registro 3103. La muestra se identificó como Mintostachys mollis (Griseb) L.
Extracción del aceite esencial
Las hojas y ramas frescas de M. mollis fueron sometidas a un sistema de arrastre por vapor por cuatro horas a 100 °C. Se obtuvo 40 mL del aceite esencial (AE) que fue almacenado en un frasco ámbar a 4 °C hasta su uso.
Cuantificación de la composición química
Para identificar los componentes químicos, el AE fue sometido a cromatografía de gases acoplada a espectrometría de masas (CG-EM). El análisis fue realizado en un equipo cromatográfico QP2010 Ultra Shimadzu con una columna de capilaridad de silica (30 m x 250 µm x 0,25 µm). La condición de análisis fueron las siguientes: la muestra fue diluida al 5 % en diclorometano e inyectado a 250 °C con un volumen de inyección de 1 µL a una razón de 1:75, la temperatura inicial de la columna fue ajustada a 40 °C, mantenida por dos minutos y calentada a 140 °C, con una razón de 3 °C/minuto; el calor fue incrementado a 250 °C una razón de 10 °C/minuto, mantenida por 20 minutos. Por último, fue calentada a 300 °C a una razón de 50 °C/minuto y mantenida por un minuto. Se empleó helio como gas de carga a un flujo constante de 1 mL/minuto. Las temperaturas de las líneas de transferencia fueron ajustadas a 250, 230 y 150 °C. Los componentes fueron identificados por su índice de retención y el espectro de masas reflejado por el número de picos en el cromatograma, que fueron comparados con la librería NIST 08.
Actividad antibacteriana
Se emplearon las cepas S. mutans ATCC® 25175™ y L. acidophilus ATCC® 4356™ obtenidas del American Type Culture Collection. La actividad antibacteriana se determinó por el método de difusión de disco. Los medios de cultivo fueron Agar cerebro-corazón (BHA, Liofilchem, Italia) para S. mutans y Agar MRS (Liofilchem, Italia) para L. acidophilus. Los medios fueron inoculados con una suspensión de 18 horas ajustada a una densidad de 108 UFC/mL que corresponde a la escala 0,5 de McFarland. Se emplearon discos de papel Whatman No. 3 estériles, de 5 mm de diámetro. Los discos fueron cargados con 10 µL del aceite esencial y cuatro discos fueron colocados en cada placa Petri. Se empleó clorhexidina al 0,12 % y agua destilada como control positivo y negativo. Las placas fueron incubadas a 37 °C por 48, en el caso de S. mutans en condiciones de microaerofilia y para L. acidophilus a 5 % de CO2 en un sistema Gaspack. Las zonas de inhibición fueron medidas con un compás digital (Ubermann©).
Concentración mínima inhibitoria y concentración mínima bactericida
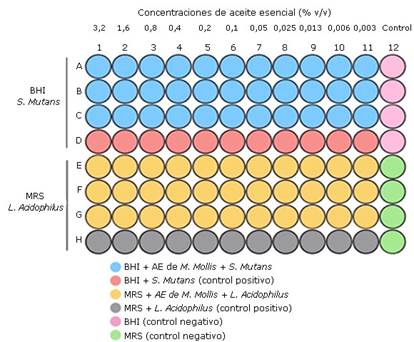
La concentración mínima inhibitoria (CMI) se determinó por el método de microdilución en placas de 96 pozos, de acuerdo a la metodología descrita por Eloff.18 Se prepararon cuatro soluciones diferentes para la prueba. La solución uno estuvo constituida por 5 mL de infusión cerebro-corazón (BHI), la solución dos por 160 µL del AE con 5 mL de BHI, la solución tres por 5 mL de caldo MRS y la solución cuatro por 160 de µL del aceite esencial con 5 mL de MRS. Las soluciones con el aceite esencial tuvieron una concentración de 3,2 % (v/v). El 50 mL de la solución uno se adicionó a todos los pozos A-D de la columna dos a la 12 y la solución tres en los pozos E-H de las mismas columnas. Para la columna uno, 100 µL de la solución dos fue adicionada en las filas A-C y 100 µL de la solución cuatro en los pozos E-G, se completó los pozos de la fila D de las columnas uno a la 11 con 100 mL de la solución uno, y en el caso de la fila H 100 mL de la solución tres.
Con una micropipeta multicanal, se transfirió 50 mL de todas las filas de la columna uno a la columna dos, y diluciones 1:2 fueron realizadas hasta la columna 11 con una concentración del aceite esencial de 3,2 a 0,003 % (v/v), los últimos 50 µL fueron descartados. Luego, 50 µL de un inóculo de S. mutans con una concentración de 1 x 108 UFC/mL fue adicionada a cada pozo de las filas A-C de las columnas uno a la 11, los pozos de E-G fueron llenados con 50 mL de MRS con 50 µL del inóculo de L. acidophilus. Los pozos de la columna 12 fueron completados con 50 mL de sus respectivas soluciones. El ensayo se realizó por triplicado, las microplacas fueron incubadas por 24 h a 37 °C. La presencia de turbidez en los pozos se consideró un indicador del crecimiento bacteriano. La CMI se determina como la mínima concentración en la cual no se observa turbidez en los pozos. Un esquema del procedimiento se muestra en la Fig. 1.
Para la determinación de la concentración mínima bactericida (CMB), placas Petri con BHA y MRS fueron inoculadas con 50 µL de la suspensión contenida en los pozos que no mostraron crecimiento bacteriano. Las placas fueron incubadas a 37 °C por 48 h, la CMB fue considerada como la mínima concentración capaz de inhibir el crecimiento de las bacterias, sin unidades formadoras de colonias (UFC). El ensayo se realizó por triplicado.
Análisis de los datos
Los datos fueron analizados con el programa SPSS para Mac OS en su versión 23.0 (Statistical Program Software System Inc., Chicago IL, USA). Se analizó la normalidad en la distribución de los datos con la prueba de Shapiro-Wilk y se verificó la homogeneidad de varianzas con la prueba de Levene. Se realizó la prueba ANOVA de un factor para comparar las medias de los grupos. El análisis de comparación intragrupos se realizó con la prueba post hoc de Tukey. El nivel de significación estadística fue ajustado al 5 % para todas las pruebas.
Resultados
Composición química del aceite esencial de M. mollis
El AE de M. mollis presentó una densidad de 1,03 ± 0,021 g/mL y un índice de refracción de 1,47 ± 0,15. Los componentes químicos y la cantidad relativa (%) del AE de M. mollis se detallan en la tabla 1. Se aislaron 10 constituyentes, los principales fueron: mentona (32,9 %) y eucaliptol (28,06 %).
Actividad antibacteriana
Los resultados del efecto antibacteriano del AE de M. mollis frente a S. mutans y L. acidophilus se muestran en la tabla 2. En este estudio el AE de M. mollis mostró gran actividad antibacteriana frente a las cepas testadas (Fig. 2), no se observaron diferencias significativas entre los halos de inhibición para S. mutans y L. acidophilus. Cuando se comparó los resultados con clorhexidina al 0,12 %, el efecto antibacteriano del AE frente a S. mutans fue similar (p > 0,05); sin embargo, para L. acidophilus sí se observaron diferencias. La clorhexidina al 0,12 % fue más efectiva para inhibir su crecimiento (p = 0,001).
Tabla 2 Actividad antibacteriana del aceite esencial de M. mollis; medición de halos de inhibición (mm)
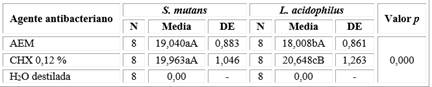
F = 1171,292 | AEM: Aceite esencial de M. mollis
La comparación intragrupos se realizó con la prueba post hoc de Tukey. Letras minúsculas diferentes entre las columnas representan diferencia significativa entre las cepas bacterianas. Letras mayúsculas diferentes entre las filas representan diferencias entre los agentes bacterianos (p > 0,05).
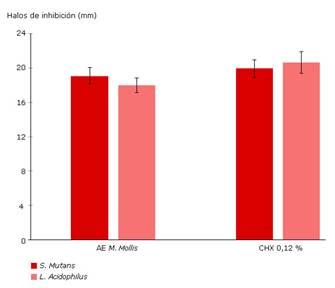
Fig. 2 Actividad antibacteriana del aceite esencial de M. mollis frente a S. mutans y L. acidophilus.
La CMI del AE de M. mollis fue de 1,6 % (v/v) para S. mutans, la misma concentración evitó la formación de UFC. En el caso de L. acidophilus, la CMI fue de 3,2 % (v/v) que fue la concentración más alta evaluada, esta concentración no fue capaz de evitar la formación de UFC (Tabla 3).
Discusión
M. mollis es una especie aromática que crece y se distribuye en la zona altoandina del Perú, aunque también puede ser encontrada en diversos países de América del Sur.4 Los AE son los principales bioproductos de las plantas medicinales, y se caracterizan por tener diversos componentes. Además, las propiedades biológicas de los AE se atribuyen a esta gran diversidad de constituyentes.19 Nuestros resultados mostraron que la evaluación a través de CG-EM del AE de M. mollis identificó 20 constituyentes, los más abundantes fueron mentona (32,9 %) y eucaliptol (28,06 %). Cano y otros9 identificaron pulegona (36,68 %) y mentona (24,24 %) como los principales constituyentes del AE de una muestra proveniente de zona andina central del Perú. Fuertes y Munguía20 identificaron los compuestos del AE de M. mollis (Kunth.) Griseb de tres regiones del Perú, donde: 1-tetradeceno (23,14 %), 2S-Trans.mentona (23,00 %) y pulegona (13,21 %) fueron los más importantes en la región Tarma; en Huaraz, 2S-Trans-mentona (41,48 %) y pulegona (16,02 %) fueron los más abundantes; y en Huancavelica fueron 2S-Transmentona (34,51 %) y pulegona (28,62 %). Peña y Gutiérrez21 encontraron valores menores para pulegona (8,82 %) y mentona (5,92 %) en esta última región. Nuestros resultados difieren de estos estudios, ya que no fue posible identificar pulegona en la muestra proveniente de la región Tacna, esto puede deberse a que la cantidad y variedad de los componentes dependen de factores como la procedencia, época de cosecha, condiciones ambientales y métodos de evaluación.7
Estudios previos han evaluado el efecto antibacteriano del AE de varias especies del género Minthostachys frente a cepas bacterianas como Bacillus subtilis, Salmonella typhi, Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, Helicobacter pylori y Pseudomonas aeruginosa, demostrando ser efectivo para inhibir su crecimiento.4,5,8 En la literatura, son pocos los estudios que evalúan la actividad antimicrobiana de este AE sobre especies de importancia odontológica. Aigaje-Sierra y otros10 evaluaron la actividad antibacteriana de tres concentraciones (25 %, 50 % y 100 %) del AE de M. mollis proveniente del Ecuador frente a Porphyromonas gingivalis, sus resultados demostraron que la concentración al 100 % fue la más eficiente, al generar halos de inhibición de 13,6 mm; sin embargo, fueron menores que los de la clorhexidina al 0,12 % (17,3 mm). Salas22 demostró el efecto antibiótico de diversas concentraciones del AE de M. mollis frente a Candida albicans, sus resultados indican que posee un efecto significativo al compararlo con fluconazol a una concentración de 1/250. El presente estudio encontró un efecto de inhibición del crecimiento bacteriano para las cepas estudiadas, en el caso de S. mutans el AE de M. mollis presentó un efecto similar al de la clorhexidina al 0,12 %; mientras que el efecto sobre L. acidophilus fue menor que el control (p < 0,05). Por otro lado, el aceite esencial de M. mollis a una concentración de 1,6 % (v/v) fue capaz de inhibir el desarrollo de S. mutans y fue bactericida a la misma concentración. Mientras que para L. acidophilus la concentración más alta evaluada fue capaz de inhibir el crecimiento bacteriano (3,2 %), sin demostrar efecto bactericida, ya que se evidenció el desarrollo de UFC; por lo que es necesario realizar otros ensayos que consideren concentraciones mayores del AE para verificar el efecto bactericida frente a L. acidophilus. Un aspecto por considerar es el hecho de haber empleado cepas bacterianas correspondientes al American Type Culture Collection, lo que sugiere la necesidad de evaluar las propiedades del AE de M. mollis frente a cepas nativas obtenidas de poblaciones donde la incidencia de caries dental sea alta.
Las propiedades antibacterianas del AE de M. mollis pueden deberse a sus principales constituyentes, como mentona y eucaliptol. Mentona es una ketona análoga del mentol, soluble en solventes orgánicos;23 eucaliptol es un monoterpeno y es el principal constituyente de muchas plantas aromáticas, como las del género E. globulus Lab.24 El eucaliptol ha sido empleado como antibacteriano y antiinflamatorio, siendo indicado para el manejo del sistema respiratorio. Kwiatkowski y otros25 demostraron que 1,8-cineole (eucaliptol) y (-)-mentona en combinación con mupirocina poseen actividad sinérgica frente a S. aureus susceptible a mupirocina.
Por otro lado, es necesario reconocer la toxicidad de los AE para establecer dosis y concentraciones que puedan ser empleadas en la formulación de productos farmacológicos. Así, Peña y Gutiérrez21 reportaron que el AE de M. mollis presenta una concentración letal media a dosis de 2941,811 mg/kg en ratones albinos. Escobar y otros26 identificaron que una dosis de 7 g/kg de peso de AE de M. verticillata administrado por 90 días a ratas Wistar no ejerció efecto citogenotóxico sobre la médula ósea ni en las células sanguíneas. Por lo que es necesario realizar otros ensayos para confirmar la empleabilidad de este aceite y sus derivados en el campo de la odontología.
Si bien, el uso de enjuagues bucales comerciales posee un importante efecto para el control de la biopelícula dental y contribuyen con la prevención de la formación de lesiones cariosas, es necesario el estudio de las propiedades de los productos naturales para identificar posibles constituyentes que puedan ser empleados en la formulación de nuevos derivados farmacológicos para la prevención y control de las caries dentales y otros padecimientos de orden médico u odontológico; esto, a su vez, favorece el estudio y la preservación de la biodiversidad de especies nativas.
En conclusión, los principales constituyentes del aceite esencial de M. mollis proveniente de la región altoandina de Tarata, en el sur del Perú, fueron mentona y eucaliptol. Además, el aceite esencial demostró poseer actividad antibacteriana frente a las cepas de S. mutans y L. acidophilus.