Introducción
En Cuba, el cáncer constituyó la segunda causa de muerte con más de 25 000 defunciones en 2019 y 2020, y los tumores malignos GI son responsables de un número considerable de ellos.1,2) La incidencia de éstos representó el 15,9 % de los cánceres que ocurren en Cuba en el período 2015 a 2017. De éstos, poco más de 70 % se concentró en las localizaciones topográficas de colon, estómago, esófago y páncreas. El 25,2 % de la mortalidad por cáncer en Cuba se atribuye a tumores malignos del tracto digestivo. Al igual que la incidencia, 78,3 % se concentra en las localizaciones topográficas de colon, estómago, esófago y páncreas.3)
El cáncer de páncreas (CP) ocupa el duodécimo lugar en incidencia, pero es el séptimo en mortalidad general, a nivel mundial.3) El riesgo de enfermar y morir por este tumor maligno en Cuba es inferior a la tasa mundial y a la del Caribe. 3-6) La falta de estrategias de cribado y detección temprana, da como resultado un estadio avanzado del cáncer al momento del diagnóstico con un 55% de casos diagnosticados en estadio IV.7) En el caso de Cuba, solo 15% de los pacientes se estadifican como etapas I-II. 3)
La quimioterapia se ha consolidado como tratamiento de referencia en pacientes con CP avanzado y consigue un modesto beneficio tanto en supervivencia (SV), supervivencia libre de progresion (SLP), como en control sintomático cuando se compara con el mejor tratamiento de soporte.8) La QT combinada a gemcitabina mejora significativamente la SV en pacientes con CP avanzado, pero también aumenta los eventos adversos.9) Los esquemas de combinación de quimioterapia como el nab-paclitaxel más gemcitabina o de fluouracilo con oxaliplatino e irinotecan (FOLFIRINOX) obtienen SV entre 9 y 11 meses, y son considerados tratamientos estándares para pacientes con CP avanzado, pero su efectividad se limita fundamentalmente a pacientes con buen estado general.10)
En el 2012, en el servicio de oncología clínica del Hospital “Hermanos Ameijeiras” se protocoliza el tratamiento sistémico de pacientes con CP avanzado para recibir esquema de QT con GEMOX, dada la evidencia aportada por el estudio de meta análisis de Hu y colaboradores,11) y como alternativa terapéutica al no disponer en los primeros años de irinotecan o nab-paclitaxel (en toda la región de Centroamérica y Caribe). Un artículo recientemente publicado y realizado en condiciones de práctica clínica, obtiene tasas óptimas de control de enfermedad y SV con la combinación de GEMOX al nimotuzumab.12)
El mal estado inmuno-nutricional del paciente oncológico ha demostrado estar relacionado con mayor número de complicaciones pos-quirúrgicas, así como incremento de la toxicidad por QT y disminución de la respuesta terapéutica y SV global en pacientes con tumores avanzados.13,14 El índice pronostico nutricional (IPN), evalúa el estado inmuno-nutricional de los pacientes a partir de los valores de albúmina y linfocitos, y ha sido ampliamente estudiado en diferentes localizaciones tumorales en las cuales ha mostrado que su disminución está asociada a peor pronóstico de SV.15 El objetivo del presente estudio es evaluar la capacidad del IPN como factor pronóstico de SV en pacientes con CP en etapas avanzadas.
Métodos
Se realizó un estudio observacional, retrospectivo, analítico, y longitudinal en pacientes con diagnóstico de cáncer avanzado de páncreas atendidos en el Servicio de Oncología Clínica del Hospital Clínico Quirúrgico "Hermanos Ameijeiras", en el período de enero de 2014 hasta diciembre de 2019. El universo quedó constituido por todos los pacientes con diagnóstico de cáncer de páncreas en estadios avanzados y/o irresecables (n= 249). La muestra incluida en el estudio debió cumplir con los criterios de selección: edad >18 años, diagnóstico confirmado cito/histológico de adenocarcinoma ductal, haber sido discutida su conducta en grupo multidisciplinario, y que recibieran tratamiento de quimioterapia con oxaliplatino y gemcitabina (GEMOX), combinado a nimotuzumab, con adecuado seguimiento. La muestra quedó constituida por 118 pacientes. No se incluyeron 131 pacientes debido a: solo tratamiento paliativo (n=39), quimioterapia con otros esquemas (n=88), y cuatro pacientes que una vez diagnosticados, y tomada la decisión terapéutica, abandonaron antes de iniciar el tratamiento propuesto.
Fueron realizados los estudios de extensión, estadificación y confirmación diagnóstica acorde al protocolo de actuación para esta enfermedad neoplásica aprobada en el hospital. Se realizó examen clínico, exámenes hematológicos y hemoquímicos, ecografía (US) abdominal/pélvica, Rx de tórax, y tomografía axial computarizada (TAC) torácica, abdominal y pélvica (simple y contrastada) en todos los pacientes. La laparoscopia se realizó para detectar nódulos peritoneales y hepáticos, e identificar los pacientes con enfermedad irresecable. La colangiografía retrógrada endoscópica, solo se realizó en casos de obstrucción completa o estenosis del conducto pancreático (con ictericia), para colocación de una endo-prótesis. La confirmación cito o histopatológica guiada o no por ecografía y/o TAC se realizó en todos los casos de la serie. Los exámenes hematológicos y hemoquímicos empleados en la investigación fueron realizados siete días previos al inicio de la QT.
Plan de Tratamiento
Una vez realizada la estadificación, se valoró en consulta multidisciplinaria de la Unidad Funcional de Tumores Digestivos. Cuando en la discusión colectiva se declaró que el paciente era irresecable, y que no era tributario de tratamiento local (cirugía y/o radioterapia) con intención curativa, se decidió la aplicación de quimioterapia que fue determinada en base a los factores siguientes: estado general, función de órganos vitales, enfermedades asociadas, posibilidad de adherencia al tratamiento propuesto, preferencias del paciente, y tolerancia que pudiera tener el paciente. El esquema de quimioterapia GEMOX, consistió en infusión intravenosa de gemcitabina (1000 mg/m²) días 1 y 8, y la infusión de oxaliplatino (85 mg/m²) día 1, cada tres semanas, por ocho ciclos. El nimotuzumab (200 mg) se administró por vía intravenosa, cada catorce días, hasta que las condiciones del enfermo lo permitiesen, a juicio del médico tratante.
Índice pronóstico nutricional (IPN)
Para la determinación del IPN, se emplearon los valores del conteo absoluto de linfocitos y los niveles de albúmina sérica previa al comienzo del tratamiento con QT, en ausencia de infección. Se empleó la fórmula: 10 x albúmina (g/dL) + 0,005 x linfocitos (mm3). Luego se empleó la mediana de los valores obtenidos para IPN (40) para categorizar en dos grupos: buen pronóstico (≥40) y peor pronóstico (<40).
Variables relacionadas con el paciente
Edad: ≤ 60 años y > 60 años.
Sexo: masculino y femenino.
Color de la piel: blanca y no blanca.
Hábito tabáquico: no y sí.
Escala ECOG: 0 y ≥1.
Índice de masa corporal: Se calculó el IMC según la fórmula: IMC= peso (kg)/talla (m2). Se categorizó en: ≤18,5 kg/m², 18,5-24,9 kg/m² y >25 kg/m².
Albúmina sérica: ≤ 35 g/L y > 35 g/L.
Conteo de plaquetas: ≤ 400 x 109 y > 400 x109.
Conteo de linfocitos: <1000/mm³ y ≥1000/mm³.
Evaluación de respuesta
La evaluación de respuesta se realizó según criterios RECIST.16 Se evaluó a las ocho semanas del comienzo de quimioterapia. Los pacientes que fallecieron antes del periodo establecido para la primera evaluación se consideraron como progresores. Si se realizó la necropsia, entonces se tomó como respuesta el resultado de la misma, y como fecha de evaluación, la del fallecimiento. A los efectos prácticos, se agrupó bajo el término de índice de control de enfermedad, los pacientes que alcanzaron respuesta parcial o estabilización de enfermedad.
Procedimientos para el análisis de la información
Se revisaron las historias clínicas y planillas de tratamiento de pacientes diagnosticados y tratados por cáncer de páncreas. Se confeccionó una base de datos en programa Excel que se procesó con la ayuda del paquete estadístico SPSS-v.20.0. Se emplearon medidas de resumen para las variables cualitativas, frecuencias absolutas y relativas expresadas en porcentajes, además de la prueba estadística Chi-cuadrado de Pearson (x 2) como método de análisis para evaluar la asociación entre variables. Se estimó la probabilidad de supervivencia global mediante el empleo del método de Kaplan Meier. Para la comparación de las diferentes curvas se empleó la prueba de Log-Rank. Se realizó análisis de regresión de Cox para evaluar las relaciones de asociación entre la supervivencia global y las características clínico-patológicas. Se empleó el método de Spearman para el análisis de correlación entre variables cuantitativas independientes. En todas las pruebas se fijó un nivel de significación de 0.05, con un intervalo de confianza (IC) de 95 %.
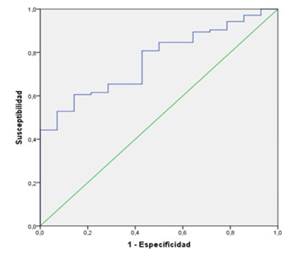
La capacidad pronóstica del IPN se evaluó mediante la curva ROC (Receiver Operating Characteristic, por sus siglas en inglés). Se estimó, puntualmente y por intervalo de confianza de 95 %, el área bajo la curva, y la sensibilidad, especificidad y valores predictivos para distintos puntos de corte de probabilidad de morir. El análisis epidemiológico de datos tabulados se realizó mediante Epidat 3.1, para su análisis.
Aspectos éticos
El protocolo de investigación fue evaluado y aprobado por el Consejo Científico y el Comité de Ética para la Investigación del HHA. Los procederes terapéuticos aplicados a los pacientes fueron explicados inicialmente y contaron con la aprobación del paciente mediante la firma del consentimiento informado asistencial. En caso de realizar algún cambio en el tratamiento, y como parte del protocolo de actuación asistencial de atención a esta enfermedad, le fue explicado al paciente y familiares. De ahí que no fuera necesario solicitar al paciente, un consentimiento informado específicamente para esta investigación. Se respetó la privacidad, confidencialidad e integridad de los datos obtenidos de los pacientes con la responsabilidad y obligación de no divulgar la identidad de los mismos.
Resultados
Al evaluar la capacidad pronóstica de mortalidad del IPN, se halló un área bajo la curva (ABC) ROC de 0,765. La figura 1 y tabla 1 se resumen los valores de sensibilidad, especificidad, valor predictivo positivo y negativo para cada uno de los índices de acuerdo al punto de corte establecido (mediana = 40).
Tabla 1 Parámetros de evaluación de exactitud diagnóstica de IPN según curva ROC.
| Característica | IPN (IC95%) |
| Punto de Corte | 40 |
| ABC | 0,693 (0,56-0,82) |
| Valor p | 0,019 |
| Sensibilidad (%) | 52,9 (42,8-63,0) |
| Especificidad (%) | 85,7 (63,8-100,0) |
| VPP (%) | 96,5 (90,8-100,0) |
| VPN (%) | 19,7 (8,9-30,5) |
| Exactitud (%) | 56,8 (47,4-66,1) |
IPN: índice pronóstico nutricional; ABC: área bajo la curva; VPP: valor predictivo positivo; VPN: valor predictivo negativo; p: significación estadística; ( ): intervalo de confianza al 95 %.
La tabla 2 muestra el comportamiento de las variables relacionadas con el paciente. La mediana de edad de la serie fue 58 años (min: 32; máx: 64). Hubo un predominio del sexo masculino (relación 1,6:1), los menores de 60 años de edad, color de piel blanca, ECOG 1, y antecedentes tabáquicos (relación 2:1). La mayoría de los pacientes presentaron índices de masa corporales en el rango de normopeso (mediana de 22,8 kg/m²), y niveles de albúmina sérica en rangos de normalidad (mediana de 40,0 g/L) (min: 19; máx: 54). La mediana de conteo de plaquetas fue 259 (min: 119; máx: 809), mientras que la medianas de conteo de linfocitos fue 1598,0 x mm³ (720; 3800). Las variables mayormente asociadas de forma significativa con IPN altos son los pacientes con sesenta años o menos (x² < 0,001); ECOG cero (x² = 0,004); IMC ≥25 Kg/m2 ;(x² = 0,003) y albúmina sérica >3,5g/dL (x² < 0,001). EL 57,3 % de los pacientes con tumores de localización predominantemente cefálica tienen IPN ≥ 40, pero no alcanzan la significación estadística (x² = 0,065).
Tabla 2 Asociación entre características clínico-patológicas y valores de IPN.
| Característica | n | % | IPN | ||
| <40 (%) | ≥40 (%) | x² | |||
| Total | 118 | - | 57 (48,3) | 61 (51,7) | |
| Edad | |||||
| ≤60 años | 69 | 58,5 | 24 (34,8) | 45 (65,2) | <0,001 |
| >60 años | 49 | 41,5 | 33 (67,3) | 16 (32,7) | |
| Sexo | |||||
| Masculino | 72 | 61,0 | 31 (43,1) | 41 (56,9) | 0,153 |
| Femenino | 46 | 39,0 | 26 (56,5) | 20 (43,5) | |
| Color de Piel | |||||
| Blanco | 71 | 60,2 | 34 (47,9) | 37 (52,1) | 0,911 |
| Negro | 47 | 39,8 | 23 (48,9) | 24 (51,1) | |
| Tabaquismo | |||||
| Si | 79 | 66,9 | 38 (48,1) | 41(51,9) | 0,950 |
| No | 39 | 33,1 | 19 (48,7) | 20 (51,3) | |
| ECOG | |||||
| 0 | 33 | 28,0 | 9 (27,3) | 24 (72,7) | 0,004 |
| ≥1 | 85 | 72,0 | 48 (56,5) | 37 (43,5) | |
| Índice de Masa Corporal | |||||
| <18,5 Kg/m2 | 15 | 12,7 | 12 (80,0) | 3 (20,0) | 0,003 |
| 18,5-24,9 Kg/m2 | 66 | 55,9 | 34 (51,5) | 32 (48,5) | |
| ≥25 Kg/m2 | 37 | 31,4 | 11 (29,7) | 26 (70,3) | |
| CA 19.9 | |||||
| ≤ 740 U/L | 73 | 61,9 | 33 (45,2) | 40 (54,8) | 0,391 |
| > 740 U/L | 45 | 38,1 | 24 (53,3) | 21 (46,7) | |
| Albúmina | |||||
| ≤3,5 g/dL | 28 | 23,7 | 28 (100,0) | 0 | <0,001 |
| >3,5g/dL | 90 | 76,3 | 29 (32,2) | 61 (67,8) | |
| Linfocitos | |||||
| <1000/mm3 | 17 | 14,4 | 10 (58,8) | 7 (41,2) | 0,348 |
| ≥1000/mm3 | 101 | 85,6 | 47 (46,5) | 54 (53,5) | |
| Plaquetas | |||||
| <400.000/mm3 | 98 | 83,1 | 47 (48,0) | 51 (52,0) | 0,868 |
| ≥400.000/mm3 | 20 | 16,9 | 10 (50,0) | 10 (50,0) | |
| Localización predominante | |||||
| Cabeza | 82 | 69,5 | 35 (42,7) | 47 (57, 3) | 0,065 |
| Cuerpo-Cola | 36 | 30,5 | 22 (61,1) | 14 (38,9) | |
| Clasificación T | |||||
| T3 | 57 | 48,3 | 26 (45,6) | 31 (54,4) | 0,572 |
| T4 | 61 | 51,7 | 31 (50,8) | 30 (49,2) | |
| Afectación Ganglionar | |||||
| Si | 89 | 75,4 | 45 (50,6) | 44 (49,4) | 0,390 |
| No | 29 | 24,6 | 12 (41,4) | 17 (58,6) | |
| Metástasis | |||||
| Si | 67 | 56,8 | 34 (50,7) | 33 (49,3) | 0,543 |
| No | 51 | 43,2 | 23 (45,1) | 28 (54,9) | |
Leyenda: ECOG: escala de la Eastern Cooperative Oncology Group; T: tumor; IPN: índice pronóstico nutricional; x²: chi cuadrado.
En el análisis univariado, el tabaquismo (HR: 1,6; IC95%: 1,08-2,46; p=0,020), la localización tumoral en cuerpo y cola del páncreas (HR: 1,7; IC95 %: 1,13-2,66; p=0,011), el nivel de albúmina ≤3,5 g/dL (HR: 2,1; IC95 %: 1,37-3,38; p=0,001), el IPN< 40 (HR: 2,0; IC95 %: 1,31-2,91; p=0,001) y la presencia de metástasis (HR: 2,8; IC95 %: 1,78-4,26; p=0,001) fueron variables asociadas a peor SV global en los pacientes. Al realizar el análisis multivariado, solamente la localización tumoral en cuerpo y cola del páncreas (HR: 1,7; IC95 %: 1,11-2,68; p=0,016), el IPN< 40 (HR: 1,7; IC95%: 1,13-2,60; p=0,011) y la presencia de metástasis (HR: 2,6; IC95 %: 1,62-4,20; p<0,001) fueron factores pronósticos independientes relacionados con la SV global. (Tabla 3)
Tabla 3 Regresión de Cox. Análisis univariado y multivariado de las caracteristicas clinico-patologicas con relacion a pobre supervivencia
| Caracteristica | Analisis Univariado | Analisis Multivariado | ||||
| HR | IC 95% | p | HR | IC 95% | p | |
| Edad > 60 años | 1,3 | 0,89-1,94 | 0,170 | - | - | - |
| Sexo Masculino | 1,1 | 0,76-1,66 | 0,565 | - | - | - |
| Color de Piel Blanca | 0,8 | 0,55-1,20 | 0,285 | - | - | - |
| Hábito tabáquico | 1,6 | 1,08-2,46 | 0,020 | 1,3 | 0,86-2,03 | 0,198 |
| ECOG ≥ 1 | 1,5 | 0,99-2,38 | 0,055 | - | - | - |
| Localización en cuerpo y cola de páncreas* | 1,7 | 1,13-2,66 | 0,011 | 1,7 | 1,11-2,68 | 0,016 |
| CA 19-9 >740 U/L | 1,4 | 0,95-2,13 | 0,089 | - | - | - |
| Albúmina (≤3,5 g/dL) | 2,1 | 1,37-3,38 | 0,001 | NA | - | - |
| Linfocitos (<1000/mm3) | 1,2 | 0,75-2,14 | 0,374 | - | - | - |
| Plaquetas (≥400.000/mm3) | 0,9 | 0,53-1,57 | 0,761 | - | - | - |
| IPN < 40 | 2,0 | 1,31-2,91 | 0,001 | 1,7 | 1,13-2,60 | 0,011 |
| Categoría T (T4) | 1,4 | 0,97-2,12 | 0,068 | - | - | - |
| Categoría N (N+) | 1,5 | 0,92-2,30 | 0,108 | - | - | - |
| Categoría M (M1) | 2,8 | 1,78-4,26 | 0,001 | 2,6 | 1,62-4,20 | <0,001 |
HR: “hazard ratio”- tasa de riesgo; IC: intervalo de confianza; ECOG: Eastern Cooperative Oncology Group; *: localización predominante dentro del páncreas; NA: no aplicable; IPN: índice pronóstico nutricional; T: tumor; N: ganglios regionales; M: metástasis; CA 19-9 (rango: hasta 37 U/L) 740=20 x límite superior normal.
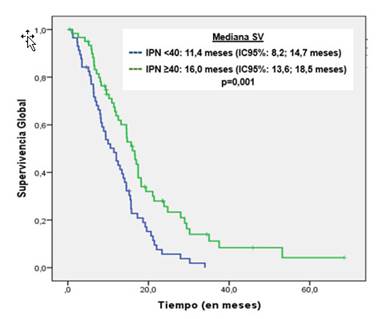
La mediana de SV fue de 13,4 meses (IC95 %-11,7; 15,8). Con respecto a la SV global, se observó que los pacientes con IPN < 40 alcanzaron una SV significativamente más baja respecto a los pacientes con IPN ≥ 40 (11,4 meses frente a 16,0 meses; p=0,001). (Fig. 2).
El índice de control de enfermedad (ICE) de nimotuzumab combinado a quimioterapia con esquema GEMOX fue 44,9 % [respuesta parcial-16,1 %, y enfermedad estable-28,8 %]. La mediana de SV en pacientes con control de la enfermedad (Fig. 3A) e IPN ≥ 40 aventaja en diez meses a aquellos con IPN < 40. (p=0,001). A pesar de la progresión de la enfermedad (Fig. 3B), los pacientes con IPN ≥ 40 tienen una discreta superioridad en mediana de SV sobre los pacientes con IPN < 40, aunque no es significativa (p=0,077).
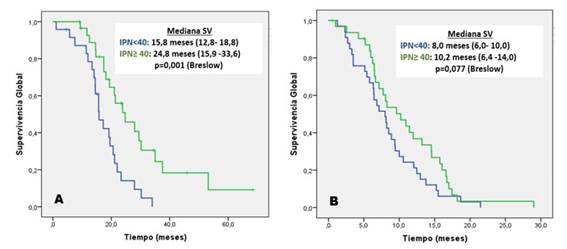
Fig. 3 Supervivencia (SV) global por tipo de respuesta según índice pronóstico nutricional (IPN). A. Índice de control de enfermedad; B. Progresión. ( ): Intervalo de confianza al 95 %.
En la tabla 4 se observa que los pacientes con IPN ≥ 40 tienen medianas de SV más altas que los pacientes con IPN < 40 en la inmensa mayoría de las variables seleccionadas con p < 0,05, excepto en el índice de masa corporal. De forma general, las mayores variaciones de SV entre los grupos (más de cinco meses) se observaron en variables como: sexo masculino, no hábitos tabáquicos, conteo de plaquetas > 400 x109, CA 19-9 ≤ 740 U/L, y no extensión metastásica.
Tabla 4 Supervivencia de índice pronóstico nutricional (IPN) según variables seleccionadas.
| n | IPN < 40 | IPN ≥ 40 | P ** | ||
|---|---|---|---|---|---|
| Mediana SV (meses) (IC-95%) | Mediana SV (meses) (IC-95%) | ||||
| Edad | ≤ 60 años | 69 | 12,5 (5,3;19.7) | 16,6 (13,6;19,6) | 0,09 |
| > 60 años | 49 | 10,0 (7,7;12,3) | 14,6 (12,4;16,8) | ||
| Sexo | Masculino | 72 | 9,4 (5,6;13,2) | 15,7 (12,6;18,8) | 0,002 |
| Femenino | 46 | 13,8 (11,9;15,7) | 16,0 (9,4;22,6) | ||
| Color de la piel | Blanca | 71 | 12,03 (6.2;17,8) | 16,7 (14.1;19,3) | 0,005 |
| No Blanca | 47 | 10,6 (7,2;13,9) | 14,7 (10,6;18,9) | ||
| Hábito tabáquico | No | 39 | 13,4 (11,1;15,8) | 23,9 (12,1;35,6) | 0,005 |
| Sí | 79 | 9,4 (5,4;13,5) | 13,2 (9,1;17,3) | ||
| ECOG | 0 | 33 | 12,5 (11,2;13,7) | 16,6 (13,4;19,8) | 0,050 |
| 1-2 | 85 | 10,0 (6,1;13,9) | 14,6 (10,9;18,3) | ||
| Índice de masa corporal* | ≤18,5 | 15 | 6,3 (4,5;8,2) | ---- | 0,059 |
| 18,5-24,9 | 66 | 12,0 (7,0;17,1) | 15,7 (13,1;18,4) | ||
| >25 | 37 | 13,0 (7,4;18,6) | 17,0 (12,7;21,3) | ||
| CA 19-9 | ≤ 740 U/L | 73 | 12,0 (7,8;16,3) | 17,4(13,4;21,5) | 0,003 |
| > 740 U/L | 45 | 9,4 (3,2;15,7) | 12,5 (9,7;15,4) | ||
| Conteo de plaquetas | ≤ 400 x109 | 98 | 11,4 (8,3; 14,5) | 15,7 (13,0;18,5) | 0,002 |
| > 400 x109 | 20 | 9,4 (3,5;15,3) | 16,7 (7,0;26,4) | ||
| T | T3 | 57 | 12,5 (7,8;17,1) | 17,0 (15,9;18,1) | 0,009 |
| T4 | 61 | 9,4 (5,8;13,0) | 12,5 (9,7;15,3) | ||
| N | Negativos | 29 | 12,0 (6,2;17,9) | 16,6 (10,5;22,7) | 0,005 |
| Positivos | 89 | 10,6 (6,8;14,4) | 15,7 (10,7;20,7) | ||
| M | No | 51 | 15,7 (11,7;19,6) | 21,4 (13,7;29,1) | 0,005 |
| Sí | 67 | 8,0 (6,4;9,6) | 12,0 (8,9;15,0) | ||
|
Localización *** |
Cabeza | 82 | 12,5 (6,8;18,1) | 17,0 (14,2;19,8) | 0,007 |
| No cefálico | 36 | 8,5 (4,6;12,4) | 14,6 (2,0;21,2) | ||
Leyenda: ECOG: escala de la Eastern Cooperative Oncology Group; IPN: índice pronóstico nutricional; SV: supervivencia; IC: intervalo de confianza; *: en kg/m²; ** Test de Breslow; ( ): intervalo de confianza al 95%; T: tumor; N: ganglios regionales; M: metástasis; ***: localización predominante; CA 19-9 (rango: hasta 37 U/L) 740=20 x límite superior normal.
Discusión
Los resultados obtenidos en la presente investigación demuestran que existe una menor supervivencia global en los pacientes con CP avanzado que presentan un bajo IPN. Estos resultados coinciden con lo reportado en otras investigaciones llevadas a cabo no solo en pacientes con CP, sino también en carcinoma epidermoide de esófago, cáncer de colon, pulmón, mama y gástrico. (15
La inflamación es una característica reconocida del cáncer y contribuye sustancialmente al desarrollo y progresión, incluida la proliferación y supervivencia, angiogénesis, metástasis y respuesta al tratamiento. (17) Las células inflamatorias promotoras de tumores incluyendo subtipos de macrófagos, mastocitos, neutrófilos y linfocitos T y B.17,18) La inflamación sistémica se considera un indicador importante de mal pronóstico en el CP. La estructura tisular desmoplásica de este, resulta de procesos inflamatorios que son inducida por células tumorales y del estroma. Por lo tanto, un tumor maligno puede conducir a un incremento de mediadores inflamatorios, como las citocinas interleucina-1, interleucina-6 y TNF-a.18,19) La secreción prolongada o excesiva de estas citocinas pueden tener diversos efectos relacionados con anorexia y caquexia, como el agotamiento de las existencias de grasa, un aumento en la degradación de proteínas en el músculo esquelético y de síntesis de proteínas de fase aguda como la proteína C reactiva (PCR).20
Onodera y colaboradores, propusieron un índice (IPN) que fue implementado inicialmente para la evaluación del estado nutricional e inmunológico de pacientes con tumores gastrointestinales previo a tratamientos quirúrgicos.21) La asociación del conteo absoluto de linfocitos y concentración de albúmina en un mismo índice puede ayudar al conocimiento del estado inmuno-nutricional del paciente, de una manera fácil y poco costosa, y también ha sido estudiado en diferentes escenarios no quirúrgicos en pacientes oncológicos.
En la presente serie, un IPN bajo mostró ser un factor pronóstico independiente relacionado con una peor SV global en pacientes con enfermedad avanzada que recibieron tratamiento con QT. Los niveles bajos de albúmina han mostrado ser un predictor de severidad en diversas neoplasias, lo cual concuerda con lo obtenido en esta investigación donde la hipoalbuminemia (≤3,5 g/dL) demostró ser un factor asociado a pobre SV global (HR: 2,1; 1,37-3,38; p=0,001). Con respecto al conteo de linfocitos, se ha demostrado que la linfopenia es un predictor de pobre supervivencia en pacientes con cáncer de páncreas, ya que desempeñan un rol fundamental en la respuesta inmune contra las células tumorales.19 En la serie de pacientes estudiada, la linfopenia no mostró ser un factor asociado a pobre supervivencia. Lee y colaboradores,23) en un estudio retrospectivo que incluyó 499 pacientes con cáncer de páncreas en diferentes estadios de la enfermedad, no encontró que la linfopenia estuviera asociada a peor supervivencia global, en cambio, la hipoalbuminemia mostró ser un factor relacionado con pobre supervivencia en pacientes con enfermedad metastásica, no así, en pacientes con tumores resecables. (24
Se ha demostrado que los pacientes con enfermedad metastásica presentan mayor pérdida de peso y menor IPN que aquellos que no presentan metástasis. En la presente serie de pacientes se observó una asociación significativa del IPN con el índice de masa corporal (IMC) y el estado ECOG. En pacientes metastásicos, se observó también una asociación significativa entre IMC el por ciento de pacientes con IMC e IPN bajo (p=0,040) (datos no mostrados). La desnutrición es un problema frecuente y grave en los pacientes con CP debido a insuficiencia pancreática exocrina, anorexia, quimioterapia y/o progresión tumoral.17,18) En muchos casos, tiene efectos negativos sobre la calidad de vida o el pronóstico. Las citocinas proinflamatorias como el TNF-a juegan un papel destacado en la patogénesis de la desnutrición. TNF-a es un importante mediador de la inflamación, que afecta tanto a la destrucción del tejido y la recuperación del daño.18) Puede inhibir selectivamente la expresión genética de la albúmina previa a la pérdida de peso, así como el desarrollo de hipotrofia. Por otra parte, induce el agotamiento de los lípidos, a través de la inhibición de la lipoproteína lipasa o por estimulación de la lipólisis, aunque su papel en el síndrome de anorexia-caquexia permanece controvertido. (25
Una evaluación nutricional es un paso en el manejo global de todos los pacientes con cáncer para distinguir pacientes desnutridos y no desnutridos. Por lo tanto, dado que mantener o mejorar el nivel de IPN puede conducir a tratamiento adecuado a largo plazo inclusive, después de la recurrencia, una intervención continua como el apoyo nutricional o el control por largos períodos de tiempo pueden ser cruciales para mejorar el pronóstico del paciente.26) Sin embargo, dado que hay evidencia médica limitada para respaldar esta hipótesis, se necesitan más estudios que incluyan mediciones seriadas en el tiempo del IPN, y no solamente, las mediciones basales, previo al tratamiento con QT, como el que mostramos en la presente investigación.
En un artículo previamente publicado en este mismo grupo de pacientes demostró el valor del índice neutrófilo-linfocito (INL) como factor pronóstico, pero no se evaluaron otros índices de inflamación sistémica.27) El mecanismo subyacente del potencial valor pronóstico del INL está principalmente en el significado del infiltrado neutrofílicos y linfocitario en el tejido tumoral. La respuesta sistémica inflamatoria promovida por las células tumorales, provoca infiltración de neutrófilos, los cuales promueven la progresión a través de producción de sustancias pro-inflamatorias como la interleuquina-2, interleuquina-6, interleuquina-10, factor de necrosis tumoral y factor de crecimiento del endotelio vascular.28
Las correlaciones entre IPN y los índices inmunológicos se analizan en otro estudio retrospectivo de Geng y colaboradores, que incluyó a 321 pacientes con CP localmente avanzado y metastásico, donde el IPN se correlaciona negativamente con INL, índice plaqueta-linfocito (IPL) y TNF-alfa, y positivamente con el índice linfocito-monocito.29) Los índices basados en PCR, como el índice pronóstico de Glasgow modificado (IPGm) y los índices inmuno-hematológicos (INL o IPL) ya se habían investigado ampliamente en pacientes con CP.30) Desafortunadamente, solo 52 pacientes (44,1 %) tuvieron exámenes de PCR al diagnóstico, por lo que no pudimos evaluar el valor predictivo del IPGm.
También se ha estudiado la correlación que existe entre altos niveles de LDH y los marcadores sistémicos inflamatorios. La elevación de LDH se relaciona con mayor actividad y progresión tumoral, asociado a SV como factor pronóstico independiente, sobretodo en pacientes con enfermedad avanzada.31
La presente investigación mostró los hallazgos consistentes con otros estudios previos, en los que el IPN, puede predecir la SV global.13,15,32 Se realiza una agrupación de los pacientes en dos grupos de riesgo, donde se tiene en cuenta los valores de la mediana de IPN. Se demostró que el grupo de pacientes que presenta un IPN bajo presenta peores resultados de SV que aquellos pacientes que tienen un IPN ≥ 40. Reconocer este subgrupo de pacientes puede ser de utilidad en la práctica clínica ya que pudieran requerir de intervenciones terapéuticas más intensas y mayor uso de terapias de soporte para mejorar el estado inmuno-nutricional y obtener resultados terapéuticos adecuados. Las investigaciones realizadas tanto en pacientes con CP como en otras neoplasias malignas utilizan puntos de corte que varían entre 40 y 50.32 Por tanto, el punto de corte ideal de este marcador necesita ser validado en futuros estudios prospectivos a gran escala. 32
Independientemente de que el tamaño muestral sea relativamente pequeño y el diseño retrospectivo del estudio, la presente investigación confirma que la disminución del IPN por debajo de 40, previo al inicio del tratamiento con QT en pacientes con CP en etapas avanzadas se asocia a una SV significativamente menor, tanto de forma global, como en cada una de las variables seleccionadas en el estudio. Además, se demuestra que el IPN representa un factor pronóstico independiente relacionado con la SV global. Esta puede ser una herramienta sencilla y práctica para clasificar pacientes con una mayor probabilidad de mortalidad temprana, y por ende, de peor pronóstico que requieren manejos diferentes a los utilizados hasta el momento.