Introducción
Tithonia diversifolia (Hemsl) A. Gray es una planta forrajera, proteica, no leguminosa, perteneciente a la familia Asteraceae. Con su utilización en la alimentación animal, se obtienen numerosos beneficios por su valor nutricional y diversidad en su composición química (Mabou-Tagne et al., 2018). Según informes de Galindo et al. (2017), su uso en la dieta animal hace posible la reducción de metanógenos y tiene efectos benéficos en la ecología microbiana ruminal. Lezcano-Más et al. (2016) plantearon que contribuye a la disminución de la carga parasitaria en bovinos jóvenes.
Esta planta originaria de Centroamérica ha sido objeto de estudio en la medicina natural y tradicional por sus múltiples propiedades, derivadas de su metabolismo secundario. Se ha descrito recientemente su aplicabilidad como antimicrobiano y antiinflamatorio (Sousa et al., 2019) para combatir la malaria (Afolayan et al., 2016), la diabetes (Sari et al., 2018) y el cáncer (Di Giacomo et al., 2015). Además, se ha empleado como abono verde por su rápido crecimiento, alta capacidad de fijar nitrógeno y acumulación de fósforo, con efecto positivo en suelos pobres (Scrase et al., 2019). También constituye una alternativa para el control de insectos, ya que ha mostrado actividad insecticida contra hormigas cortadoras de hojas (Pantoja-Pulido et al., 2017).
Esta investigación tuvo como objetivo caracterizar, cualitativa y cuantitativamente, los principales metabolitos presentes en los extractos de hojas, tallos y raíces de T. diversifolia, así como determinar la capacidad antioxidante total de las diferentes partes de la planta.
Materiales y Métodos
Obtención del material vegetal. Las hojas, los tallos tiernos y las raíces de T. diversifolia se recolectaron en la finca de un productor, ubicada en los 22°49’50,0”N y 81°01’05,3”W, en la provincia de Matanzas, Cuba.
Preparación de los extractos. Las muestras se lavaron y secaron en estufa a 50°C, durante 24 h para las hojas y por 72 h para los tallos y las raíces (López et al., 2006). El material vegetal, seco y molido, se sometió a maceración pasiva con etanol durante 24 h (tres veces). Posteriormente, se filtraron al vacío y el solvente se retiró mediante un rotoevaporador (López et al., 2006). Los ensayos se realizaron con extractos etanólicos de hojas, tallos y raíces de T. diversifolia, en el laboratorio de Biotecnología de la Estación Experimental de Pastos y Forrajes Indio Hatuey, en Matanzas, Cuba.
Tamizaje fitoquímico de metabolitos secundarios mediante métodos colorimétricos
Fenoles totales y/o taninos. Se realizó mediante el método del cloruro férrico. Los extractos se evaluaron a una concentración de 10 mg/mL para los tallos y las raíces, mientras que en las hojas de 2 mg/mL (Chhabra et al., 1984).
Flavonoides. Se utilizó el ensayo de Shinoda y los extractos se evaluaron a una concentración de 10 mg/mL para los tallos y las raíces, y de 2 mg/mL para las hojas (Bonilla-Rios et al., 2014).
Saponinas. La identificación de saponinas se realizó mediante el método de la espuma. Los extractos se prepararon a razón de 10 mg/mL (Robles-García et al., 2016).
Cumarinas. Para la determinación cualitativa de cumarina, se utilizó la prueba del hidróxido de sodio. Los extractos se dispusieron a 10 mg/mL (Vázquez y García-Vieyra, 2017).
Quinonas. La determinación colorimétrica de quinonas se realizó a partir de 500 µL de los extractos, a una concentración de 10 mg/mL. Se les agregó 500 µL de H2SO4 (Vázquez y García-Vieyra, 2017).
Terpenoides. La identificación de terpenoides se realizó a partir de 500 µL de los extractos a una concentración de 10 mg/mL, según la metodología de Vázquez y García-Vieyra (2017).
Determinación cuantitativa de los principales grupos de metabolitos secundarios
Fenoles totales. La determinación cuantitativa de fenoles totales se realizó mediante el método de Folin-Ciocalteu, según lo planteado por Ocampo et al. (2014) con algunas modificaciones. Los resultados se expresaron en mg de ácido ascórbico/mg de extracto.
Flavonoides. El estudio cuantitativo de flavonoides se realizó mediante el método del cloruro de aluminio, según precisiones citadas por Chekol y Desta (2018), algunas modificadas. Los resultados se expresaron como mg de quercetina/mg de extracto.
Saponinas. La cuantificación de saponinas se realizó según el método descrito por Guzmán et al. (2013), con algunas reformas. Los resultados se expresaron como mg de Panax Ginseng 10 %/ mg de extracto.
Todos los extractos se trabajaron a una concentración de 1mg/mL
Actividad antioxidante total. Se aplicó el método de captura del radical fosfomolibdato. Según la metodología de Umamaheswari y Chatterjee (2008), se realizó el ensayo basado en la reducción de Mo (VI)-Mo (V) por los extractos. Cada muestra se evaluó por triplicado en tres repeticiones en el tiempo. Los resultados se expresaron como mg de ácido ascórbico/mg de extracto. Todos los extractos se trabajaron a 10 mg/mL.
Análisis estadístico. Las variables contenido de fenoles, flavonoides, saponinas y actividad antioxidante total se analizaron a través de estadística descriptiva con el paquete estadístico SPSS®, Versión 15.
Resultados y Discusión
En la tabla 1 se muestran los resultados del tamizaje cualitativo de los extractos etanólicos de hojas, tallos y raíces de T. diversifolia, a partir de pruebas colorimétricas para los fenoles y/o taninos, flavonoides, saponinas, cumarina, quinonas y terpenoides.
Tabla 1 Tamizaje fitoquímico cualitativo de los extractos etanólicos de T. diversifolia a partir de pruebas colorimétricas.

Los ensayos colorimétricos permitieron identificar los metabolitos secundarios presentes en los extractos de T. diversifolia (tabla 1). El extracto de las raíces mostró la presencia de todos los metabolitos. Sin embargo, en el extracto de las hojas hubo ausencia de terpenoides, y para el de los tallos, de saponinas. Aunque no se hayan encontrado estos metabolitos, no significa que no estén presentes. Quizá se puedan detectar con mayores concentraciones del extracto o mediante otro tipo de método analítico cuantitativo, como la cromatografía líquida de alta resolución (HPLC) o el ELISA.
Cada solvente tiene diferentes capacidades de extracción y espectro de solubilidad, por lo que las cantidades de fitocompuestos presentes en uno u otro extracto dependerá de su afinidad con el solvente de extracción utilizado (Soto-García y Rosales-Castro, 2016). La intensidad del color en la reacción dejó ver que las raíces son el órgano con mayor cantidad de fitocompuestos, seguido de las hojas y los tallos. Debido a la interferencia del color, tratándose de un método cualitativo, y no con las mismas concentraciones, solo se determinó la presencia o la ausencia del metabolito en cuestión.
En otras especies de la familia, como Tithonia tubaeformis (Jacq.) Cass, se han realizado tamizajes fitoquímicos en extractos metanol-agua y se informa la presencia de alcaloides, esteroides, taninos y cumarinas (Hinojosa-Dávalos et al., 2013), con ausencia de saponinas. Sin embargo, Olayinka et al. (2015) refieren la presencia de todos los metabolitos en T. diversifolia, que han sido mencionados también en el presente estudio.
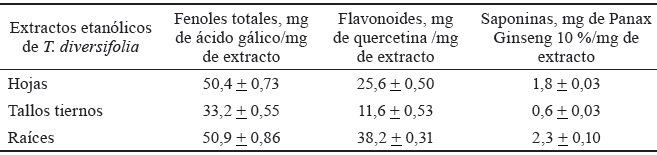
La cuantificación de los principales metabolitos secundarios se muestra en la tabla 2. Los extractos tuvieron altos contenidos de fenoles y flavonoides, mientras que las saponinas se presentaron en menor cuantía. En correspondencia con los ensayos colorimétricos, los extractos de las raíces mostraron las mayores concentraciones de metabolitos. Le siguieron las hojas y, por último, los tallos.
Umar et al. (2015) realizaron un estudio fitoquímico de las hojas, los tallos y las raíces en extractos etanólicos y acuosos de T. diversifolia. Estos autores plantearon que los metabolitos secundarios eran significativamente altos en las hojas, seguidos de la raíz y el tallo, a excepción de la concentración de fenoles donde los valores más elevados correspondieron a la raíz. Esto concuerda con los resultados de este estudio, pues las raíces presentaron mayor contenido de metabolitos, le siguieron las hojas y, por último, el tallo. Según indicó Arguayo (2002), existe gran variación en cuanto a la concentración de metabolitos secundarios en las diferentes partes de las plantas, pues no presentan un patrón de máxima producción ni órganos especiales de almacenaje. Además, la síntesis de estos compuestos del metabolismo secundario depende, en gran medida, del estado fenológico de la planta, la época del año, las características del suelo, la región del país donde se establece y las condiciones ambientales, entre otras cuestiones (Sampaio y Da Costa, 2018).
T. diversifolia ha mostrado variabilidad en cuanto a la presencia de metabolitos secundarios, según informes de varios autores (Rivera et al., 2018). De ahí las diferencias en los resultados y la versatilidad de la planta para su adaptación a diferentes ambientes.
El estudio del metabolismo secundario en las plantas influye en diferentes actividades biológicas que pueden traer beneficios para la salud animal y humana. Por ello, una vez realizado el tamizaje fitoquímico se procedió a medir el porcentaje de capacidad antioxidante, lo que está determinado por muchos de estos metabolitos antes mencionados.
En la figura 1 se muestra la actividad antioxidante total de los extractos etanólicos de hojas, tallos tiernos y raíces de T. diversifolia. Como se puede observar, el extracto de las raíces presentó la mayor capacidad antioxidante. Le siguió el extracto de las hojas, mientras que el de los tallos tiernos mostró menor actividad. Estos resultados están en correspondencia con el contenido de metabolitos secundarios de los extractos, lo que demostró que la actividad antioxidante evidenciada en este estudio se puede asociar al contenido de fenoles y flavonoides, lo que se explica por las propiedades redox de los compuestos fenólicos.

Figura 1 Actividad antioxidante total de los extractos etanólicos de las hojas, tallos tiernos y raíces de T. diversifolia.
La actividad antioxidante de los fenoles y flavonoides, de manera general, está dada por su capacidad secuestradora de radicales libres, quelante de hierro, así como por la inhibición de enzimas oxidasas. Estos metabolitos son capaces de evitar o atenuar el estrés oxidativo, debido a las especies reactivas del oxígeno (ERO), lo que previene la oxidación de importantes biomoléculas (proteínas, ácidos nucleicos, lípidos y azúcares). Lo anterior está asociado a la aparición de determinadas enfermedades (cáncer, Alzheimer, envejecimiento, cataratas, diabetes, hipertensión, enfermedades cardiovasculares, entre otras), que tienen cada vez más impacto y alcance en la sociedad (Działo et al., 2016).
La capacidad antioxidante de un extracto de planta se precisa con mayor exactitud mediante la utilización de varios métodos analíticos, pues existe gran variación en los mecanismos que un compuesto o mezcla antioxidante puede ejercer in vivo. Todo ello dependerá, en gran medida, de la biodisponibilidad de la mezcla de compuestos presentes y de sus interacciones sinérgicas para producir una respuesta antioxidante a nivel celular (López-Alarcón y Denicola, 2013).
Según informes de Betancur y Mosquera (2017), las especies de la familia Asteraceae se destacaron por presentar altos valores de actividad antioxidante ante el radical DPPH. También Pantoja-Pulido et al. (2017) plantearon que T. diversifolia mostró buena actividad antioxidante, cuando se probó en DPPH. y en ensayos de reducción férrica.
Conclusiones
La determinación cualitativa y cuantitativa de los metabolitos secundarios mostró la presencia de fenoles, flavonoides, cumarinas, quinonas y terpenoides en extractos etanólicos de las raíces, tallos y hojas de T. diversifolia.
Los extractos de las raíces y hojas de T. diversifolia presentaron las mayores concentraciones de fenoles y flavonoides.
Las raíces constituyen el órgano con mayor actividad antioxidante, seguido de las hojas y, por último, del tallo.
T. diversifolia es una fuente importante de diversidad, debido a la variedad de compuestos bioactivos que es capaz de sintetizar.