INTRODUCCIÓN
Tithonia diversifolia (Hemsl.), conocida comúnmente como botón de oro, es una planta de la familia Asteraceae. Originaria de América Central, se adapta bien a regiones tropicales y se cultiva en diversos países como recurso forrajero, por su alta producción de biomasa, rápida recuperación después del corte y valor nutricional (Cerdas-Ramírez, 2018).
Esta especie extrae del suelo cantidades importantes de nutrientes para la producción de la biomasa (Botero-Londoño et al., 2019), de modo que cuando se cultiva como forraje, necesita una adecuada fertilización para mantener su productividad y conservar la fertilidad del medio edáfico (López-Guzmán et al., 2017; Santos et al., 2021). Sin embargo, los altos precios de los fertilizantes y la necesidad de fomentar una agricultura amigable con el medio ambiente, sugieren la búsqueda de estrategias de fertilización que garanticen una nutrición adecuada de los cultivos, disminuyan el uso de insumos externos y, a la vez, aseguren la protección de los recursos naturales (Finkel et al., 2017).
En los últimos años se ha prestado mucha atención al uso de los biofertilizantes, por su efecto directo en la mejora de las propiedades biológicas de los suelos, el aumento de los rendimientos de los cultivos y la reducción del uso de los fertilizantes sintéticos (Agarwal et al., 2018).
Entre los microorganismos utilizados como biofertilizantes se encuentra la bacteria asociativa Azospirillum brasilense, capaz de fijar nitrógeno atmosférico y mejorar la productividad y calidad de los cultivos, además de otros beneficios como la producción de fitohormonas, la solubilización de fosfatos y la protección de las plantas contra estreses abióticos (Fukami et al., 2018; Oliveira et al., 2018). También la biofertilización con hongos formadores de micorrizas arbusculares, que aumentan el volumen de suelo, exploran las raíces y facilitan la absorción de los nutrientes y el agua, ha mostrado su efectividad en diferentes cultivos (Chandrasekaran, 2020; Simó-González et al., 2020). Sin embargo, pocos trabajos abordan el efecto de la utilización de ambos biofertilizantes en la producción de forraje de T. diversifolia.
A partir de estas premisas, el objetivo de este estudio fue evaluar el efecto de la biofertilización, simple y combinada de Azospirillum brasilense y Rhizoglomus irregulare, en el estado nutricional y el rendimiento de biomasa de T. diversifolia.
MATERIALES Y MÉTODOS
Localización. El experimento se realizó en una vaquería de la Unidad Básica de Producción Cooperativa (UBPC) Juan Oramas, ubicada en el municipio de Guanabacoa, provincia La Habana, a los 23o08’ de latitud Norte y a los 82º11’ de longitud Oeste.
Suelo. El estudio se realizó en un suelo pardo mullido carbonatado (Hernández-Jiménez et al., 2015), cuyas características químicas principales se presentan en la tabla 1.
Tabla 1 Características químicas del suelo (profundidad 0-20 cm)
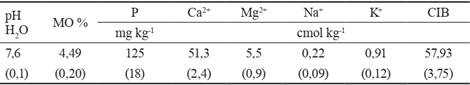
MO: materia orgánica, CIB: capacidad de intercambio de bases, Valores entre paréntesis indican intervalos de confianza (α=0,05)
Para el análisis del suelo se utilizaron los siguientes métodos: pH en H2O (potenciometría, relación suelo-agua 1:2.5), contenido de materia orgánica (Walkley y Black), P asimilable (extracción con H2SO4 0.5 mol L-1 y determinación colorimétrica), bases intercambiables (extracción con NH4Ac 1 mol L-1 pH 7, determinación por complejometría para Ca y Mg y fotometría de llama para Na y K) y capacidad de intercambio de bases (suma de bases intercambiables), según las técnicas analíticas establecidas en el laboratorio de suelos y plantas del Instituto Nacional de Ciencias Agrícolas (INCA), descritas por Paneque et al. (2011).
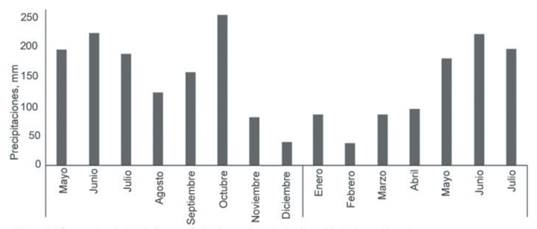
Condiciones climáticas. El comportamiento de las precipitaciones durante el período en que se condujo el experimento (junio 2018-julio 2019) se presenta en la figura 1.
Tratamiento y diseño experimental. Se evaluaron cuatro tratamientos (biofertilización con A. brasilense, biofertilización con R. irregulare, biofertilización con A. brasilense + R. irregulare y un testigo sin inocular), distribuidos en un diseño cuadrado latino para evitar posibles variaciones en la fertilidad del suelo y en las poblaciones residentes de hongos micorrízicos arbusculares (HMA), originadas por la distribución espacial y el manejo agronómico que tuvieron las plantas cultivadas anteriormente en el área donde se realizó el experimento, y que pudieran aumentar el error experimental. Cada tratamiento se distribuyó una sola vez, en filas y columnas. Las parcelas constituyeron la unidad experimental, con una superficie total de 24 m2 y un área de cálculo de 16 m2.
Procedimiento experimental. El suelo se preparó mediante labores de roturación (arado), grada, cruce (arado) y grada, a intervalos aproximados de 25 días entre cada labor. Posteriormente se surcó, y en mayo de 2018, todas las parcelas se sembraron de Canavalia ensiformis (L.) DC, pero se inoculó con R. irregulare en el momento de la siembra en los dos tratamientos correspondientes a la biofertilización con HMA, como vía para reproducir en el suelo cantidades suficientes de propágulos micorrízicos de R. irregulare para la posterior inoculación de T. diversifolia (Rivera et al., 2020).
C. ensiformis se sembró a 50 cm entre surcos y 20 cm entre plantas. En los tratamientos con HMA, la inoculación se realizó por el método del recubrimiento de las semillas. Para ello se preparó una pasta fluida mediante la mezcla de inóculo sólido y agua, en proporción 1: 0.6 m v, donde se sumergieron las semillas. Se secaron a la sombra e inmediatamente se sembraron. El inóculo contenía 30 esporas por gramo de la cepa INCAM-11, de la especie de HMA R. irregulare (Sieverding et al., 2014), procedente de la colección del INCA.
A su vez, C. ensiformis se cortó a los 60 días y su biomasa aérea se retiró del campo para la alimentación de los animales. La tabla 2 muestra la cantidad de esporas de HMA que quedaron en el suelo en las parcelas correspondientes a cada tratamiento, después del corte de C. ensiformis.y al momento de la plantación de T. diversifolia.
Tabla 2 Cantidades de esporas que quedaron en el suelo después del corte de C. ensiformis.

Valores entre paréntesis indican intervalos de confianza (α=0,05)
Después del corte de C. ensiformis, se surcó y se procedió a la plantación de T. diversifolia, que se realizó con propágulos vegetativos de aproximadamente 30 cm de longitud, tomados de la parte superior y media de los tallos de un campo cultivado de esta especie, muy próximo al área experimental. Los propágulos se plantaron a 1,0 m entre surcos y 0,5 m entre plantas.
Al momento de la plantación de T. diversifolia, en cada parcela se tomaron muestras compuestas de suelo, a una profundidad de 0-20 cm, a las que se les determinó pH en H2O y los contenidos de materia orgánica, P asimilable, bases intercambiables y determinación del Ca y Mg, Na y K, y la capacidad de intercambio de bases.
Para la biofertilización con A. brasilense se utilizó el producto comercial Nitrofix®, procedente del Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA), que contenía la cepa 8I, con una concentración de 109 UFC mL-1. Se preparó una mezcla de inóculo líquido y agua en relación 1:10 v / v. Mediante una mochila manual se aplicó al suelo, 20 L ha-1 del producto comercial. Se administró muy próximo a los surcos, a los quince días después de la brotación de T. diversifolia. El experimento se condujo en condiciones de secano y no se aplicó fertilización de fondo.
Mediciones. Se realizaron cuatro cortes. El primero a los 120 días después de la plantación (noviembre de 2018) y el resto, en febrero, mayo y julio de 2019, a una altura de 30 cm de la superficie del suelo. En cada corte se pesó la biomasa fresca de la parte aérea correspondiente al área de cálculo de las parcelas. Se tomaron muestras de 200 g, que se llevaron a una estufa de circulación de aire a 70 ºC durante 72 h, para calcular el porcentaje de materia seca (MS) y estimar el rendimiento de MS. En el segundo y cuarto corte, se determinaron las concentraciones (g kg-1 de MS) de N, P, K en la biomasa (Paneque et al., 2011).
En el momento del segundo y cuarto corte, enmarcados en el período lluvioso y poco lluvioso, respectivamente, se tomaron tres sub-muestras de raíces y de suelo de la rizosfera de cada parcela, a profundidad de 0-20 cm. Se usó para ello un cilindro metálico de 5 cm de diámetro y 20 cm de altura. Los puntos de muestreo se distribuyeron equidistantes y separados a 10 cm de los surcos.
Las submuestras se homogeneizaron para formar una muestra compuesta por parcela y se extrajo 1 g de raicillas para su tinción y clarificación (Rodríguez-Yon et al., 2015). Se evaluaron la frecuencia de colonización micorrízica mediante el método de los interceptos (Giovanetti y Mosse, 1980) y la densidad visual o intensidad de la colonización, de acuerdo con Trouvelot et al. (1986), así como el número de esporas en la rizosfera a partir del tamizado y decantado por vía húmeda de dichas estructuras y de su observación en el microscopio (Herrera et al., 1995).
Se determinó el índice de eficiencia (IE) de la biofertilización mediante la siguiente fórmula:
IE: [Rendimiento acumulado de MS (t ha-1) del tratamiento biofertilizado - Rendimiento acumulado de MS (t ha-1) del tratamiento testigo / Rendimiento del acumulado de MS (t ha-1) del tratamiento testigo] x 100
Análisis matemático. Los datos, una vez que se comprobó la normalidad y homogeneidad de la varianza, se procesaron mediante el análisis de varianza y la prueba de Tukey (p < 0,05). En las variables correspondientes a las características químicas del suelo y al número de esporas de HMA que quedaron en el suelo después del corte de C. ensiformis (tablas 1 y 2), así como en aquellas cuyos resultados se muestran en las figuras, se utilizó el intervalo de confianza (α=0,05) como estadígrafo de dispersión o como criterio para su comparación (Payton et al., 2000). En todos los casos se utilizó el programa estadístico SPSS 25 (2017).
RESULTADOS Y DISCUSIÓN
La inoculación con R. irregulare incrementó la frecuencia e intensidad de la colonización y el número de esporas en la rizosfera (fig. 2), lo que demostró la efectividad de esta cepa para colonizar las raíces de T. diversifolia. No obstante, los mayores valores se alcanzaron con la aplicación conjunta de ambos biofertilizantes. Este comportamiento se pudiera atribuir al aumento de los sitios de colonización del HMA a partir del efecto positivo que ejercen las fitohormonas producidas por A. brasilense en el incremento de la longitud y la ramificación de las raíces y, consecuentemente, en la formación y la multiplicación de las estructuras micorrízicas (Raklami et al., 2019).

Figura 2 Efectos de los tratamientos en la frecuencia e intensidad de la colonización y en el número de esporas en la rizosfera T. diversifolia.
El efecto de R. irregulare se observó aun en el cuarto corte (julio 2019). Es decir, 12 meses después de la plantación de T. diversifolia. Incluso, los valores de frecuencia, intensidad de la colonización micorrízica y número de esporas en la rizosfera en este corte fueron mayores que los registrados en el segundo (febrero 2019). Este comportamiento se pudiera relacionar con las épocas en que se realizaron los muestreos. Durante el período lluvioso ocurre un rápido crecimiento de los cultivos, debido al incremento de los volúmenes de precipitación, temperatura y luminosidad. Ello implica la absorción de mayor cantidad de nutrientes para la formación de la biomasa y, consecuentemente, la formación de mayores cantidades de estructuras micorrízicas para garantizar el acceso de las plantas a los recursos del suelo (Bhardwaj y Chandra, 2018).
El aumento de las variables fúngicas en los tratamientos inoculados con R. irregulare también confirma lo planteado por Rivera et al. (2020) acerca de la efectividad del uso de C. ensiformis como cultivo precedente y como vía para la inoculación micorrízica del cultivo posterior, lo que implica una reducción importante de las cantidades de inoculante a utilizar.
De acuerdo con el método de inoculación utilizado, en el que se usa una cantidad de inoculante equivalente al 10 % del peso de la semilla o propágulo, en T. diversifolia implicaría la utilización de 100 kg ha-1 de inoculante. Sin embargo, con la utilización de C. ensiformis previamente inoculada, como vía para la inoculación de T. diversifolia a partir de los propágulos micorrízicos que deja este cultivo en el suelo, la cantidad de inoculante se redujo a 6 kg ha-1.
La tabla 3 muestra el efecto de la biofertilización en las concentraciones de N, P y K en la biomasa de la parte aérea, en el segundo y cuarto corte. R. irregulare y A. brasilense incrementaron las concentraciones de N con respecto al tratamiento no inoculado, aunque no se constataron diferencias significativas entre ambos tratamientos. Sin embargo, los mayores efectos se obtuvieron con la aplicación conjunta de los biofertilizantes. No se encontraron diferencias significativas entre los tratamientos para las concentraciones de P y K en la biomasa. Este comportamiento estuvo en correspondencia con los altos contenidos de ambos nutrientes en el suelo (Paneque y Calaña, 2001).
Tabla 3 Efecto de los biofertilizantes en las concentraciones de N, P y K en la biomasa (g kg-1).
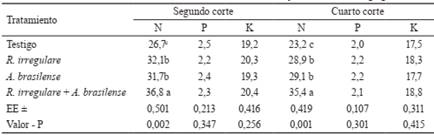
Letras distintas en la misma columna difieren significativamente, según prueba de Tukey (p < 0,05)
Los rendimientos de masa seca tuvieron un comportamiento similar al observado en las concentraciones de nutrientes en la biomasa (tabla 4). Es decir, con la aplicación por separado de uno u otro biofertilizante hubo aumento significativo en este indicador, y ambos mostraron valores similares. No obstante, el mayor efecto se obtuvo mediante la coinoculación con ambos microorganismos.
Tabla 4 Efecto de biofertilizantes en el rendimiento de biomasa de T. diversifolia (t MS ha-1).
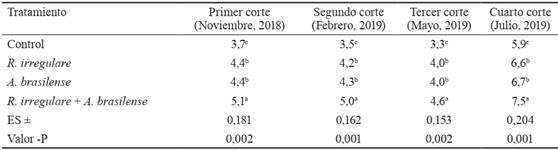
Letras distintas en la misma columna difieren significativamente, según prueba de Tukey (p < 0,05).
El efecto de los biofertilizantes en el incremento de los rendimientos de T. diversifolia parece estar relacionado con su influencia en el aumento de las concentraciones de N en la biomasa. Se conoce que este cultivo absorbe cantidades importantes de N (Santos et al., 2021), y a juzgar por el contenido de materia orgánica del suelo donde se desarrolló el experimento, que clasifica como mediano (Paneque y Calaña, 2001), la disponibilidad de este elemento en el suelo pudo no ser suficiente para satisfacer la demanda del cultivo. De este modo, los biofertilizantes pudieron haber contribuido a satisfacer estas necesidades y, consecuentemente, a la mejora de los rendimientos de biomasa.
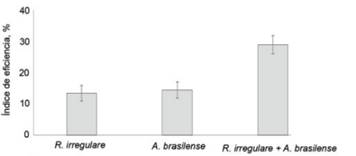
Al analizar el índice de eficiencia de la biofertilización, que muestra en incremento porcentual los rendimientos de biomasa de cada tratamiento inoculado con respecto al testigo sin inocular, no hubo diferencias entre la aplicación de uno y otro biofertilizante por separado. Sin embargo, el mayor valor se obtuvo con la aplicación conjunta de ambos (fig. 3).
Los HMA participan activamente en la transferencia del N y otros nutrientes del suelo a la planta hospedera mediante la red de micelios que aumenta la capacidad de absorción de las raíces de las plantas (Yu et al., 2020). A. brasilense puede fijar cantidades importantes de N atmosférico y transferirlo a la planta hospedera (Aguirre et al., 2018). Ello se traduce en un incremento del rendimiento, incluso, en una reducción de las necesidades de este nutriente, vía fertilización (Leite et al., 2019). Pero el hecho de que los mayores efectos se hayan obtenido con la aplicación conjunta de ambos biofertilizantes, demuestra que sus beneficios se complementan, lo que da como resultado una respuesta agronómica superior que con la aplicación de uno u otro por separado.
Siddaram et al. (2017) y Kamali y Mehraban (2020), al evaluar los efectos de la coinoculación con A. brasilense y HMA observaron una interacción tripartita entre ambos microorganismos y la planta hospedera, cuyas relaciones sinérgicas dieron como resultado incremento en las concentraciones de nutrientes y en el crecimiento de las plantas, significativamente mayores que los alcanzados con la aplicación de cada microorganismo por separado.
Otro aspecto interesante fue la permanencia del efecto de los biofertilizantes en el sistema suelo-planta, que se observó aún a los doce meses de la plantación de T. diversifolia. Ello hace pensar que los beneficios de la biofertilización se pudieran extender más allá de ese período, y sugiere realizar estudios al respecto.
Se concluye que la inoculación simple con A. brasilense y R. irregulare mejora la nutrición nitrogenada y los rendimientos de biomasa de Tithonia diversifolia. Con la aplicación conjunta de ambos biofertilizantes, se logra mayor efectividad de la inoculación micorrízica y valores de estos indicadores superiores a los que se alcanzan con cada uno por separado. Se sugiere profundizar en los estudios sobre la coinoculación con A. brasilense y R. irregulare y su contribución a la reducción del uso de fertilizantes.