My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Oftalmología
Print version ISSN 0864-2176
Rev Cubana Oftalmol vol.26 no.3 Ciudad de la Habana Sept.-Dec. 2013
PRESENTACIONES DE CASO
Manifestaciones oftalmológicas por virus de Epstein-Barr
Ophthalmological manifestations caused by Epstein-Barr virus
Dra. AdrianneMayulySuñetÁlvarez,I Dr. Rafael González Díaz,I Dra. Beatriz Rodríguez Rodríguez,I Dra. Daysi Vilches Lescaille,I Dr. Yoel Rodríguez Martín,II Dr. Raúl Rúa MartínezI
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Instituto Cubano de Neurología y Neurocirugía "Prof. Dr. José Rafael Estrada González". La Habana, Cuba.
RESUMEN
Se trata de un paciente masculino de 26 años que acude por disminución brusca de la visión del ojo derecho. Seingresó como una uveítis posterior dada por exudación extensa en área macular del ojo derecho, acompañada de edema del disco óptico, vasculitis aledaña a la lesión y hemorragias dispersas en llama en el polo posterior. La etiología era controversial y, el tratamiento más apropiado era debatible, por lo que se le realizaron estudios como retinografías seriadas, angiografías fluoresceínicas y reacción en cadena de polimerasa a una muestra del humor acuoso, que confirmó la etiología viral; lo que resultó en una agudeza visual final de 0,1. Posterior a 6 meses del cuadro inicial, el paciente presentó queratitis intraestromal en forma numular -que recurre ante episodios de stress-, para desaparecer luego de terapia tópica con antiinflamatorios no esteroideos y esteroideos.La baja incidencia de casos reportados con uveítis posterior por virus de Epstein Barr resulta de un pobre conocimiento de la presentación de la enfermedad, por tanto un retraso en la instauración del tratamiento. En estos casos la prueba de oro es la reacción de cadena de polimerasa.
Palabras clave: Epstein-Barr, virus, uveítis, vasculitis, PCR.
ABSTRACT
This article presented a 26 years-old male patient who went to the ocular service with sudden reduction of vision in his right eye. He was admitted to the hospital and diagnosed as posterior uveitis based on extensive exudation in the macular area of the right eye, edema of the optic disk, vasculitis next to the lesion and disperse hemorrhages in the posterior pole. The etiology of this case was controversial and the most suitable treatment was under discussion, so it was decided to perform serial retinographies, fluorescein angiographies and polymerase chain reaction in a aqueous humor sample taken from the patient. The viral etiology was confirmed, resulting in final visual acuity of 0.1. After 6 months of the initial clinical picture, the patient suffered nummular-shaped intrastromal keratitis - it appears in stress episodes- and finally disappears after topical therapy with non-steroidal and steroidal anti-inflammatory drugs. The low incidence of cases reported with posterior uveitis caused by Epstein Barr virus is due to the poor knowledge about the onset of this disease, and leads to delay in applying treatment. The golden rule in this case is the polymerase chain reaction.
Keywords: Epsterin-Barr, virus, uveitis, vasculitis, polymerase chain reaction.
INTRODUCCIÓN
El virus de Epstein Barr (EBV) es un herpes virus humano tipo 5cosmopolita, subfamilia gamma, que se está extendido mundialmenteyaproximadamente el 90 % de la población a los 30 años ya está seroconvertida.La trasmisión de este virus ocurre primariamente por la saliva, y en menor grado por transfusiones de sangre y la principal vía de diseminación que es la saliva expulsada por estos pacientes seropositivos, constituyen del 15 al 25 % de la población general. La infección primaria, que es la Mononucleosis infecciosa (MI) afecta el grupo de 14 a 18 años de edad.1 Cuando el virus penetra al organismo invade los linfocitos B, y entra en fase latente,2 dando paso a un estado de inmunidad que persiste de por vida, al generarse anticuerpos contra antígenos de la cápside viral y contra antígenos nucleares del virus.3 Incluso, bajo condiciones oculares normales el ADN de EBV puede ser encontrado en el iris, cuerpo ciliar, retina, y coroides. Esta primoinfección puede cursar sin síntomas generales ni locales.4 La reactivación suscita bajo estados de inmunodepresión.3
Los datos clínicos y de laboratorio sugieren que el EBV pueda estar directa o indirectamente involucrado en la patogénesis de una variedad de enfermedades oculares. En algunos casos, dicha asociación se ha reconocido recientemente, y se trabaja para establecer el papel patogénico exacto por el que actúa el EBV, que aún no ha sido bien dilucidado.5
Aunque se han descrito en diferentes investigaciones las lesiones oculares, en su mayoría se limitan a la conjuntivitis folicular y la queratitis. Más recientemente se han reportado casos de neuritis óptica unilateral, relacionados con episodios previos de fiebre recurrente en los cuales se diagnosticó el EBV luego del ataque ocular.6,7El curso clínico de estos casos indica que la activación del virus ocurrió inicialmente en las neuronas que conforman los axones de las células ganglionares, extendiéndose por contigüidad a retina y coroides, y luego al segmento anterior. También este espectro lo conforman casos de necrosis retinal aguda8 y panuveítis9 en pacientes muy jóvenes, con y sin sintomatología general sugerente de infección previa por EBV.
Se ha descrito una relación entre la inflamación ocular y la infección por el EBV durante la «fase aguda» de la Mononucleosisinfecciosa siendo la vasculitis retiniana y neuritis óptica sus manifestaciones más frecuentes, aunque también han sido descritos la coriorretinitis y el glaucoma secundario.9-14 Acompañando la infección crónica por EBV hay reportes de uveítis anterior sensible a la corticoterapia o uveítis posterior severa, con inflamación del disco óptico y edema macular.15,16 Puede diagnosticarse un cuadro asociado al EBV cuando los signos oculares se presentan después de una sintomatología catarral en pacientes con niveles elevados de anticuerpos frente al antígeno anticápside viral (ACV) en el humor acuoso. Generalmente, son cuadros de presentación bilateral, que responden bien a la corticoterapia, aunque habitualmente recurrentes.17,18
Teniendo en cuenta la amplia distribución mundial del virus y los escasos reportes recogidos de su afectación ocular a todos los niveles; se describe este representativo caso, el cuál fue diagnosticado por la técnica del PCR practicado al fluido ocular.
PRESENTACIÓN DEL CASO
Paciente masculino de 26 años de edad que acude a consulta por disminución brusca de la visión del ojo derecho (OD), de 5 días de evolución; sin otro síntoma acompañante. Antecedentes patológicos personales y familiares sin interés, y examen físico general sin alteración . Al examen oftalmológico la agudeza visual mejor corregida (AVMC) inicial fue de cuenta dedos (CD) en el OD y 1,0 en el ojo izquierdo (OI). La tonometría aplanática de no contacto confirmó 25 en el OD y 16 en el OI. Clínicamente presentaba blefarospasmo leve y fotofobia, dolor ocular a la supraducción, defecto pupilar aferente relativo (DPAR), reacción inflamatoria celular de 2+ en la cámara anterior, medios transparentes y al fondo de ojo el disco óptico hiperémico, hemorragias intrarretinianas anulares menores de 300 µm diseminadas en polo posterior, escasas, desprendimiento de retina seroso en toda el área macular, infiltrado subretinal de ± 4 diámetros de disco (DD) en mácula inferior, cuyo borde amenazaba la fóvea, con vasculitis aledaña (Fig. 1) y escasa celularidad vítrea posterior.
Inicialmente se sospechó una retinocoroiditis por toxoplasma, como causa más frecuente de inflamación del segmento posterior en pacientes inmunocompetentes, se trató como una retinitis infecciosa bacteriana, por lo que se impuso tratamiento con metronidazol y amikacina, cubriendo el espectro de los gérmenes grampositivos y gramnegativos, y asociado con metilprednisolona para combatir la inflamación.
La AVMC a los 7 días se mantenía en CD a 1 m, a pesar de la mejoría por clínica y tomografía de coherencia óptica (OCT) del fenómeno inflamatorio, no había signos de toma sistémica (Fig. 2a,b). (Fig. 2c) En esta fecha se recibe el resultado de la reacción en cadena de la polimerasa (PCR) del humor acuoso que informa negativo alvirusde Herpes simple (HSV), a Herpes zóster (VZV), a Citomegalovirus (CMV), a Rubeola, a Virus Linfotropo humano tipo 1 (HTLV-1) y positivo a EBV. Al cumplir los 7 días de tratamiento antibiótico se decide continuar sólo con esteroides por vía oral a razón de 1 mg/kg/día.
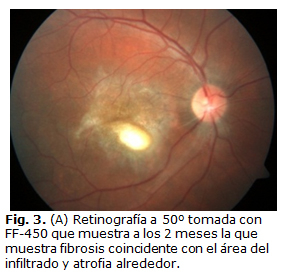
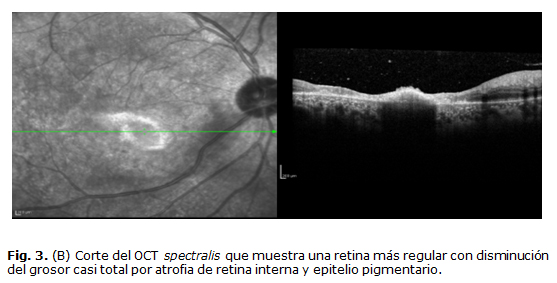
A los 2 meses acude para reevaluación en consulta, donde hay evidencia de mejoría por clínica y OCT (Fig. 3a, 3b), la AVMC fue de 0,05 y se decide comenzar el esquema reductivo de los esteroides orales.
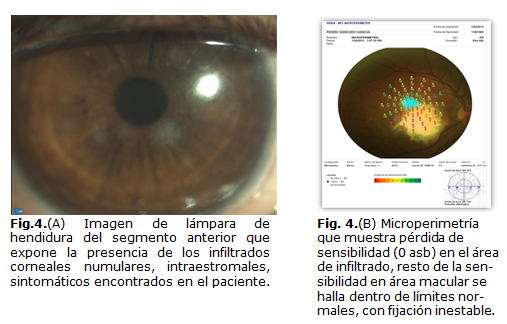
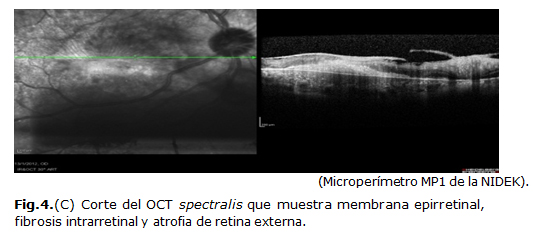
Al año del episodio el paciente acude a consulta alegando pérdida visual total, al examen oftalmológico se constata edema corneal difuso, sin celularidad en cámara anterior, y se impone tratamiento con deshidratadores corneales y antiinflamatorios esteroideos. A las 2 semanas se evidencia la presencia de infiltrados corneales anulares, localizados en estroma, unilaterales, paracentrales, de diferente diámetro (Fig. 4a, b, c). Fue tratado con antiinflamatorios esteroideos tópicos y el cuadro fue cediendo lentamente, sufriendo 2 recaídas dentro de un período de 2 meses.
DISCUSIÓN
En casi todos los sitios anatómicos oculares se ha demostrado la presencia del EBV, incluso en tejidos sanos. Se han reportado numerosos casos de conjuntivitis en pacientes confirmados serológicamente con MI.19 Meisler y coautores en 1981 informaron un caso con una masa inflamatoria conjuntival unilateral y nódulos linfáticos preauriculares agrandados en un muchacho 11 años diagnosticado de MI.20 En la biopsia se informó la presencia de un infiltrado linfocitario con células gigantes multinucleadas.
Wilhelmus informó un caso de queratoconjuntivitis unilateral folicular en una paciente de 16 años con MI, además de nódulos linfáticos preauriculares agrandados, en la que el virus fue hallado en cultivos de las lágrimas y conjuntiva.21 Matoba y coautores también describieron casos de inflamación conjuntival consistente en leve hiperemia ocasional acompañada por una respuesta folicular en conjuntiva tarsal en una serie de pacientes con MI.22 Gardner y otros informaron un caso de un nódulo de conjuntiva bulbar asociado con adenopatías preauriculares y submandibulares en un paciente de 38 años con MI aguda, que al corte histológico fueron observados linfocitos maduros y células plasmáticas, además de tinción positiva de células antigénicas para EBV que demuestra actividad en la fase latente, como son la proteína de membrana latente 1 (LMP-1) y el antígeno nuclear del EBV 2 (EBNA-2).23
Se han reportado evidencias directas e indirectas del papel patogénico del EBV en el síndrome de Sjögren. Hay múltiples casos con síndrome de Sjögren primario instaurado inmediatamente después de la confirmación serológica de MI.24 En 1990 Plugfelder sugirió que los pacientes con síndrome de Sjögrentenían elevaciones significativas de anticuerpos séricos al antígeno de cápside viral del EBV y antígenos precoces comparados con pacientes sin síndrome de Sjögrencon deficiencia de lágrimas y controles normales.25 Estos resultados sugieren que los pacientes con síndrome de Sjögrenprimario tienen infección persistente crónica por EBV, lo que constituye un factor de riesgo para esta enfermedad.26 Esto suscita que el virus permanece en la glándula lagrimal en estado no patológico latente, y el sitio celular y estado de la expresión genómica parece similar a los reportados en la glándula salival.27
En 1991 Tsubota realizó un estudio donde le aplicaron la reacción en cadena de la polimerasa PCR a muestras de lágrimas y biopsia de glándulas lagrimales a pacientes sanos y enfermos, concluyendo que el EBV puede persistir en un pequeño porcentaje en glándulas lagrimales normales, y es hallado en la mayoría de las glándulas lagrimales de pacientes con síndrome de Sjögren; sugiriendo que el EBV puede ser una factor de riesgo en la patogénesis de la afectación de la glándula lagrimal en el síndrome de Sjögren.28
En cuanto a la presencia del virus en la córnea, la primera asociación informada reportada vino de Payrau y Hoel en 1958.29 En 1980, Pinnolis y colegas describieron a un paciente de 16 años con anticuerpo-positivo para MI; quién, al interrumpir los corticoesteroides orales, desarrolló una queratitis intersticial numular bilateral sin vascularización estromal. Las opacidades corneales eran bilaterales y simétricas a diferencia del virus de Herpes simple y del virus de la Varicela zóster, y más profundas dentro del estroma corneal que los infiltrados subepiteliales de la queratitis por adenovirus. Reforzado esto por los estudios serológicos, donde la inmunofluorescencia indirecta para el anticuerpo específico contra el ACV mostró títulos elevados correspondientes con un infección aguda.30
En 1986, Matoba y socios informaron de 7 pacientes con queratitis estromal por EBV, pero sólo 3 de ellos tenían síntomas clínicos de MI o evidencia de reciente seroconversión, por lo que postularon que el desarrollo de la queratitis por EBV no dependía de la infección reciente por el virus, pero podía ocurrir en el estado crónico.21 Las queratitis intersticiales aparecieron en 4 pacientes en forma unilateral, multifocal, discretas, bien demarcadas, en estroma anterior, de 0,1 a 2 mm de diámetro, con apariencia de manchas pleomórficas o de anillo granular. En otros 2 pacientes se presentaron infiltrados bilaterales, multifocales, a todo grosor del estroma o en su profundidad, que recordaban una queratitis luética; y en 1 paciente se presentó con las características antes descritas combinando ambas presentaciones. En un segundo reporte, Matoba y Jones describieron 2 pacientes adicionales con infiltrados corneales subepiteliales similares a los vistos en la queratoconjuntivitis epidémica adenoviral. Uno de los pacientes mostró un incremento de los anticuerpos contra el antígeno nuclear del EBV EBNA, y los anticuerpos séricos contra el adenovirus nunca fueron detectables.31
Casos semejantes fueron reportados en años posteriores, como en 1990 por Pflugfelder,32 y en 1993 por Palay,33 llegando a concluir que entre las queratitis parecen existir 3 modelos morfológicos distintos:
§ Tipo I: infiltrado subepitelial, muy similar al hallado en las queratitis por adenovirus epidémicas.
§ Tipo II: opacidades en mitad anterior del estroma, se presentan de 2 formas: pequeñas, granulares, redondas o anulares, con mínima inflamación asociada; o más grandes, como manchas, pleomórficas, con inflamación activa.
§ Tipo III: queratitis estromal profunda o a todo grosor, en forma pleomórfica o parcheada, predominantemente involucra la córnea periférica, y puede simular una queratitis luética intersticial si es bilateral, o una queratitis estromal por HSV si es unilateral.
El curso clínico en dos de los casos informados sugiere que una forma de queratitis puede progresar a otra, y cuando se presenta el infiltrado profundo en estroma o a todo grosor con neovascularización representa una fase más tardía de la enfermedad.
La patogénesis de este tipo de queratitis asociada al EBV no se ha establecido; sin embargo, el caso reportado por Pflugfelder y asociados sugiere que la infección epitelial por EBV puede conducir a una queratitis estromal por contigüidad. El EBV se demostró por PCR en la dendrita y el anticuerpo monoclonal EBV-específico por tinción. Aunque el descubrimiento del genoma del EBV en este caso puede ser debido a las células persistentemente infectadas en el epitelio corneal, la inmunohistoquímica evidenció el antígeno temprano del EBV dentro de la dendrita del epitelio en fase replicativa de la infección.32
Han sido reportadas manifestaciones neuroftalmológicas y del segmento posterior en pacientes con evidencias clínicas o serológicas de MI. En 1952 Tanner revisó casos de neuritis óptica uni y bilateral, ocasionalmente acompañados de edema retinal, en pacientes con diagnóstico clínico y serológico de MI.19 También, un caso de neuritis óptica severa en un paciente con confirmación serológica de MI fue reportado por Jons en 1998.34 La oftalmoplejía debida a parálisis múltiples o simples de nervios craneales III, IV y VI, así como las parálisis de Bell, también se han descrito en pacientes con MI.35,36
Recientemente, en el año 2010, Miyagi dio a conocer un caso de un adolescente de 17 años con edema de papila por EBV unilateral, agudeza visual inicial de 20/20, edema prominente del disco óptico, tortuosidad vascular, aumento de la mancha ciega en el campo visual, DPAR, el resto de examen oftalmológico y general normal, y la serología con títulos elevados contra EBV.37
Se han descrito casos de uveítis anterior leve, granulomatosa (nódulos de Koeppe, precipitados queráticos gruesos blancos, que en ocasiones coronan las opacidades estromales; o no granulomatosa, pueden ser uni o bilaterales, con vitritis, o vitritis aislada.19,38 Las evidencias para su patogénesis están basadas principalmente en exámenes serológicos y PCR. Se refiere que responden bien a antiinflamatorios esteroideos y no a la terapia antiviral, aunque cursan con episodios recurrentes.
En 1989, Kelly reportó un adolescente de 17 años con retinocoroiditis aguda bilateral, que había sufrido un episodio previo de 3 semanas de enfermedad tipo influenza, dolor de garganta y linfadenopatía cervical, además de rash en el tronco. Al examen oftalmológico la AVMC era de 1,0 y CD, respectivamente, en el OD se describió la presencia de una retinitis activa a nivel del vaso temporal superior y celularidad vítrea 1+, en el OI se encontró inyección cilioconjuntival, edema corneal estromal, múltiples precipitados queráticos, DPAR, celularidad 3+ en cámara anterior, nódulos de Koeppe y presión intraocular de 40 mmHg, la celularidad vítrea de 3+, un área extensa en el fondo de ojo de retinitis activa, con hemorragias recientes en el polo posterior y opacidades vítreas, vasculitis, edema de papila. La serología fue positiva para EBV, recibió tratamiento con clindamicina, prednisona y acetazolamida orales. Finalmente la AVMC del OI fue 0,1 quedando una cicatriz atrófica blanca con halo un pigmentado.39
En el 2008, al Hospital de Valencia en España, ingresó un niño de 5 años con Necrosis Retinal Aguda por EBV bilateral (edema retinal, vasculitis oclusiva, vitritis, sin edema papilar) con IgM anti EBV(+), resto de exámenes negativos. AVMC inicial 20/400 y AVMC final 20/40.40
En 2 pacientes con diagnóstico clínico y serológico de MI se ha presentado retinitis, manifestada como una forma punteada profunda en uno, y a todo grosor en el otro.41,42Grossniklaus reportó un caso de necrosis retinal aguda en un niño de 8 años con enfermedad linfoproliferativa ligada al X (resultado de la deleción de Xp 23-25, que contiene un gen que interviene en la respuesta inmune al EBV).43
Los datos clínicos y de laboratorio sugieren que el EBV puede estar directa o indirectamente involucrado en la patogénesis de una serie de enfermedades oculares. En algunos casos, la asociación entre el virus y ciertas enfermedades oculares ha sido reconocida solo recientemente, está actualmente en estudio su roll patogénico exacto.
REFERENCIAS BIBLIOGRÁFICAS
1. Henle W, Henle G. Epstein-Barr virus and infectious mononucleosis. N Engl J Med. 1973; 288(5):263-4.
2. Schooley RT, Dolin R; Epstein-Barr virus (infectiuos mononucleosis). In: Mandell GL, Douglas RG, Bennett JE, eds: Principles and Practice of Infectious Diseases, Vol III. New York, Churchill Livingstone, 1990, p 1172.
3. Strauss SE. EpsteinBarr virus infections: biology, pathogenesis and management. Ann Intern Med. 1993;118(1):45-58.
4. Kimura H, Morita M, Yabuta Y. Quantitative analysis of Epstein-Barr virus load by using a real-time PCR assay. J ClinMicrobiol. 1999;37(1):132-6.
5. Duane's Ophthalmology en CD-ROM User Guide. [monografía en CD-ROM]. Tasman W, Jaeger E editor. versión 2.0. Hagenstown: Lippincolt-Raven; 2006.
6. Yamamoto M, Ohga S, Ohnishi Y, Inomata H. Optic disk vasculitis associated with chronic Epstein-Barr virus infection. Ophthalmologica. 2002;216(3):221-5.
7. Aizawa N. A case of unilateral optic disc swelling with chronic active EpsteinBarr virus infection. ClinOphtal. 2010;4:977-9.
8. Gallego-Pinazo R. Epstein-Barr virus and acute retinal necrosis in a 5-year-old immunocompetent child. Case report. ClinOphthal. 2008;2(2):451-5.
9. Kelly SP. Retinochoroiditis in acute Epstein-Barr virus infection. BJO. 1989;73(12):1002-3.
10. Ostler HB, Thygeson P. The ocular manifestations of herpes zoster, varicella, infectious mononucleosis, and cytomegalovirus disease. SurvOphthalmol. 1976;21(2):148-59.
11. Karpe G, Wising P. Retinal changes with acute reduction of vision as initial symptoms of infectious mononucleosis. ActaOphthalmol (Copenh). 1948;26(1):19-24.
12. Blaustein A, Caccavo A. Infectious mononucleosis complicated by bilateral papilloretinal edema. Arch Ophthalmol. 1950;43(5):853-6.
13. Raymond LA, Wilson CA, Linnemann CC. Punctate outer retinitis in acute Epstein-Barr virus infection. Am J Ophthalmol. 1987;104(4):424-6.
14. Jones J, Gardner W, Newman T. Severe optic neuritis in infectious mononucleosis. Ann Emerg Med. 1988;17(4):361-4.
15. Wong KW, D'Amico DJ, Hedges TR III, Soong HK, Schooley RT, Kenyon KR. Ocular involvement associated with chronic Epstein-Barr virus disease. Arch Ophthalmol. 1987;105(6):788-92.
16. Morishima N, Miyakawa S, Akazawa Y, Takagi S. A case of uveitis associated with chronic active Epstein-Barr virus infection. Ophthalmologica 1996; 210(3):186-8.
17. Usui M, Sakai J. Three cases of EB virus-associated uveitis. IntOphthalmol 1990;14(5-6):371-6.
18. Sakai J, Usui M, Usui N. The possible association of Epstein-Barr virus and uveitis. Nippon GankaGakkaiZasshi. 1990;94(5):496-507.
19. Tanner OR. Ocular manifestations of infectious mononucleosis. Arch Ophthalmol 1954;51(2):229-41.
20. Meisler DM, Bosworth DE, Krachmer JH. Ocular infectious mononucleosis manifested as Parinaud'soculoglandular syndrome. Am J Ophthalmol 1981;92(5):722-6.
21. Wilhelmus KR: Ocular involvement in infectious mononucleosis. Am J Ophthalmol 1981;91(1):117-8.
22. Matoba AY, Wilhelmus KR, Jones DB. Epstein-Barr viral stromal keratitis. Ophthalmology. 1986;93(6):746-51.
23. Gardner BP, Margolis TP, Mondino BJ. Conjunctival lymphocytic nodule associated with Epstein-Barr virus. Am J Ophthalmol. 1991;112(5):567-71.
24. Pflugfelder SC, Crous CA, Atherton SS. Epstein-Barr virus and the lacrimal gland pathology of Sjögren's syndrome. En: Sullivan DA (ed). Lacrimal Gland, Tear Film and Dry Eye Syndromes.New York: Plenum Press; 1994. p. 641-6.
25. Pflugfelder SC, Tseng SCG, Pepose JS. Epstein-Barr viral infection and immunologic dysfunction in patients with aqueous tear deficiency. Ophthalmology. 1990;97(3):313-23.
26. Pflugfelder SC, Crouse CA, Pereira I, Atherton SS. Amplification of Epstein-Barr virus genomic sequences in blood cells, lacrimal glands, and tears from primary Sjögren's syndrome patients. Ophthalmology. 1990;97(8):976-84.
27. Wolf H, Haus M, Wilmes E. Persistence of Epstein-Barr virus in the parotid gland. J Virol. 1984;51(3):795-8.
28. Tsubota K, Fujishima H, Toda I. Increased level of Epstein-Barr virus DNA in lacrimal and salivary glands of patients with Sjögren'ssyndrome.ActaOphthalmol Scand. 1995;73(5):425-30.
29. Payrau P, Hoel J. MononucleoseInfectieuseetKeratite.BullSocFrDermatolSyphiligr. 1958;5-6:381-4.
30. Pinnolis M, McCulley JP, Urman JD. Nummular keratitis associated with infectious mononucleosis. Am J Ophthalmol. 1980;89(6):791-4.
31. Matoba AY, Jones DB: Corneal subepithelial infiltrates associated with systemic Epstein-Barr viral infection. Ophthalmology. 1987;94(12):1669-71.
32. Pflugfelder S, Huang A, Crouse C. Epstein-Barr keratitis after a chemical facial peel. Am J Ophthalmol. 1990;110(5):571-3.
33. Palay DA, Litoff D, Krachmer JH. Stromal keratitis associated with Epstein-Barr virus infection in a young child. Arch Ophthalmol. 1993;111(10):1323-4.
34. Jones J, Gardner W, Newman T. Severe optic neuritis in infectious mononucleosis. Ann Emerg Med. 1988;17(4):361-4.
35. Davie CJ, Ceballos R, Little SC. Infectious mononucleosis with fatal neuronitis. Arch Neurol. 1963;9:265-72.
36. Grose C, Henle W, Henle G, Feorine PM. Primary Epstein-Barr virus infections in acute neurologic diseases. N Engl J Med. 1975;292(8):392-5.
37. Aizawa N. A case of unilateral optic disc swelling with chronic active EpsteinBarr virus infection. ClinOphtal. 2010;4:9779.
38. Wong KW, D'Amico DJ, Hedges TR et al: Ocular involvement associated with chronic Epstein-Barr virus disease. Arch Ophthalmol. 1987;105(6):788-92.
39. Kelly SP. Retinochoroiditis in acute Epstein-Barr virus infection. BJO. 1989;73(12):1002-3.
40. Gallego-Pinazo R. Epstein-Barr virus and acute retinal necrosis in a 5-year-old immunocompetent child. Case report. ClinOphthal. 2008;2(2):4515.
41. Raymond LA, Wilson CA, Linnemann CC. Punctate outer retinitis in acute Epstein-Barr virus infection. Am J Ophthalmol. 1987;104(4):424-6.
42. Kelly SP, Rosenthal AR, Nicholson KG, Woodard CG. Retinochoroiditis in acute Epstein-Barr virus infection. Br J Ophthalmol. 1989;73(12):1002-3.
43. Grossniklaus HE, Aaberg TM, Purnell EW. Retinal necrosis in X-linked lymphoproliferative disease. Ophthalmology. 1994;101(4):705-9.
Recibido: 28 de noviembre de 2012
Aprobado: 5 de enero de 2013
Dra. AdrianneMayulySuñet Álvarez. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: mayuli@horpf.sld.cu