Introducción
La retinopatía de la prematuridad es el más grave de los riesgos que sufren los ojos de los niños que nacen de manera prematura, sin embargo, no es el único. Los defectos refractivos, ambliopía y estrabismo se reportan con mayor frecuencia en este grupo que en los nacidos a término.1,2,3. El desarrollo de retinopatía de la prematuridad incrementa el riesgo de estas enfermedades, lo que condiciona un necesario seguimiento oftalmológico para lograr el máximo desarrollo visual en los infantes.
Por otra parte, los defectos refractivos no corregidos constituyen actualmente la primera causa de discapacidad visual en edad escolar, y uno de los grupos más vulnerables a desarrollar estos defectos son precisamente los niños prematuros. Según la Organización Mundial de la Salud en el mundo se producen anualmente alrededor de 15 millones de nacimientos prematuros y los países de mayores tasas son India, China y Nigeria.4
La emetropización es el proceso de desarrollo refractivo mediante el cual los componentes oculares crecen de manera coordinada para crear un ojo sin error refractivo. Numerosos estudios han demostrado que los bebés prematuros son más susceptibles a todos los errores de refracción, incluida la anisometropía, que sus contrapartes a término.5,6
Se han descrito dos tipos de miopía: la del prematuro y la miopía inducida por retinopatía de la prematuridad severa, en pacientes tratados. Se plantea que en pacientes con retinopatía de la prematuridad leve la enfermedad no contribuye al estado de refracción, más allá lo que es atribuible al parto prematuro. Su incidencia general es alrededor del 30 % y mayor, a menor edad gestacional y peso al nacer.7
La miopía del prematuro se describe por varios autores8,9 como una miopía de inicio temprano, no axil, sino dependiente de un desarrollo alterado del segmento anterior con aumento del grosor y de la potencia del cristalino y poca profundidad en la cámara anterior.
La causa exacta de la alteración en el desarrollo del error de refracción asociada con la retinopatía de la prematuridad no se comprende completamente. Ryan en 195210 analizó el papel del oxígeno en el parto prematuro y postuló que la retirada repentina de oxígeno precipitó una crisis vascular que afectó la vascularización de la coroides, lo que resultó en miopía.
Fielder11 postuló más tarde que la lesión de retinopatía de la prematuridad, al estar ubicada en la parte del ojo que experimenta un crecimiento máximo durante la vida fetal tardía y neonatal temprana, puede ejercer un efecto mecánico sobre la esclerótica anterior y el segmento anterior. Esto se corresponde con la teoría de la detención del crecimiento del segmento anterior, cuyo sello distintivo es una cámara anterior menos profunda y una córnea más curvada.
La edad gestacional y el peso al nacer claramente tienen un efecto temprano sobre el crecimiento ocular, pero, a criterio de Cook y colaboradores12 no explican todas las diferencias en las tasas de crecimiento de las variables biométricas y el error refractivo. Otros consideran que, en pacientes tratados por retinopatía de la prematuridad, la miopía no se relaciona tanto con la etapa aguda de la retinopatía de la prematuridad sino con la cicatrización que genera el efecto del láser en el ojo. Una reciente investigación evaluó la relación entre la cantidad y extensión de la ablación retinal y la severidad del defecto refractivo concluyendo que la extensión de la miopía después de la ablación con láser de la retina para retinopatía de la prematuridad es mayor si se trata un mayor número de quemaduras con láser o una mayor proporción de la retina.13 Iwase demostró que los adultos que habían recibido tratamiento láser diodo en 360° presentaban un espesor mayor del cristalino y disminución de la profundidad de la cámara, con miopías más altas y predisposición al glaucoma, comparado con los que habían recibido ablación parcial de la retina.14
En Cuba el Programa Nacional para la Atención de Retinopatía de la Prematuridad establece el seguimiento por oftalmología pediátrica y baja visión al paciente prematuro que desarrolla la enfermedad, una vez superada la fase aguda; pero no ha sido definido un protocolo de atención específico, en aras de brindar las mejores herramientas terapéuticas. Con el objetivo de describir el comportamiento del defecto miópico hasta el año de vida, en pacientes que desarrollaron retinopatía de la prematuridad, y determinar los principales factores de riesgo relacionados con el mismo, se realizó esta investigación.
Método
Se realizó un estudio descriptivo, longitudinal prospectivo en pacientes que desarrollaron retinopatía de la prematuridad y fueron atendidos en la consulta de Oftalmología Pediátrica y Estrabismo del Instituto Cubano de Oftalmología Ramón Pando Ferrer. Los pacientes nacieron entre enero de 2018 y diciembre de 2019 en los hospitales maternos 10 de Octubre, Ramón González Coro y Eusebio Hernández, de La Habana. El Universo lo constituyeron todos los pacientes que desarrollan retinopatía de la prematuridad de las tres instituciones de salud mencionadas y la muestra quedó conformada por 37 pacientes (74 ojos) que habiendo sido tratados o no por retinopatía de la prematuridad mantuvieron un seguimiento estable en consulta posterior a la fase aguda de la enfermedad. Se clasificó en retinopatía de la prematuridad leve los estadios que no requirieron tratamiento por evolucionar a la regresión de manera espontánea y retinopatía de la prematuridad grave aquellos que sí requirieron intervención, ya fuese con láser, con antiangiogénicos o el procedimiento combinado. Los autores tuvieron en cuenta para la clasificación los criterios del Comité internacional para la Clasificación de la Retinopatía de la Prematuridad.15 Y como criterios de tratamiento los estandarizados por el grupo cooperativo de tratamiento temprano para la retinopatía de la prematuridad.16
El instrumento para la recolección del dato primario fue la encuesta o planilla utilizada por el protocolo nacional de pesquisa, en la que se reflejaron los datos de las historias clínicas de los pacientes. De esta se obtuvieron las variables sexo, edad gestacional al nacer (prematuridad), peso al nacer, tipo de retinopatía de la prematuridad, tratamiento y tipo de tratamiento (estos tres últimos para ojo derecho). Los pacientes fueron examinados a los seis y 12 meses de vida. En cada consulta se realizó examen oftalmológico general incluyendo refracción por el método de esquiascopía, previa dilatación con ciclopentolato al 0,5 %. Se consideró retinopatía de la prematuridad leve aquella con resolución espontánea sin necesidad de tratamiento y retinopatía de la prematuridad grave cuando fue necesario una intervención, ya fuese con láser, antiangiogénicos o combinación de ambos.
El procesamiento estadístico se realizó mediante el paquete SPSS (Statistical Pakage for Social Sciences). Se empleó el procesamiento estadístico descriptivo, con un análisis sustentado en el empleo de gráficos y tablas de distribución de frecuencia. El análisis se realizó utilizando: frecuencias absolutas y relativas; medidas de tendencia central: media; medidas de dispersión: mínimos, máximo, y desviación estándar. Para variables numéricas se compararon las medias aritméticas por la prueba T para igualdad de medias. Para variables no numéricas se utilizó el método de tabla de contingencia chi cuadrado. Se consideró una p significativa menor de 0,05.
En todos los casos se contó con el consentimiento informado de los padres o tutores del paciente para la investigación acorde a la Declaración de Helsinki.
Resultados
Se evaluaron 37 pacientes prematuros que desarrollaron retinopatía de la prematuridad, 22 de sexo masculino y 15 del sexo femenino.
La media de edad gestacional y peso al nacer fueron 30,2 semanas (mínimo 26,2; máximo 34,1) y 1 287g (mínimo 9 00 g; máximo 2 100 g), respectivamente. Al diferenciarlos por tipo de retinopatía de la prematuridad en los que tuvieron regresión espontánea la edad gestacional fue 30,7 semanas, peso al nacer 1 315 g y en los de retinopatía de la prematuridad grave 28,9 semanas, peso al nacer 1 213 g.
El mayor número de pacientes estuvo comprendido entre las 28 y 32 semanas de edad gestacional al nacer (81,1 %) y con peso al nacer entre 1 000 g y 1 500 g (62,2 %).
Diez pacientes desarrollaron retinopatía de la prematuridad grave por lo cual recibieron tratamiento, seis con fotocoagulación láser, uno con inyección de antiangiogénico (bevacizumab) y tres con terapia combinada (fotocoagulación + bevacizumab). En cada caso el tratamiento aplicado fue el mismo en ambos ojos; 27 pacientes tuvieron una a leve con regresión espontánea.
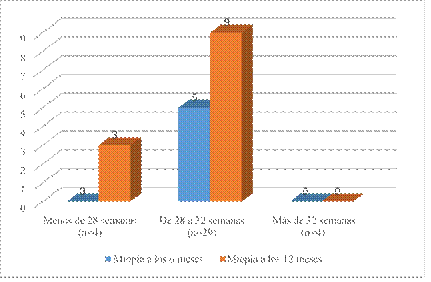
A los seis meses cinco ojos de 27 pacientes (considerando solo los ojos derechos) presentaron miopía, lo que representa el 18,5 %. A los 12 meses este valor se incrementó a 44,4 %.
Al evaluar la variable prematuridad no hubo significación estadística en su relación con la miopía en ninguna de las consultas (a los 6 meses p = 0,450/ y a los 12 meses p = 0,072). No obstante hay una disminución del valor de la p entre la primera y segunda evaluación.
De los pacientes que nacieron con más de 32 semanas ninguno desarrolló miopía hasta los 12 meses (Fig. 1).
Si tenemos en cuenta la media del equivalente esférico según prematuridad (Tabla 1) el menor valor a los seis meses les correspondió a los nacidos con menos de 28 semanas. Sin embargo, este también es el grupo en que menos disminuyó con respecto a la consulta del año.
Tabla. 1 Distribución del equivalente esférico en cada consulta según prematuridad
| Prematuridad | Equivalente esférico (seis meses) | equivalente esférico (12 meses) | Diferencia |
|---|---|---|---|
| Menos de 28 semanas | 1,18 | 1,125 | 0,055 |
| De 28 a 32 semanas | 1,3 | 0,57 | 0,73 |
| Más de 32 semanas | 2,21 | 1,215 | 0,995 |
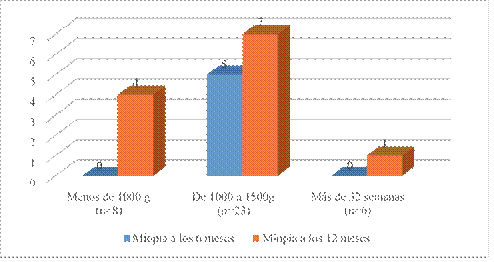
Tampoco mostró significación estadística la relación entre miopía y peso al nacer (a los 6 meses p = 0,172/ y a los 12 meses p = 0,397) (Fig. 2).
Los pacientes que nacieron con un peso de 1 000 g a 1 500 g mostraron el menor equivalente esférico a los seis meses y también a los 12 meses (Tabla 2).
Tabla 2 Distribución del equivalente esférico en cada consulta según peso al nacer
| Peso al nacer | Equivalente esférico (6 meses) | Equivalente esférico (12 meses) | Diferencia |
|---|---|---|---|
| Menos de 1000g | 1,4 | 0,8 | 0,6 |
| De 1 000 g a 1 500 g | 1,02 | 0,14 | 0,88 |
| Más de 1 500 g | 2,4 | 1,4 | 1 |
En cada caso el equivalente esférico se expresó positivo, por debajo de 2,50 D y disminuyo entre los seis y 12 meses de vida.
De acuerdo con el tipo de retinopatía de la prematuridad (leve o grave), si bien a los seis meses no mostró significación la presencia de miopía, al año sí se hizo manifiesta la relación (Tabla 3). De los 10 pacientes con retinopatía de la prematuridad grave, siete ojos derechos desarrollaron esferas negativas.
Tabla 3 Distribución de pacientes con miopía en ojos drechos a los seis y 12 meses según tipo de retinopatía de la prematuridad
| Defecto miópico del ojo derecho | Retinopatía de la prematuridad leve | Retinopatía de la prematuridad grave | p | ||
|---|---|---|---|---|---|
| (n = 27) | (n = 10) | ||||
| No | % | No | % | ||
| 6 meses | 2 | 7,4 | 3 | 30 | 0,074 |
| 12 meses | 5 | 18,5 | 7 | 70 | 0,003 |
Del total de ojos con retinopatía de la prematuridad grave (20) a los seis meses el 35 % mostraron defectos miópicos y a los 12 meses el 65 %.
Desde el punto de vista cuantitativo el equivalente esférico en ambos tiempos se obtuvo significación estadística con el tipo de retinopatía de la prematuridad, considerando el ojo derecho de cada paciente (Tabla 4).
Tabla 4 Distribución del equivalente esférico del ojo derecho por consulta según tipo de retinopatía de la prematuridad
| Tipo de retinopatía de la prematuridad | Equivalente esférico (seis meses) | Equivalente esférico (12 meses) | p |
|---|---|---|---|
| Retinopatía de la prematuridad leve | 1,72 | 1,05 | 0,008 |
| Retinopatía de la prematuridad grave | 0,12 | 0,09 | 0,002 |
De toda la muestra solo unpaciente requirió corrección óptica al año de edad por miopía (mayor o igual a 4 D) y anisometropía (mayor o igual a 4D). Se correspondió a un paciente tratado por retinopatía de la prematuridad.
Discusión
El sexo masculino se considera en algunos países un factor de riesgo para el desarrollo de retinopatía de la prematuridad, y algunos artículos lo evidencian.17 Aunque en Cuba no está claramente demostrado Castro Pérez y colaboradores18 reconocen el predominio del sexo masculino en su muestra, así como en estudios previos. También Soto Fors y colaboradores19 en un estudio de pacientes con retinopatía de la prematuridad en embarazos múltiples, de una de las maternidades que coincide con el nuestro, encontró mayor número de varones con retinopatía de la prematuridad, con significación estadística.
Desde el año 1997 se inició en Cuba el Programa Nacional de Prevención de
Ceguera por retinopatía de la prematuridad con el objetivo de minimizar la incidencia y la prevalencia de esta enfermedad.20 La tasa de incidencia de retinopatía de la prematuridad no supera los 3/1 000 nacidos vivos pero la presencia de casos inusuales con mayor peso y edad gestacional al nacer que han requerido tratamiento, ha hecho que los indicadores límites de tamizaje se establezcan en 35 semanas y 1 700 g de peso al nacer.20 A esto se añade un tercer criterio a juicio del neonatólogo de pacientes prematuros con mayor peso y edad gestacional, pero con factores de riesgo como sepsis grave, oxigenoterapia prolongada, intervención quirúrgica, entre otros.
Los criterios de pesquisa de retinopatía de la prematuridad varían entre distintos países, según su desarrollo social y económico que impacte sobre todo en la unidad de cuidados intensivos neonatales. Las economías de ingresos altos se centran principalmente en los bebés con un peso corporal inferior a 1 250 g13 mientras que otros países tienen criterios más elevados: peso corporal menor de 2 000 g o edad gestacional menos de 34 semanas.17
En este estudio los niños tenían un peso medio al nacer de 1287 g (DE ± 305 g) y una edad gestacional media de 30,2 semanas (DE ± 2,0 semanas). Son más altas que las informadas por estudios en los que las pautas de detección de la retinopatía de la prematuridad eran de peso corporal menor de 1 250 g13 y más bajas que las analizadas por muchos otros autores con criterios de detección más
altos.(17)
Con relación al número de ojos miopes nuestros resultados difieren de autores como Vujanović y colaboradores21). quien reportó que a los nueve meses de edad ya era la miopía el defecto más frecuente en 132 ojos tratados.
Que la prematuridad y el peso al nacer no muestren significación estadística con la presencia de miopía en nuestro estudio, puede depender del tamaño de la muestra, las diferencias del número de pacientes entre los grupos y la edad máxima estudiada, pues la mayoría de los artículos se refieren a edades mayores a la representada, de dos a seis años.
Desde el punto de vista cuantitativo los mayores valores de equivalente esférico corresponden a los nacidos con más de 32 semanas y de 1 500 g, lo cual sugiere, no obstante, que tienen una mayor protección ante la miopía, los pacientes con estas características.
Para algunos autores el peso al nacer y la edad gestacional son significativamente menores en pacientes con retinopatía de la prematuridad.22,23
Fustamante Sánchez y colaboradores17 no encontraron diferencias estadísticamente significativas en la edad gestacional de pacientes con retinopatía de la prematuridad cicatrizal con respecto a los de retinopatía de la prematuridad grave, pero sí marcó diferencias el peso al nacer.
Este estudio evidencia relación estadística entre el tipo de retinopatía de la prematuridad de acuerdo a su gravedad con el desarrollo de miopía; en pacientes con retinopatía de la prematuridad grave es más frecuente este defecto refractivo, y de los seis a 12 meses el riesgo se incrementa, y mostrar un equivalente esférico de menor cuantía.
En comparación con publicaciones previas Wang y colaboradores24 concluyen que el grupo de retinopatía de la prematuridad severa progresó rápidamente hacia la miopía, particularmente durante los primeros 1,3 años.
Similares resultados obtuvieron Fu y colaboradores25 quienes afirman que el equivalente esférico está estrechamente relacionado con el desarrollo de retinopatía de la prematuridad.25
El estudio más completo sobre miopía en pacientes tratados por retinopatía de la prematuridad proviene de la serie de publicaciones del grupo cooperativo de tratamiento temprano para la retinopatía de la prematuridad.26,27). En ojos no tratados asignados al azar, se encontró que había una incidencia general de miopía del 21 % al año, cayendo al 16 % a los 4,5 años de edad. La incidencia de miopía en ojos sin retinopatía de la prematuridad fue del 10 %; en ojos con retinopatía de la prematuridad en regresión espontánea, 20 %; y en ojos con retinopatía de la prematuridad severa y secuelas, 80 %.
Los criterios para la corrección óptica en los niños se obtuvieron de la propuesta de la Academia Americana sobre el defecto ambliopizante según la edad.28 Solo un paciente sobrepasó los límites de miopía permisible para el año de edad, acompañado también de anisometropía miópica.
A partir del incremento de defectos refractivos en general y de miopía en particular es consenso entre los autores que los pacientes con retinopatía de la prematuridad grave deben ser monitoreados con frecuencia.29,30 La mayor disyuntiva está en la evaluación y seguimiento de los pacientes que desarrollan retinopatía de la prematuridad con regresión espontáneamente. Para algunos debe comenzar entre los 18 y 24 meses,29 los más osados proponen que entre los tres y cuatro años.31 Se coincide con Kaya y colaboradores31 quienes afirman que también deben ser monitoreados cuidadosamente para no pasar por alto posibles aumentos en las condiciones refractivas.
Conclusiones
Hasta los 12 meses de vida la prematuridad y el peso al nacer no constituyeron variables que influyeran en la aparición de miopía en pacientes con retinopatía de la prematuridad. Por el contrario, la retinopatía de la prematuridad grave sí se asoció con una mayor miopía. La detección temprana, seguimiento y corrección adecuada de los defectos refractivos en pacientes prematuros son requisitos para evitar la ambliopía y lograr un desarrollo visual óptimo.