Introducción
El globo ocular está en contacto con el medio ambiente a través de la superficie ocular, que está integrada por diversas estructuras oculares como párpados, córnea, conjuntiva, sistema de inervación y película lagrimal (PL) que la recubren. Esta última, constituye el primer elemento del sistema óptico ocular. Además, posee otras funciones, como la lubricación y nutrición de la superficie ocular, acción antimicrobiana, protección mecánica en el parpadeo y eliminación de restos celulares. Su formación y estabilidad en el ojo sano y enfermo, dependen de la composición y propiedades físicas de la lágrima.¹
La estimulación y la secreción de la glándula lagrimal se produce a través del control neuronal y hormonal. Esta glándula recibe inervación de los nervios simpáticos, parasimpáticos y sensoriales. Alteraciones en este nivel conllevan una inhibición de la glándula,2,3 con subsecuentes trastornos.
En el año 2007, el Dry Eye WorkShop II (DEWS II) dio a conocer la primera definición consensuada y aceptada a nivel global sobre la enfermedad del ojo seco (EOS).4 Sin embargo, en el año 2017 a causa del trabajo mancomunado entre el Tear Film and Ocular Surface Society (TIFOS) y el DEWS II se redefinió como una enfermedad multifactorial de la superficie ocular caracterizada por una pérdida de la homeostasis de la película lagrimal, acompañada por síntomas oculares, en los cuales la inestabilidad e hiperosmolaridad de la PL, inflamación y daño de la superficie ocular, y anormalidades neurosensoriales juegan roles etiológicos.5
El síndrome de disfunción lagrimal es un padecimiento multifactorial, derivado de una deficiencia o evaporación excesiva de la lágrima. En el modelo clásico se considera a la lágrima formada por tres subcapas: mucosa, acuosa y lipídica.3) La mucosa favorece la adherencia de la lágrima a la córnea. Es producida de forma esencial por las células de Globet y secretada por la glándula lagrimal principal. Su función es proveer de nutrientes y oxígeno a la córnea; mientras que la lipídica se produce en las glándulas de Meibomio (DGM) y se encarga de retrasar el tiempo de evaporación de la lágrima.
Si alguna de estas subcapas presenta deficiencias en la función o producción, el EOS puede aparecer con síntomas como sequedad, irritación, parpadeo frecuente, sensibilidad ocular que se incrementa al exponerse a vapores o aire acondicionado, entre otros; lo que causa daño en la superficie ocular interpalpebral.3
La EOS tiene una elevada prevalencia a nivel mundial. La carga económica en la sociedad, y el impacto de la enfermedad en el individuo, a través de su efecto sobre la visión, calidad de vida y productividad laboral, así como en la esfera psicológica y física del mismo, son considerables. Atendiendo a lo anterior, se realizó una exhaustiva revisión de la literatura, con el objetivo de describir el contexto actual de la enfermedad del ojo seco, lo cual puede contribuir a realizar un diagnóstico precoz y establecer un adecuado manejo terapéutico.
Métodos
Se realizó una búsqueda sistemática de la literatura científica de mayor impacto, con el uso de las siguientes palabras clave (MeSH): ojo seco; EOS; lágrima; hiperosmolaridad, disfunción lagrimal. Se limitó la búsqueda por tipo de diseño (revisiones, series de casos, estudios descriptivos, analíticos y experimentales, metaanálisis). No se tuvo en cuenta el idioma de la publicación.
Las bases de datos utilizadas fueron: PubMed, Ebsco Host, Lilacs y Science Direct. Se identificaron y evaluaron 114 artículos, de los cuales, se seleccionaron 23, por su pertinencia para el estudio.
Descripción de la enfermedad del ojo seco
Se ha descrito que la EOS tiene mayor incidencia en mujeres que en hombres,6 debido a una disminución de las hormonas sexuales (estrógenos, andrógenos y prostaglandinas), que regulan la superficie ocular.7) Además, existe una relación proporcional entre los signos y síntomas y el avance de la edad.8) El Womenʹs Health Study (WHS) estimó una mayor frecuencia de síntomas graves en mujeres hispanas y asiáticas en comparación con las caucásicas.6
La prevalencia de la enfermedad varía, según las diferentes investigaciones, en dependencia de los criterios diagnósticos y la población estudiada. Se estima que oscila entre el 5 % y el 50 % en estudios que se basaron en síntomas con o sin signos, entre el 8,5 % y el 30,1 % si se hace el diagnóstico mediante la asociación de síntomas y signos, con un incremento hasta el 75 % si solo se registran los signos.9
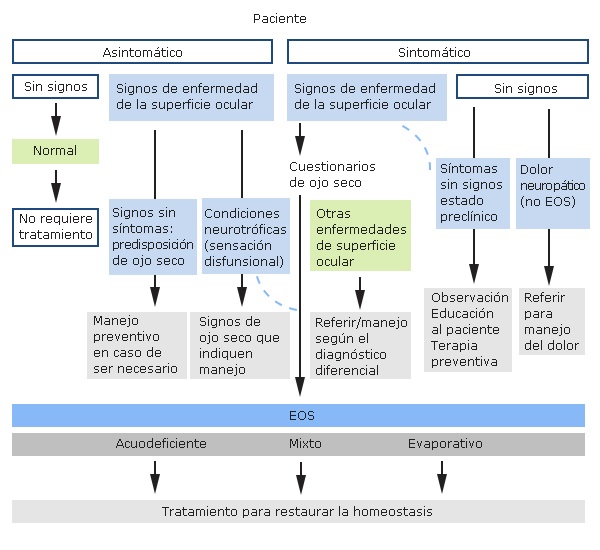
La clasificación actual se aleja por completo de aquellas separaciones binarias por categorías independientes. El nuevo sistema se basa no solo en la etiopatogenia, sino que aplica una metodología de diagnóstico que separa a los pacientes en función de su sintomatología y signos para su correcta catalogación (fig. 1).
Una vez clasificado el paciente en función de los síntomas y signos, el nuevo diagrama los vuelve a agrupar en función de la etiopatogenia:
Evaporativa: que obedece a deficiencias en la capa lipídica por disfunción de las glándulas de Meibomio, inadecuado cierre palpebral, baja frecuencia del parpadeo, uso de preservativos, deficiencias de vitamina A y alergias.5
Acuodeficiente: se genera como consecuencia de trastornos de las glándulas lagrimales que conllevan a un descenso en la producción acuosa, está asociado con frecuencia a enfermedades autoinmunes e inflamatorias sistémicas (como el síndrome de Sjögren) o mixta.10
Estas categorías no son excluyentes, sino más bien concurren como un continuo, en el que coexisten ambos estados con una de las categorías, con una más presente que la otra, pero sin excluirla. Se observa una tendencia hacia el componente evaporativo hasta en un 80 % de los casos.
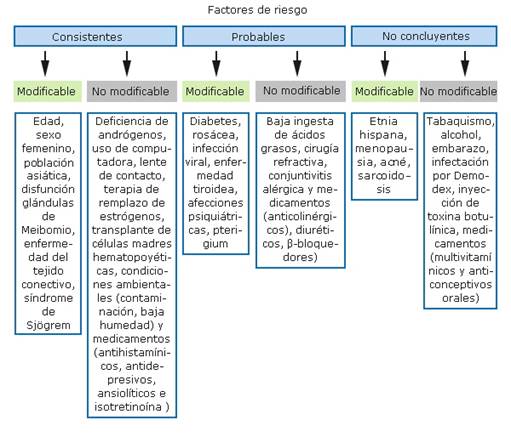
Existe una extensa lista de factores de riesgo para el desarrollo de la EOS, pues la película lagrimal y la superficie ocular forman parte de una unidad funcional dinámica que está influenciada por el estilo de vida, la exposición ambiental, las enfermedades metabólicas y oculares, entre otras. Para mejorar su comprensión, la TFOS DEWS II clasifica los factores de riesgo en no modificables y modificables, que se subdividen a su vez en consistentes, probables y no concluyentes4 (fig. 2).
La inestabilidad de la PL, la hiperosmolaridad lagrimal, apoptosis e inflamación contribuyen a la fisiopatología de la EOS. El componente inflamatorio se reconoce cada vez más, e incluso ha sido implícito en la última definición de ojo seco del Dry Eye Workshop II. Es importante, que en la actualidad, la mayor parte de los tratamientos del ojo seco se basen en estrategias para su control.11) Estas etiologías no se excluyen mutuamente, sino que están conectadas entre sí de manera cíclica, actuando como puntos de entrada, a lo que se conoce como círculo vicioso de la EOS (fig. 3).
Desde el DEWS se emplea esta nomenclatura para referirse a la cadena de acontecimientos que ocurren y explican por qué la EOS es capaz de autoperpetuarse en el tiempo y volverse crónica si no se trata de manera adecuada. El ojo seco acontece siempre que algún componente de la unidad lagrimal funcional, que incluye los párpados, glándulas lagrimales y nervios sensitivos y motores, sean incapaces de mantener la PL estable.6
La disfunción de las DGM, por obstrucción ductal consecuencia de hiperqueratinización, atrofia del tejido glandular secundario al envejecimiento, y lesión de las glándulas lagrimales asociado a enfermedades autoinmunes, donde se genera destrucción acinar, y constituyen las principales causas de ojo seco12 (fig. 3). Por otra parte, cualquier entidad que altere la conducción nerviosa desde la superficie ocular hacia las glándulas, como es el caso de la cirugía refractiva, puede lesionar las terminaciones nerviosas corneales y alterar la conducción nerviosa indispensable para la producción lagrimal refleja.13,14)
La alteración en la producción o composición de la película lagrimal acarrea un aumento en la osmolaridad. La hiperosmolaridad de la lágrima genera deterioro de las células epiteliales y caliciformes, conduce a disminución de humectabilidad, y por tanto a ruptura precoz de la PL, e incrementa aún más la osmolaridad y actúa como un mecanismo perpetuador.11,14
Una película lagrimal inestable promueve la activación de células del sistema inmunitario, liberación de moléculas proinflamatorias como citoquinas, enzimas proteolíticas, metaloproteinasas, que desencadena la cascada inflamatoria en la superficie ocular, y genera apoptosis de las células caliciformes, alteración en la formación del glicocálix y deterioro celular epitelial corneal y conjuntival.15 Constituye un reto, por la extensa variedad de síntomas y signos, así como por la ambigüedad en la etiopatofisiología de la enfermedad. (fig. 3).
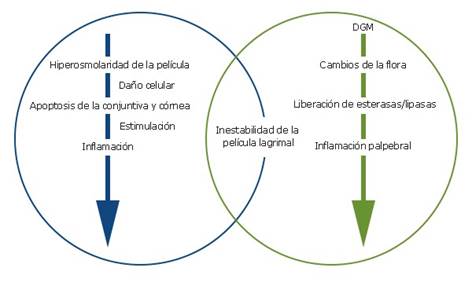
Fig. 3 Círculo vicioso del ojo seco (azul) y segundo círculo vicioso (en verde) del EOS. El punto de coincidencia es la inestabilidad de la película lagrimal. Adaptado de Baudouiny otros.15
El grupo TFOS DEWS II propone:16
Descartar aquellas condiciones que puedan simular el ojo seco, a través de preguntas de triaje.
Aplicar cuestionarios de detección que permitan cuantificar los síntomas y monitorizar la respuesta al tratamiento. Los cuestionarios recomendados por el DEWS, son el DEQ5 (Dry Eye Questionnaire) y test de OSDI (Ocular Surface Disease Index); puntajes ≥ 6 y valores ≥ 13, respectivamente que apoyan el diagnóstico de EOS.5
Dentro del grupo TFOS DEWS II se consideran datos de disrupción de la homeostasis de la superficie ocular y diagnóstico definitivo de EOS si existen síntomas y por lo menos la presencia de uno de los tres signos específicos siguientes:16
Reducción del tiempo de ruptura de la película lagrimal (TBUT) < 10 s. Representa el tiempo que tarda en romperse la lágrima después del parpadeo. Sirve para medir la estabilidad de la película lagrimal. Tiene una especificidad y sensibilidad entre el 60 y 70%.17
Osmolaridad elevada o una disparidad interocular (EOS es generalmente simétrica): la medición de la osmolaridad de la lágrima es controvertido pues muestra variaciones significativas y no está siempre al alcance en los servicios de atención.18
Tinción positiva de la superficie ocular: córnea, conjuntiva o margen palpebral. Se puede realizar con fluoresceína, rosa de bengala o verde de lisamina. La fluoresceína es la tinción vital más usada en la práctica. Se hace más aparente dos minutos después de la instilación y se vuelve más intensa si se observa bajo un filtro amarillo. Más de cinco puntos de tinción se considera un resultado positivo. La escala de Oxford es la más utilizada para determinar el grado de tinción corneal y la severidad de la enfermedad.17,18
La prueba de Shirmer se usa para evaluar cantidad de lágrima que produce la glándula lagrimal. No se utiliza anestesia local. Se sabe que tiene una gran variabilidad, por lo que no se debe usar como único criterio diagnóstico.1 (fig. 4)
Se utilizan tiras de papel blanco o de filtro Whatman 5 x 35 mm, se pliega 5 mm en un extremo y se inserta en el fondo de saco conjuntival en la unión del tercio externo y el tercio medio del párpado inferior. Se indica al paciente cerrar los ojos ligeramente. A los cinco minutos se extraen las tiras y se mide con una regla milimetrada el grado de humedad a partir del pliegue. Puede realizarse con o sin anestesia y en condiciones estimuladas. El valor anormal es < 10 mm.
Esta prueba se puede realizar con anestesia, también llamada prueba de secreción basal. Sin embargo, ha demostrado una mayor variabilidad que la prueba sin anestesia.5,6
Después del diagnóstico de EOS basado en los síntomas y uno o más de los marcadores de homeostasis, se pueden realizar pruebas de clasificación a través de meibografía, interferometría lipídica y mediciones del volumen lagrimal. Estos exámenes ayudan a determinar si el paciente se encuentra dentro del espectro de un ojo seco acuodeficiente o evaporativo, y permitirá establecer la gravedad del padecimiento para guiar el tratamiento.
La medición de citoquina, metaloproteinasas, factor de necrosis y citologías de impresión son útiles para la evaluación de la inflamación. Un patrón determinado de citoquinas en la lágrima puede dar información del tipo de célula T involucrada en el proceso inflamatorio u orientar el diagnóstico hacia otras enfermedades como la alergia ocular.(19 Por otra parte, la elevación de metaloproteinasas en la película lagrimal indica pérdida de uniones celulares y alteración en la barrera epitelial ocular.6 Esta entidad se puede abordar de acuerdo con la gravedad de la enfermedad, el subtipo de ojo seco o la capa de la película lagrimal afectada.6,17,20
En cualquier caso, el primer paso es la modificación de la dieta (rica en ácidos grasos esenciales, omega 3 y 6) y de factores ambientales (no orientar los ventiladores hacia la cara, evitar ambientes con aire acondicionado, uso de gafas, masaje de los párpados), tratar trastornos predisponentes como la blefaritis y la potencial modificación de medicación tópica o sistémica que empeoren el cuadro. Se contraindica el uso de lentes de contacto con modalidad de corrección óptica, en casos de ojo seco moderado a grave.
El tratamiento de elección sigue siendo hoy en día a base de lubricantes oculares o lágrimas artificiales (carmelosa sódica, hidroxipropil-metilcelulosa, hialuronato de sodio, hidroxipropil-guar). En casos leves, usar de 3-4 veces al día, moderado cada 1-2 horas (preferir sin conservantes para evitar toxicidad).
Aquellos pacientes con cuadros leves de ojo seco evaporativo requerirán higiene palpebral, compresas tibias, suplementos lagrimales, oclusión de puntos lagrimales (colágeno, tapones de silicona, cianoacrilato, láser de argón, cauterio o diatermia) o secretagogos.20
Pacientes con ojo seco moderado a grave requerirán unido a lo anterior el uso de geles, emulsiones o ungüentos, lágrimas artificiales sin conservantes, sustitutos biológicos (suero autólogo al 20 %) y medicamentos dirigidos al control de la inflamación, como esteroides tópicos o inmunomoduladores (ciclosporina A oftálmica).21,22
Además de la opción de tratamiento quirúrgico descrita de forma previa, se puede realizar: parche conjuntival o desplazamiento del punto, sutura o exéresis de los canalículos, trasplante glandular (salivar y submandibular hacia los fórnix, trasplante de mucosa (membrana amniótica). En casos graves puede ser reducción de la fisura palpebral, cisternoplastia, tarsorrafia prepunctal, puntal, lateral o total. En muy graves con grandes trastornos en la superficie ocular se puede realizar la colocación de dacrioreservorio abdominal.23
Se concluye que es relevante comprender el desarrollo de la EOS, pues hoy en día representa un problema para la salud pública mundial. En los últimos 20 años se ha logrado alcanzar una mejor comprensión de la fisiopatología de la enfermedad, lo que mejorará aún más a través de la investigación continuada. El diagnóstico y tratamiento representa un reto, lo que obedece a la complejidad de esta entidad. La identificación temprana de los subtipos y el control de la gravedad es crucial para mejorar el bienestar del paciente.