Introducción
Desde su aparición, las imágenes multimodales se han convertido en una herramienta esencial para el diagnóstico y seguimiento de enfermedades retinales y coroideas. La tomografía de coherencia óptica de dominio espectral (Spectral Domain Optical Coherence Tomography SD-OCT por sus siglas en inglés) es la más popular. En 2013, un grupo de investigadores aprovechó su singularidad para describir distintas presentaciones de una misma entidad.1 La maculopatía media aguda paracentral (Paracentral Acute Middle Maculopathy PAMM por sus siglas en inglés) y la neurorretinopatía macular aguda (Acute Macular Neuroretinopathy AMN por sus siglas en inglés); ambas son dos variantes distintas con una base fisiopatológica similar.2
La PAMM en el SD-OCT se caracteriza por una banda hiperreflectiva que se ubica en la capa nuclear interna que puede extenderse desde la capa plexiforme interna a la plexiforme externa en su fase aguda y en la fase crónica se observa adelgazamiento de la capa nuclear interna por atrofia.1 En cambio, en la AMN tipo 2 la banda hiperreflectiva se ubica en la capa nuclear externa que involucra la zona elipsoide y la zona de interdigitación en la fase aguda, y adelgazamiento de esta capa en la fase crónica.2
Ambas variantes se identifican como lesiones isquémicas causadas por un flujo fallido en el plexo vascular intermedio y/o profundo; por lo que la presencia de la banda hiperreflectiva en el SD-OCT indica un infarto de las capas correspondientes, causado por la perfusión deficiente en todo el sistema capilar retiniano. Es una manifestación de la cascada isquémica retiniana, en la que las formas más leves de isquemia se desarrollan en el extremo venular del plexo profundo, es decir prevenular. Las formas moderadas avanzan horizontalmente para involucrar difusamente la capa nuclear interna y las formas graves avanzan verticalmente para infartar la retina interna y parte de la externa.3
Los pacientes que presentan estos hallazgos en la etapa aguda acuden a la consulta de oftalmología por presentar uno o varios escotomas paracentrales en uno o ambos ojos, que comienzan de manera aguda y suelen ser permanentes o de resolución variable. La agudeza visual (AV) está levemente reducida si el escotoma es central y hay una apariencia normal del fondo de ojo, o con alguna de las siguientes variantes: lesión grisácea profunda parafoveal (PAMM)2,3 y lesiones intrarretinianas de color marrón rojizas en forma de cuña, cuyos ápices tienden apuntar hacia la fóvea (AMN).3,4 Existen reportes de casos que informan otros síntomas como visión borrosa, miodesopsias o metamorfopsias;5 sin embargo, después de un tiempo de ocurrido los primeros síntomas los hallazgos no son evidentes, pues el fondo de ojo no muestra lesiones y el SD-OCT solo muestra disminución de las capas afectadas (en la PAMM la capa nuclear interna y la AMN tipo 2 la capa externa con o sin disrupción de esta) en las imágenes tomadas en alta resolución.4
Como diferencias fundamentales entre la PAMM y la AMN tipo 2 se puede decir que la PAMM se describió como una variante de la AMN a la llegada del SD-OCT. Ambas se consideran condiciones distintas con características superpuestas por lo que se reconoce a la AMN tipo 1 o PAMM cuando se presentan hallazgos por SD-OCT a nivel de la capa nuclear interna y la AMN tipo 2 como la presencia de anormalidades de las capas retinianas externas de la mácula, que puede involucrar o no al epitelio pigmentario de la retina. La edad promedio de los pacientes con PAMM es de aproximadamente 59 años, con predominio en hombres; mientras que los pacientes con lesiones de AMN tipo 2 es más común en jóvenes y en mujeres. La PAMM se asocia con diversas enfermedades vasculares retinianas, mientras que la AMN es una entidad de enfermedad independiente.2,4,6
Hay múltiples causas relacionadas con ambas presentaciones. Si bien la PAMM se asocia con frecuencia a las enfermedades vasculares retinianas primarias como la retinopatía diabética, retinopatía hipertensiva, oclusiones arteriales y venosas, existen otras causas sistémicas relacionadas con esta enfermedad.7 Los estados de hipercoagulabilidad (embarazo) las complicaciones iatrogénicas de algunos procedimientos (pos-vitrectomía, pos-extracción de cataratas, pos-inyección intravítrea de anti-VEGF),8 efectos secundarios de medicamentos (inhibidores de la fosfodiesterasa-5),9 afecciones neurológicas como migrañas,5 traumatismos,10 enfermedades febriles (infección por Coxsackie A4),11 entre otros son causas comunes para que ocurran ambas enfermedades. En los tres últimos años el antecedente de infección por COVID-19 así como, la vacunación (AstraZeneca, contra H1N1 e Influenza) fueron reportes importantes relacionados tanto en pacientes que desarrollaron AMN y PAMM.12
La angiografía por tomografía de coherencia óptica (Optical Coherence Tomography Angiography OCTA por sus siglas en inglés) sirve como medio auxiliar para corroborar el diagnóstico en algunos casos. Con ella se puede detectar el flujo dentro de cada plexo capilar, proporcionando una resolución en profundidad. Las hipoperfusiones de la capa capilar profunda se encuentran tanto en lesiones agudas como crónicas demostradas mediante segmentación OCTA del plexo profundo, (que se localiza con la hiperreflectividad en el SD-OCT), debido a que el flujo capilar profundo comprometido es la causa de dichas lesiones. Estas también pueden mostrar un flujo preservado del plexo capilar profundo, que rápidamente se deteriora a medida que se produce la atrofia de la capa nuclear interna en lesiones crónicas (mejor explicado en la PAMM que en la AMN tipo 2). Aunque la hipoperfusión de este plexo es única para la PAMM, las lesiones también pueden mostrar un flujo reducido en el plexo capilar intermedio y el plexo capilar superficial asociado y se han relacionado con la distorsión de la zona avascular foveal.3,4
Por tanto, el OCTA confirma en muchos casos de PAMM una asociación de flujo reducido en los plexos capilares intermedio, profundo y ocasionalmente superficiales; mientras que en la AMN tipo 2 ocurre asociación con flujo reducido en el plexo capilar profundo solamente.6) En las características del OCTA de la PAMM se describen tres patrones: arteriolar (a lo largo de la arteria retiniana principal), globular (alrededor de los capilares distales) y en forma de helecho (a lo largo de las venas retinianas); aunque es factible una combinación de patrones. En cambio, en la AMN tipo 2 no están bien descritos dichos patrones; las lesiones de ambas variantes estaban relacionadas con oclusiones vasculares capilares. Sin embargo, el plexo capilar primario afectado en estas entidades sigue siendo un tema de discusión, y las posibilidades incluyen los plexos capilar superficial, intermedio y profundo de la retina, así como el coriocapilar.13
Otras pruebas que pueden apoyar el diagnóstico tanto de la AMN tipo 1 como el tipo 2 son las pruebas de campo visual automatizadas de Humphrey 10-2 y los registros de la cartilla de Amsler que ayudan a documentar y monitorear la progresión del escotoma.7 Aunque la autofluorescencia de fondo dificulta la identificación de ambas se puede observar una sutil hipofluorescencia, debido al bloqueo de las fuentes más profundas de la señal autofluorescente y ocasionalmente se puede apreciar el patrón perivenular de lesiones salteadas en el caso de la PAMM. Algo a tener en cuenta es que ambas variantes no se pueden detectar mediante angiografía con fluoresceína; en parte debido a la dispersión de las capas retinianas más superficiales (de forma especial en la PAMM), por lo que la angiografía basada en tintes, no proporciona una resolución adecuada en profundidad y, por lo tanto, no puede ilustrar adecuadamente el plexo vascular profundo.5,8
En el seguimiento se observó que en el SD-OCT de los pacientes con diagnóstico de AMN que presentaron: hiperreflectividad en la capa plexiforme externa y la capa nuclear externa con el tiempo, la reflectividad de la plexiforme externa se recuperó y las lesiones progresaron hasta la interrupción de las uniones del segmento interno/segmento externo del fotorreceptor y del segmento externo/epitelio pigmentario de la retina; lo que resulta en un adelgazamiento crónico de la capa nuclear externa. Las lesiones de la retina externa en las etapas posteriores de AMN se deben a una disminución en la densidad de los conos o una disminución en la guía de ondas de los conos por medio de la oftalmoscopia de barrido con láser y óptica adaptativa.4 Por el contrario, las lesiones de PAMM que presentaron hiperreflectividad de la capa plexiforme interna y de la capa nuclear interna, disminuyeron sin afectar la retina externa. Debido a las causas subyacentes de origen vascular es que se hacen permanentes en el tiempo y los pacientes mantienen el escotoma paracentral.5 Hasta el momento, no se ha identificado un tratamiento adecuado después del evento, por lo que solo es posible trabajar sobre los factores de riesgo.4
En la actualidad, la mayoría de los estudios revisados sobre el tema son presentaciones o series de casos pequeños realizados en centros médicos aislados. No se registró ninguna información sobre estas afecciones en Cuba. Esta publicación se realiza con el objetivo de presentar dos casos con cuadros clínicos similares y de diferentes presuntos diagnósticos. También se destaca el valor de las imágenes multimodales como medio auxiliar de diagnóstico.
Presentación de caso
Caso1
Se presenta una paciente de 29 años de edad que acudió a la consulta de retina del Instituto Cubano de Oftalmología Ramón Pando Ferrer por presentar disminución de la agudeza visual del ojo izquierdo (OI) de forma súbita con dos meses de evolución. Antecedentes de haber padecido dengue hace dos años y recibió vacunación contra la COVID-19 (Abdala, tres dosis entre el 2020-2021 y dos refuerzos en los últimos cinco meses). La paciente refiere que la disminución de la visión ocurrió después del segundo refuerzo de la vacuna Abdala. Era gastronómica de profesión y con antecedentes familiares de abuelo materno con glaucoma.
En la psicofísica visual se halló la agudeza visual sin corrección (AVSC) con cartilla de Snellen era de 1,0 en el ojo derecho (OD) y 0,6 en el ojo izquierdo (OI), mientras que la mejor corregida (AVMC) era de 1,0 con +1.00 -0,50 x 160o y de 0,5 periférico con +0,50 -0,50 x 10o respectivamente. La presión intraocular del OD de 14 mmHg y del OI: 15 mmHg. En la biomicroscopía del segmento anterior no se observaron datos positivos a destacar en ninguno de los dos ojos. Los medios estaban transparentes y los reflejos pupilares sin alteraciones. En el segmento posterior con lente de 90D se observó en el OD un disco óptico con buena coloración, relación copa disco de 0,2 y brillo foveal; en el OI el disco óptico presentaba buena coloración, relación copa disco de 0,2 pero en el área macular existía un discreto aspecto rojizo con aumento del brillo foveal y una lesión pequeña grisácea parafoveal inferonasal. Estos datos se observaron con la oftalmoscopía binocular indirecta con lupa de 20D, además de visualizar la retina aplicada hasta periferia y a la identación sin alteración en ambos ojos (AO). No existía desprendimiento del vítreo posterior.
En el SD-OCT se realizaron diferentes protocolos de adquisición (line horizontal y vertical) e imágenes (multicolor, autofluorescencia, infrarrojo y libre de rojo) con el Spectralis SD HRA-OCT I de la firma Heidelberg. Además, se le tomaron imágenes de adquisición en el Cirrus OCTA- 5000, de la firma Carl Zeiss con diferentes protocolos (Angiography Analysis 3 x 3, Macular Thickness. Macular Cube 200 x 200, Line HD 21) de angiografía de los diferentes plexos capilares y grosor macular.
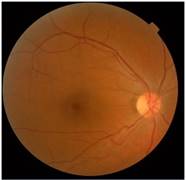
En el OD todos los exámenes fueron normales y en el OI los cambios fueron imperceptibles. En la imagen multicolor hay un aumento de la coloración rojiza de la zona foveal, que no autofluorece y se visualiza mejor en los planos más profundos con las imágenes infrarroja y libre de rojo (fig. 1 se muestra OI). En el line 90o y 180o (SD HTA- OCT I de la firma Heidelberg) se visualizan poco los cambios. Hay irregularidad de la capa plexiforme externa, disminución del grosor de la capa nuclear interna y un foco de hiperreflectividad pequeño del OI (señalado con flecha blanca). Las imágenes tomadas son de alta velocidad que muestran menos detalles que las imágenes realizadas con alta definición (fig. 1 y fig. 2B). En la figura 3A se recogen los datos del grosor macular de ambos ojos con el protocolo Cubo Macular 200 x 200 (Cirrus OCTA- 5000, de la firma Carl Zeiss) y el OI presentó menor grosor macular que el OD, coincidiendo las zonas rojas de esta prueba con los datos positivos obtenidos en el line 90o y 180o expuesto en las figuras 1, 2 y 3. En el OCTA de ambos ojos con el análisis del plexo capilar profundo se observó diferencia entre ambos. En el OD hay un aumento de la zona avascular comparado con el OI y sus márgenes son irregulares (fig. 3B).

Fig. 1 Imágenes multicolor que muestra la lesión parafoveal inferonasal con flecha blanca del OI (dos meses de evolución).
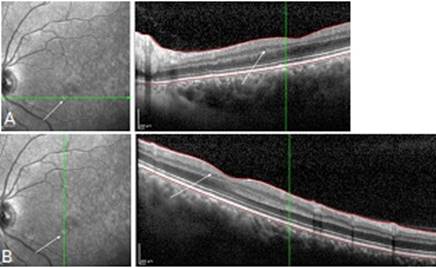
Fig. 2 A) Line horizontal en la lesión señalada con la flecha blanca (a los dos meses de evolución). B) Line vertical en lesión señalada con flecha blanca (a los dos meses de evolución).
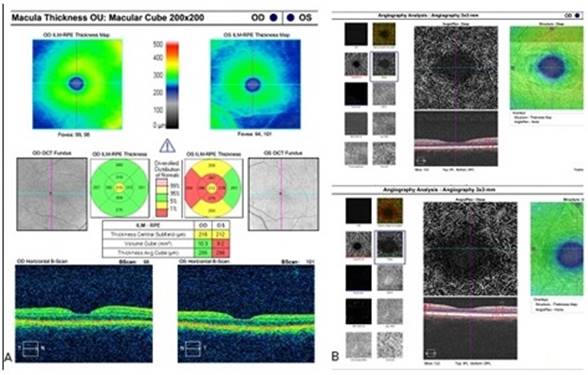
Fig. 3 A) Macular Cube 200x200 AO. Disminución del grosor macular OI (a los dos meses). B) OCTA plexo capilar profundo de AO, en el OI (imagen inferior) hay irregularidad de la zona capilar y es de mayor tamaño que el OD.
Luego del interrogatorio, el examen físico y los datos hallados en el SD-OCT y en el OCTA se concluyó que el caso como una presunta maculopatía paracentral aguda media (PAMM). Este diagnóstico se sostiene ya que la paciente presentó exámenes de laboratorio negativos, sin antecedentes patológicos, no usaba ningún medicamento por vía parenteral u oral, ni mantenía anticoncepción con píldoras orales. Solo hubo un evento interesante relacionado con el inicio de los síntomas y fue que recibió el refuerzo de la vacunación Abdala contra la COVID-19. A pesar de acudir al hospital dos meses después de la aparición de los síntomas hay algunos elementos de las imágenes que ayudan a pensar en este diagnóstico.
Caso 2
Se presenta una paciente femenina de 36 años de edad que acudió a la consulta de neurooftalmología por presentar visión borrosa y distorsionada OD de un año de evolución. Antecedentes patológicos de haber padecido dengue hemorrágico (dos semanas previas al evento). Niega enfermedad sistémica y no usa medicamentos por vía oral, ni anticonceptivos orales. Recibió vacunación contra la COVID-19 (tres dosis). En las pruebas de psicofísica visual realizada a los 21 días de iniciados los síntomas la AVSC fue de 0,05 en el OD y de 1,0 en el OI y la mejor corregida fue de 0,05 con +0,50 +1,00 x 90o y de 1,0 con +0,75 +0,50 x 90o respectivamente. La presión intraocular hallada en el OD fue de 11 mmHg y en el OI: 12 mmHg. En el examen con lámpara de hendidura no hubo datos positivos a destacar y al examen del segmento posterior con el lente de 90D se observó en el OD pequeñas hemorragias peripapilares hacia h-6 y h-9, esta última ubicada en el haz papilomacular y de mayor tamaño. En ese momento quedó sin diagnóstico en el hospital de la cabecera de la provincia donde fue atendida.
Fue reevaluada al año por el servicio de neurooftalmología de Instituto Ramón Pando Ferrer porque la paciente mantenía los síntomas con muy poca mejoría visual. En las pruebas psicofísicas la AVSC fue de 0,2 en el OD y la 1,0 en el OI; y la mejor corregida fue de 0,3 con -1,00 x 20o y la 1,0 con +0,75 +0,50 x 90o respectivamente. Al examen físico del segmento posterior de OD se observó disco de buen tamaño con bordes regulares, sin las hemorragias antes descritas y en el área foveal se observó aumento de la coloración y tamaño de esta con aspecto granular. Los vasos y el resto de la retina mantenían un aspecto normal. En el OI no había datos positivos a destacar (fig. 4).
Antes el cuadro clínico se le realizan a la paciente retinografía de fondo y el Cirrus OCTA- 5000, de la firma Carl Zeiss con los protocolos (Angiography Analysis 3x3, Macular Thickness. Macular Cube 200x200, Line HD 21).
La figura 5 muestra por medio del OCTA el plexo capilar profundo de ambos ojos, donde se observó ausencia de capilares en el plexo profundo del OD en el sector superior a la fóvea. El ojo contralateral tiene una distribución homogénea de los capilares. En el volumen macular del OD se observan detalles en la línea 9 a la 11, disminución de la capa nuclear externa y cambios en la capa plexiforme externa que presenta bordes festoneados (señalas con flecha blanca); las imágenes se ven con mejores detalles pues son de alta resolución (fig. 6A). En la figura 6B se analiza el grosor macular total y se destaca una disminución del grosor de toda esta área en el OD, llegando a la atrofia.
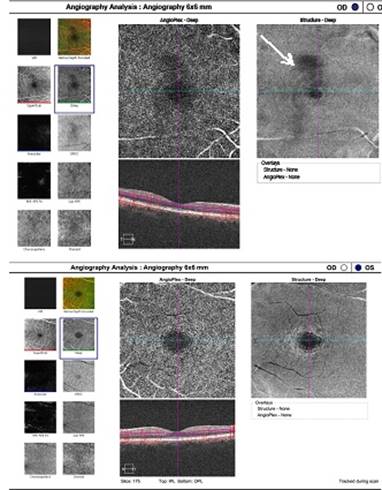
Fig. 5 OCTA de AO. En el OD hay pérdida de vasos superior a la fóvea señalada con flecha blanca (imagen superior). Un año de evolución.
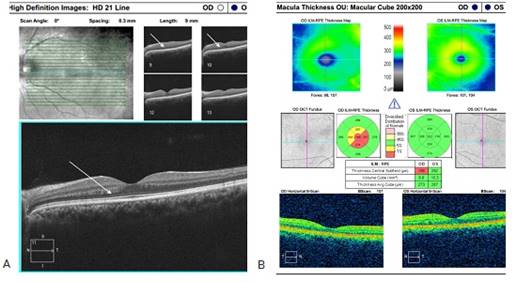
Fig. 6 A) Volumen line a 900 disminución de la capa nuclear interna. B) Grosor macular 200 x 200 OD. Disminución del grosor macular total.
Al finalizar el examen oftalmológico, basado en el interrogatorio negativo, en las pruebas de laboratorio en límites normales y antecedentes de la aparición de los síntomas dos semanas después de sufrir dengue hemorrágico se concluyó que era un caso de diagnóstico probable de neuroretinopatía macular aguda, luego de un año de evolución. Las imágenes multimodales apoyan el diagnóstico.
Discusión
La neurorretinopatía macular aguda fue descrita por primera vez por Bos Deutman y caracterizada por Fawzi.2 En ella se englobaban varias enfermedades que cursaban con un cuadro clínico similar y escotoma paracentral pero, con la utilización del SD-OCT se han podido separar algunas de ellas en diferentes variantes de la enfermedad. Serraf, en el 2013, identificó dos formas de la neurrretinopatía macular aguda por SD-OCT: el tipo 1 también conocido como PAMM, en la cual se observa una banda hiperreflectiva en la capa nuclear interna, aunque puede afectarse la capa plexiforme externa; y la tipo 2 en la que la banda hiperreflectiva se ubica en la capa nuclear externa que involucra la zona elipsoide, la zona de interdigitación y el epitelio pigmentario de la retina.14
Tanto la PAMM como la AMN tipo 2 se manifiestan con escotoma paracentral y disminución de la visión; se cree que su patogenia implica exposición a vasopresores o enfermedades microvasculares sistémicas que causan isquemia retiniana. Aunque su patogenia aún no se ha estudiado por completo existen factores causales descritos entre los que se encuentran el uso de vasoconstrictores, el uso de anticonceptivos orales, enfermedades de la retina, anemia falciforme y algunas enfermedades que aumentan la hipercoagulabilidad sanguínea o que activan las citoquinas produciendo un proceso inflamatorio.7 También, se describen estados pos-vacunación contra enfermedades como el dengue, el H1N1 y COVID-19.15
En los casos presentados, ambas mujeres niegan enfermedades sistémicas, uso de medicamentos, tratamiento con anticonceptivos orales o enfermedades de la retina. Al interrogatorio solo se recoge como positivo la vacunación contra la COVID-19 en la paciente 1 y el antecedente de dengue hemorrágico en la paciente 2. Hay algunos reportes acerca del tema. En el 2021, Vinzamuri y otros15 en una serie de casos hallaron en sus pacientes oclusiones en el plexo capilar profundo relacionados con enfermedad viral o después de la vacunación contra H1N1, influenza y contra la COVID-19, datos muy relacionados con los dos casos que presentamos.
Según la literatura hasta hoy los hombres de la tercera edad se ven mayormente afectados por AMN tipo 1 (PAMM) y las mujeres jóvenes por AMN tipo 2. Sin embargo, debido a los pocos reportes que tenemos hasta el momento, creemos que la epidemiología podría englobar rangos más precisos en el futuro.2,4,6 En nuestro estudio ambas fueron mujeres con edades contemporáneas (de 25 a 40 años).
Entre las presentaciones clínicas de las formas de AMN encontramos desde un fondo sin lesiones aparentes hasta lesiones parafoveales intrarretinianas grisáceas hipopigmentadas unilaterales (presentación más frecuente), o bilaterales (menos frecuentes) en su etapa aguda. Y en la etapa crónica el fondo de ojo se presenta de apariencia normal. 2,4 Ambas formas estuvieron presentes en las dos pacientes reportadas. El primer caso tuvo cambios en la retina en el área parafoveal, tomando en cuenta que llegó con solo dos meses de comenzados los síntomas y en el 2, el fondo de ojo tuvo cambios de hemorragias que estaban en el haz papilomacular en la primera consulta descritos en la historia clínica, pero al año (momento que se ve en la consulta del instituto) se observaba un fondo de ojo normal con un aspecto granular en la mácula. Se cree que las presentaciones de las pacientes están relacionadas con el tiempo que transcurrió desde que comenzaron los síntomas hasta el momento de la evaluación oftalmológica y su relación o no con enfermedades propias de la retina.
En una revisión realizada por Abdolrahimzadeh en el 2021 sobre la PAMM describe múltiples áreas marrones oscuras que apuntan hacia la fóvea en la fotografía del fondo de ojo; sin embargo, con frecuencia son muy tenues y difíciles de distinguir.13 Los reportes de la AMN tipo 2 son muy escasos, pero se coincide que existen pocos signos a la oftalmoscopía binocular indirecta en esta variante.2 Lo hallado en los casos reportados coincide con la literatura consultada.
El método de imagen básico para distinguir entre los dos tipos de AMN es la tomografía de coherencia óptica de dominio espectral, la cual se convierte en indispensable en aquellos casos en que los hallazgos oftalmoscópicos resulten normales como ocurre en el caso 2 presentado. Como se describió anteriormente en la PAMM se afecta la capa nuclear interna apareciendo una banda hiperreflectiva en la etapa aguda. Se postula que la fuente de isquemia es el plexo vascular intermedio o profundo.4
En el caso 1 reportado con diagnóstico de PAMM se halló en la tomografía muy pocos datos. Hay irregularidad de la capa plexiforme externa y ligera delgadez de la capa nuclear interna del OI con un foco hiperreflectivo pequeño. Este hallazgo está relacionado con el tiempo transcurrido desde la disminución de la visión hasta el momento de la consulta (2 meses), porque los hallazgos tomográficos típicos aparecen en la etapa aguda. No está registrado en la literatura cuando culmina la etapa aguda, lo que explicaría la ausencia de la banda hiperreflectiva por la isquemia que hace el diagnóstico en estos casos.2,4 Sin embargo, en la AMN tipo 2 la tomografía se ve afectada en las capas nuclear externa (que involucra la zona elipsoide, la zona de interdigitación) y/o el epitelio pigmentario de la retina; y la fuente de isquemia se plantea que se encuentra en el plexo vascular profundo.4,6)
La paciente 2 diagnosticada con AMN tipo 2 se observa en la imagen de alta resolución (protocolo HD line 21, OCTA - Cirrus) disminución de la capa nuclear externa con cambios en la capa plexiforme externa que presenta bordes festoneados. Resultado que es frecuente en los pacientes con esta variante luego de pasado un tiempo de evolución (1 año) debido a la atrofia que presentan los fotorreceptores por la isquemia del plexo vascular profundo y en ocasiones de la coriocapilar.2,6
Abdolrahimzadeh plantea que las bandas hiperreflectantes en la PAMM se ven claramente a nivel de la capa nuclear interna sin evidencia de alteraciones en la retina externa. Sin embargo, en algunas lesiones se puede observar una extensión de hiperreflectividad que involucra la capa plexiforme externa. Por el contrario, la AMN exhibe hiperreflectividad en las capas plexiforme externa y nuclear externa, y está relacionada con la interrupción de la zona elipsoide. Además, en etapas tardías desaparece la hiperreflectividad y disminuye el grosor de las capas afectadas.13 El resultado de los casos presentados es muy similar a lo descrito en este estudio en etapas tardías, pero en la paciente 2 no encontramos interrupciones en la capa elipsoide.
El OCTA mapea los plexos vasculares utilizando el contraste de movimiento intrínseco, y debido a la ubicación de la isquemia vascular de ambas variantes de AMN, es un medio que apoya el diagnóstico. El software de OCTA permite la medición cuantitativa automática de la densidad vascular en diferentes niveles de la retina, incluyendo el plexo capilar superficial, el plexo capilar intermedio y el plexo capilar profundo, con alta repetibilidad y reproducibilidad. La tecnología de OCTA convencional permite la adquisición de imágenes 6 x 6 mm y 3 x 3mm y consta de varias imágenes centradas en la mácula (superonasal, inferonasal, superotemporal e inferotemporal).6
En los diferentes estudios consultados las lesiones de PAMM tienen disminución en la señal de flujo en el plexo medio y profundo, con una disminución adicional en la señal de flujo en el plexo superficial. En el seguimiento de estos pacientes se halló adelgazamiento significativo de la capa nuclear interna, por la isquemia persistente del plexo medio, debido a que su reperfusión es relativamente baja. En contraste, las lesiones de AMN tipo 2 están asociadas con una reducción en las señales de flujo en el plexo profundo, confirmando la presencia de una isquemia focal aislada en este plexo y en los axones de los fotorreceptores.5
En ambos casos presentados se recogen cambios en el plexo capilar profundo (fig. 3B y 5) sin patrón repetitivo. En el primer caso (PAMM) hay aumento del FAZ (Foveal Avascular Zone) del OI con irregularidad en la red capilar al compararlo con el OD; y en el segundo caso (AMN tipo 2) se presenta ausencia de capilares en el sector superior a la fóvea del OD comparado con la distribución homogénea del plexo capilar profundo del OI.
Se realizaron los dos protocolos de adquisición de angiografía 3 x3 mm (caso 1) y 6 x 6mm (caso 2). No se cuenta en el instituto con el software de perfusión y densidad de vasos del plexo profundo, ni del intermedio, solo del plexo capilar superficial; pero de forma cualitativa se pueden visualizar los defectos antes explicados. Por esta razón, se realizó el protocolo de grosor macular (Macular Cube 200 x 200); para justificar la permanencia de la mala visión de ambas pacientes, provocada por la disminución del grosor de las capas de la retina en el sector donde ocurrió la isquemia. Esto demuestra que la isquemia del plexo capilar profundo daña la capa nuclear interna, externa y plexiforme externa; terminando en atrofia macular o en mejoría visual si existiera una reperfusión poderosa, que no ocurrió en los casos presentados, pero hay evidencia en la literatura de mejoría visual luego del tiempo.5
En un estudio retrospectivo realizado por Chu y otros,5 en el 2018, se analizó perfusión y densidad de vasos en pacientes con ambas variantes de AMN, los cuales mostraron evidencia de una recuperación variable de la señal de flujo capilar en los diferentes niveles capilares. Los diversos plexos experimentaron una amplia gama de efectos y en el caso de los pacientes con PAMM se pudieron rastrear los capilares reperfundidos hasta su origen arteriolar. Era evidente que el adelgazamiento de la nuclear interna se reducía con una reperfusión más fuerte del plexo capilar medio. De manera similar, observaron recuperación parcial de la señal de flujo en el plexo capilar profundo durante la recuperación de AMN; a medida que la lesión pasa de la hiperreflectividad al adelgazamiento de la capa nuclear externa.5 En el estudio de los dos casos presentados no se pudo seguir estos cambios de los plexos capilares por no tener el software disponible. La visión alcanzada en todas las consultas no mostró mejoría.
Como tratamiento en la actualidad se conoce poco. No existe uno que esté demostrado para ninguna de las dos variantes. Puede ser necesario realizar una evaluación sistémica, para descartar condiciones como diabetes, hipertensión, anemia de células falciformes y otras enfermedades, en especial en individuos sanos y con examen de retina negativo. La importancia del funcionamiento de las arterias carótidas, corazón, trastornos hipercoagulables, inflamatorios e infecciosos también deben ser descartados. La terapia con oxígeno inhalado e hiperbárico utilizados en casos de oclusión de la arteria retiniana (BRAO) y oclusión de la arteria central de la retina (CRAO) no está avalada a pesar que hay reportes escasos de resultados alentadores.13 En los casos que se presentan no se llevó a cabo ningún tratamiento y se carecía de factores de riesgos asociados. Solo se recogió en los interrogatorios los antecedentes de vacunación contra en COVID-19 en ambos casos y de dengue hemorrágico en el segundo caso.
Se puede concluir que la PAMM y la AMN tipo 2 se definen como variantes de una misma enfermedad que afectan la capa nuclear interna, capa plexiforme externa y la capa nuclear externa. Ambas presentan cambios en el SD-OCT en estas capas de la retina, tanto en la etapa aguda como la tardía y por medio del OCTA se evidencia la isquemia parafoveal focal en los plexos profundos e intermedios como probable etiología. Se advierte la importancia de las imágenes multimodales para el diagnóstico y se recomienda investigar los factores de riesgo que pueden afectar la retina en estos pacientes; pues en la actualidad no existe cura para ellas.