My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Salud Pública
Print version ISSN 0864-3466
Rev Cubana Salud Pública vol.37 supl.5 Ciudad de La Habana 2011
ARTÍCULO
Terapia antioxidante, estrés oxidativo y productos antioxidantes: retos y oportunidades
Antioxidant therapy, oxidative stress and antioxidant products: challenges and opportunities
Alberto J. Núñez Sellés
Académico de Mérito. Academia de Ciencias de Cuba. La Habana, Cuba.
INTRODUCCIÓN
La relación que existe entre la concentración de radicales libres y el estado de salud de los seres humanos es un hecho aceptado en la actualidad por la comunidad científico-médica. Vocablos tales como estrés oxidativo, actividad prooxidante y producto antioxidante, son cada vez más comunes e indican el interés cada vez más creciente sobre este tema. Una avalancha informativa ha conducido a la aparición de miles de productos, de origen natural o sintético, que se expenden por lo general como "productos de salud"con el calificativo de "antioxidantes", con lo cual se quiere significar la capacidad de disminuir la concentración de radicales libres en el organismo humano y, por tanto, mejorar el estado de salud de quien lo consume. Para ilustrar lo anterior, el ejemplo que mayor divulgación ha tenido es el de la "paradoja francesa",1que consiste en la aparente compatibilidad de una dieta elevada en grasas con una reducida incidencia de la ateroesclerosis coronaria, lo cual se atribuye al consumo regular por los franceses de vino tinto o jugo de uvas, productos con un elevado contenido de flavonoides.2 A estos flavonoides y otras sustancias fenólicas que contiene el vino tinto se le atribuyen propiedades antioxidantes,3 que reducen la oxidación de las lipoproteínas de baja densidad (LDL) y con ello la disminución del riesgo de enfermedades aterogénicas.4,5 Otros ejemplos son el proceso de envejecimiento del organismo humano6 y las correlaciones halladas entre los procesos de iniciación, promoción y progresión del cáncer,7-10 con el incremento de la generación de radicales libres y sus metabolitos, lo que ha inducido el consumo de productos antioxidantes como agentes quimiopreventivos.
A pesar de este aumento, tanto de la información científico-técnica como de divulgación y la publicidad comercial sobre los productos antioxidantes para estimular su consumo, sobre todo en los países más desarrollados, el tema del estrés oxidativo resulta aún poco conocido por una gran parte de la comunidad médica. Razones para explicar ese estado de poco conocimiento habrían decenas de ellas y no emplearemos espacio para tratar de explicarlo. El presente trabajo está destinado a tratar de llenar ese vacío de información. Muy especialmente este material está destinado al personal médico que trabaja en la atención primaria de salud, aunque seguro resultará de utilidad para otras especialidades y profesionales que desarrollan su actividad asistencial, docente y científica en el Sistema Nacional de Salud.
CONCEPTOS Y DEFINICIONES DE LA TERAPIA ANTIOXIDANTE
Radicales libres. Especies Reactivas de Oxígeno (ERO)
Un radical libre es una especie química definida, que tiene en su estructura uno o más electrones no pareados, caracterizada por su elevada reactividad y capacidad de formar otros radicales libres por reacciones químicas en cadena.11 A diferencia de las especies químicas que poseen una carga eléctrica (iones), que son generalmente estables en los medios más comunes, muchos radicales libres son inestables, por lo que tienden a reaccionar muy rápidamente con otros componentes químicos.
Las Especies Reactivas de Oxígeno (ERO) incluyen a los radicales libres y a moléculas derivadas del oxígeno de interés biológico con una elevada reactividad, que son capaces de producir radicales libres en el organismo humano.12-15 Las ERO más comunes y de mayor importancia biológica son las siguientes: oxígeno singlete (1O2), radical hidroxilo (HO.), radical alcoxilo (RO.), radical-anión superóxido (O2.-), óxido nítrico (NO), peróxido de hidrógeno (H2O2), ácido hipocloroso (HOCl) y peroxinitrito (ONOO-). Existe otro grupo de radicales libres donde el electrón no pareado tiene como centro a átomos de carbono (C), nitrógeno (N) o zufre (S). En lo adelante y con el objetivo de simplificar, todas estas especies químicas se referirán como ERO.
¿Cómo se forman las ERO?
Existen diferentes procesos endógenos generadores de ERO, tales como la respiración mitocondrial (O2·-), la activación de polimorfonucleares (HOCl, 1O2, HO. y H2O2), el metabolismo del ácido araquidónico (O2·-), las acciones enzimáticas (O2·-, NO y H2O2) y la catálisis por liberación de hierro y cobre (HO.), entre otros.16-18 Es decir, el organismo humano produce ERO que son necesarias para el funcionamiento y balance armónico de diversos sistemas, sin las cuales se pueden producir desórdenes fisiológicos o alteraciones del sistema inmune y dar lugar a diversas enfermedades o permitir su evolución y desarrollo hacia diferentes estados patológicos.19-22
Otras ERO se forman en exceso en el organismo humano por la acción de factores exógenos, que constituyen un estrés para el organismo humano. Entre esos factores se encuentran la contaminación ambiental (atmosférica, acuática y de los suelos), las radiaciones de todo tipo (ultravioleta, gamma, hertziana y otras), los hábitos tóxicos (tabaco, alcohol y estupefacientes), la alimentación inadecuada, la exposición a sustancias tóxicas (fertilizantes y pesticidas), el metabolismo de algunos fármacos y un elevado estrés físico o psíquico. Algunos de estos factores pueden llegar a controlarse, por ejemplo, la alimentación, los hábitos tóxicos y los ejercicios físicos, pero otros quedan fuera de control de la persona, por ejemplo, la contaminación ambiental y la exposición continua a radiaciones. Es decir, el organismo se encuentra sometido, de una forma continua, a la producción excesiva de ERO por la acción de factores externos que no son posibles de controlar por la persona.23-25
Otra fuente generadora de ERO es la alteración estructural de macromoléculas esenciales de la célula (ADN, proteínas y lípidos), sobre las cuales se originan reacciones químicas irreversibles para su funcionamiento.26 Estas reacciones generan derivados (ej. malonildialdehído e hidroperóxidos orgánicos) que propagan el daño oxidativo en el organismo humano. Aunque aún resulta un tema controvertido, de forma general se acepta que esta tercera vía de producción de ERO es una consecuencia de alteraciones genéticas (hereditarias o no) o de desórdenes fisiológicos del organismo como resultado de alguna enfermedad. Sin embargo, otros autores, a partir de algunas evidencias experimentales, consideran lo contrario.27 Es decir, que la causa de dichas alteraciones genéticas o desórdenes fisiológicos es la sobreproducción de ERO, bien sea de forma endógena o exógena, lo cual favorece la fragmentación del ADN y la ruptura de la pared celular, con lo cual el tema del estrés oxidativo debe tener una importancia mayor en la terapia de enfermedades de la que se le ha atribuido hasta el momento
¿Cuáles son los mecanismos antioxidantes del organismo humano para reducir el exceso de ERO?
Los mecanismos antioxidantes con que cuenta el organismo humano para reducir el exceso de ERO, causado por factores endógenos o exógenos, pueden clasificarse de la siguiente forma.28
Mecanismo preventivo: en este mecanismo toman parte diversas proteínas, que poseen núcleos coordinados o con capacidad de enlace de metales, tales como la albúmina, metalotioneína y ceruloplasmina, que poseen un núcleo central de cobre (Cu); y la ferritina, transferrina y mioglobina, que poseen un núcleo central de hierro (Fe). De esta forma se previene la formación de ERO muy dañinas, como por ejemplo, los radicales hidroxilo, a partir de otras moléculas. La deficiencia de alguna de estas proteínas en el organismo o de los metales Cu y Fe, alrededor de los cuales se forman dichos complejos de coordinación, o su alteración estructural por causas genéticas o fisiológicas, deja al organismo sin protección contra la sobreproducción endógena de ERO.
Mecanismo reparador: constituido por enzimas que reparan o eliminan las biomoléculas que han sido dañadas por el ataque de ERO, tales como la glutatión peroxidasa (GPx), glutatión reductasa (GR) y metionina-sulfóxidoreductasa (MSR). Dichas enzimas actúan como intermediarias en dicho proceso reparador del daño oxidativo, por el ataque de ERO producidas en exceso. Todo factor del medio que inhiba o modifique su actividad se convierte en una condición que favorece la aparición o el reforzamiento del estrés oxidativo. Ello requiere, por tanto, el conocimiento de la química de las enzimas reparadoras del daño oxidativo. Por solo mencionar un ejemplo: se ha demostrado que el selenio (Se) actúa como un cofactor de la GR, si el organismo tiene deficiencia de Se, las funciones de la GR se verán inhibidas y se favorece el daño oxidativo.29 Por tanto, la suplementación con Se en esos casos debe constituir una alternativa terapéutica para disminuir el daño oxidativo y la progresión de la enfermedad.
Mecanismo secuestrador: consiste en la eliminación del exceso de ERO formadas en el organismo, lo cual puede lograrse por la acción de enzimas tales como la superóxidodismutasa (SOD), GPx, catalasa y otras metaloenzimas o la presencia de entidades químicas con capacidad secuestradora de radicales libres, tales como los ácidos grasos poliinsaturados, úrico y ascórbico (vitamina C), los tocoferoles (vitamina E), la bilirrubina, los carotenoides y flavonoides.30
En la actualidad existe poco más de una decena de productos antioxidantes en el mercado con evidencias experimentales suficientes de su actividad preventiva, reparadora o secuestradora de ERO. Sin embargo, se encuentran disponibles también un gran número de formulaciones bajo la etiqueta de "antioxidantes"cuya efectividad es aún dudosa y que, por lo general, constituyen extractos de productos naturales que no han sido investigados con profundidad, ni se han determinado sus posibles efectos tóxicos, agudos o crónicos. Un resumen de los productos antioxidantes de mayor circulación en el mercado internacional y cuya actividad ha sido comprobada de forma experimental, incluso en ensayos clínicos controlados, se muestran en la tabla.
Los mecanismos de defensa antioxidantes descritos con anterioridad pueden ser insuficientes cuando tiene lugar un desbalance muy pronunciado a favor de la generación excesiva de ERO u ocurre un debilitamiento de los sistemas antioxidantes endógenos. Por lo tanto, resulta imprescindible tener en cuenta siempre una, alguna o la totalidad de las siguientes alternativas:
- Eliminar hábitos tóxicos tales como el consumo de alcohol y tabaco.
- Incrementar el consumo de hortalizas, vegetales y frutas.
- Disminuir el consumo de grasas y alimentos fritos.
- Suplementar la dieta con productos antioxidantes de probada eficacia e inocuidad.

¿Qué es el estrés oxidativo y cuál es su importancia?
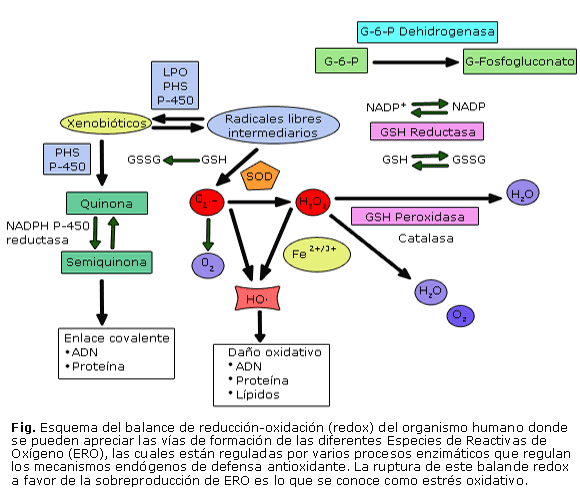
El balance oxidativo del organismo humano, es decir, la producción endógena de ERO sin sobrepasar ciertos límites, resulta esencial para la regulación metabólica, la producción de energía metabólica, la activación o inactivación de biomoléculas, la transducción de señales, el recambio celular y el control del tono vascular, entre otros. Si este balance entre los sistemas oxidantes (generadores de ERO) y los antioxidantes (preventivo, secuestrador y reparador) se desequilibra a favor de los primeros, por la producción excesiva de ERO, el debilitamiento de los sistemas antioxidantes o por ambas causas, se estará en presencia de lo que se conoce como estrés oxidativo.51 Un esquema de este balance de oxidación-reducción en el organismo, más conocido como "balance redox"se muestra en la figura.
El exceso de ERO promueve el ataque de estas sobre compuestos químicos que se hallan en las células (lípidos, proteínas y ADN), dando lugar al inicio de una serie de reacciones químicas que pueden conducir a la aparición de graves desórdenes fisiológicos y la agudización de la enfermedad o incluso alterar el desempeño físico o psíquico de una persona supuestamente sana. No obstante, ciertos autores consideran que esto ocurre exactamente al revés; es decir, que el estrés oxidativo conduce a la aparición de la enfermedad y es la causa de las alteraciones que se observan después en sistemas biológicos.52
En la actualidad se han reportado casi 100 enfermedades en las que existen certezas experimentales sobre la incidencia del desbalance del estado oxidativo en su surgimiento y desarrollo,53-59 entre ellas: cardiovasculares, neurológicas, endocrinas, respiratorias, de origen inmune y autoinmune, isquemia, trastornos gástricos, carcinogénesis y progresión de tumores. No obstante, la mayoría de los autores de publicaciones científicas relacionadas con este tema, tanto de los que están a favor como de los que están en contra de la terapia antioxidante, coinciden en que son necesarios un mayor número de ensayos clínicos controlados, a doble ciego, por períodos de tiempo prolongados y con número de sujetos suficientes, que hagan válida la teoría de la terapia antioxidante.60-63
Las evidencias experimentales, obtenidas tanto in vitro como in vivo, a nivel de biomodelos de experimentación, en líneas celulares o en animales de experimentación, permiten asegurar que la célula atacada por ERO puede:64
- alterar su código genético por modificación de la estructura espacial de la molécula de ADN o la destrucción de pares de bases,
- reprimir la expresión de genes mediante la inhibición, alteración o destrucción de factores transcripcionales,
- perder su integridad por ruptura de la pared celular causada por la oxidación lipídica,
- modificar sus funciones por la acumulación de lipoproteínas oxidadas de baja densidad (LDL), y
- activar o inactivar enzimas esenciales para el funcionamiento de la célula.
Estos procesos de degradación celular pueden conducir a la pérdida parcial o total de funciones de los sistemas fisiológicos del organismo humano. Una de las obras más abarcadoras sobre este tema,65 muestra resultados que corroboran la asociación entre el estrés oxidativo y las enfermedades relacionadas con el envejecimiento. Quizás las enfermedades más estudiadas en relación con su progresión y el incremento de marcadores del estrés oxidativo son las neurodegenerativas.66 Aunque en la actualidad no están claros todos los factores que conducen a la muerte neuronal en dichas enfermedades, se ha observado que en todas ellas hay deposición de proteínas específicas modificadas por la elevada concentración de ERO. Más evidente aún resulta la deposición de ciertos metales de transición, protagonistas del daño oxidativo, en zonas específicas del cerebro donde ocurren los mayores daños a causa de la enfermedad. Otra evidencia reciente de ello es la comprobación de la disfunción del metabolismo del glutatión por el estrés oxidativo, lo cual influye en la patogénesis de enfermedades tales como Parkinson, Alzheimer, Ataxia de Friedrich y la esclerosis lateral amiotrófica.67
De forma específica, en la enfermedad de Alzheimer, se ha registrado que un biomarcador del estrés oxidativo
(8,12-isoPGF2a) puede ser un marcador predictivo de la enfermedad en ancianos con trastornos cognitivos ligeros,68 y se ha demostrado la existencia de un gen que reduce la neurodegeneración inducida por el estrés oxidativo en un modelo de ratón transgénico que impide la replicación celular de neuronas.69
Algunos antioxidantes han demostrado ser efectivos en prevenir la apoptosis en células neuronales,70 así como la degradación de proteínas relacionadas con enfermedades neurodegenerativas.71 El estrés oxidativo moderado puede reprimir, de forma específica, varios tipos de genes mediante la influencia de las ERO sobre factores de transcripción en el sistema nervioso central.72
¿Cuáles son los marcadores químicos del estrés oxidativo?
Una de las deficiencias que con mayor frecuencia se le han señalado a los estudios clínicos con productos antioxidantes es la inadecuada selección de los marcadores del estrés oxidativo en fluídos biológicos (plasma, sangre, orina, líquido cefaloraquídeo y otros). Dichos estudios, realizados entre las décadas del 70 y 80, consideran la medición de la concentración del propio producto antioxidante en el fluido biológico, lo cual no ofrece información alguna sobre la intensidad del estrés oxidativo. A partir de finales de la década del 80 se empieza a introducir en la medición del estrés oxidativo un grupo de marcadores químicos que, de manera directa o indirecta, brindan información sobre la concentración de diferentes tipos de ERO en el organismo humano. Incluso se ha llegado a sugerir la existencia de marcadores específicos para determinadas enfermedades. Las técnicas de determinación de los marcadores químicos del estrés oxidativo incluyen técnicas gasométricas, espectrofotométricas, inmunoenzimáticas (ELISA) y cromatográficas, algunas de las cuales son las siguientes:
- Estado de los antioxidantes totales (TAS: Total Antioxidant Status).73
- Sustancias reactivas al ácido tiobarbitúrico (TBARS: ThiobarbituricAcid Reactive Substances).74,75
- Radicales hidroxilo (OH).76
- Peroxidación de los lípidos.77
- Malonildialdehído y 4-hidroxialdehídos (MDA + HA).78
- Potencial de peroxidación (PP).79
- Oxido nítrico (NO).80
- Fragmentación del ácido desoxirribonucleico (ADN).81
- Contenido de grupos sulfhidrilo y carbonilo.82
- Superóxido dismutasa (SOD).83
- Glutatión reducido (GSH).84
- Glutatión peroxidasa (GPx).85
Un diseño adecuado de un protocolo de ensayo clínico con un producto antioxidante debe considerar una selección de dichos marcadores químicos del estrés oxidativo, según el esquema terapéutico sea profiláctico o terapéutico, así como las características individuales de los pacientes incluidos en el estudio.
Los ensayos clínicos de antioxidantes han tratado de medir la eficacia en función de los puntos finales de la observación clínica. Sin embargo, muy pocos ensayos han monitoreado los marcadores de la oxidación…Los ensayos clínicos futuros con antioxidantes deben monitorear los marcadores del estrés oxidativo en pacientes con niveles altos documentados del estrés oxidativo. Estos marcadores deben ser monitoreados para mostrar el efecto directo del antioxidante objeto del estudio clínico sobre el estado redox del paciente.8
¿Qué es un producto antioxidante?
El producto antioxidante es aquel que previene la formación de ERO en cantidades perjudiciales para el organismo humano, estimula los mecanismos de reparación endógenos al daño causado por el ataque de ERO o suministra entidades químicas que aumentan la capacidad endógena de secuestro de radicales libres formados en exceso en el organismo. La ingestión de frutas y vegetales frescos en la dieta diaria es una de las mejores formas de prevenir la generación excesiva de ERO,87 por lo que se debe considerar la existencia de una dieta balanceada como el primer paso en el camino de lograr un satisfactorio estado de salud. Sin embargo, la continua e incrementada presencia de factores de riesgos ambientales, incluidos los períodos prolongados de estrés psíquico y físico, hacen recomendable el consumo de productos antioxidantes que, al menos, cumplan alguna de las funciones descritas con anterioridad.
El mejor producto antioxidante será aquel capaz de prevenir la generación de ERO en exceso, estimular los mecanismos de reparación de tejidos dañados por el ataque de ERO y aumentar la capacidad antioxidante del organismo humano por el suministro de componentes capaces de eliminar el exceso de ERO en el organismo.
¿En qué consiste el efecto prooxidante de los antioxidantes?
Toda molécula química, incluso el oxígeno, que puede aceptar electrones es un oxidante o agente oxidante. Por el contrario, una sustancia que dona electrones es un reductor o agente reductor. En general, una reacción química en la cual una sustancia gana electrones es definida como una reducción, mientras que la oxidación es un proceso en el cual ocurre una pérdida de electrones. Cuando un reductor dona sus electrones, esto causa que otra sustancia se reduzca y cuando un oxidante acepta electrones, esto causa que otra sustancia se oxide. Usualmente se asocia al agente reductor como aquel que dona o aporta uno o más átomos de hidrógeno y el agente oxidante el que recibe el hidrógeno. Un proceso de reducción siempre va acompañado por un proceso de oxidación. Tal es el balance redox (reducción-oxidación) del organismo humano que, cuando se altera conduce al estrés oxidativo, y constituye la base de los procesos químicos, bioquímicos, biosintéticos que regulan el crecimiento celular. Estos procesos también son importantes para entender los efectos de la oxidación biológica y la relación ERO-antioxidante. Mientras el reductor y el oxidante son términos químicos, en un ambiente biológico estos deben ser denominados como antioxidante y prooxidante, respectivamente.88 En la literatura científica existen muchos ejemplos de la importancia biológica de los agentes prooxidantes.89
Si se acepta la existencia de ambas actividades en el balance redox del organismo humano (antioxidante y prooxidante), no resulta descabellado aceptar la hipótesis de que un reto prooxidante, de leve a moderado, al organismo humano puede inducir el reforzamiento de los mecanismos antioxidantes endógenos y favorecer la acción de los productos antioxidantes, tal como se ha demostrado en los retos quirúrgicos por isquemia-reperfusión o, más recientemente, en el mecanismo de acción del ozono en la ozonoterapia.90
¿Qué es la terapia antioxidante?
El tema de la terapia antioxidante es muy controvertido dentro de la comunidad científica y médica. La mayoría relaciona este término con la administración de formulaciones que contengan productos antioxidantes, sea esta de forma única o complementaria, en la terapia de una enfermedad específica. De hecho se acepta que, por lo tanto, existe alguna relación entre la progresión o etiología de la enfermedad y la presencia del estrés oxidativo en alguna de sus formas. Sin embargo, en la mayoría de los protocolos de ensayos clínicos que se realizan bajo el término "terapia antioxidante" no se tiene en cuenta o se desconocen las características de la variabilidad del estrés oxidativo interpaciente. No obstante todas las evidencias de la literatura científica sobre la relación entre estrés oxidativo y la progresión de enfermedades, sobre todo crónicas, la administración de productos antioxidantes a los pacientes se considera, de forma muy frecuente, como suplementaria o de segunda importancia en la metodología terapéutica. Uno de los factores que puede contribuir a ello es el entorno regulador actual, donde los antioxidantes no se consideran medicamentos, sino suplementos nutricionales o productos naturales para la salud, ya que el estrés oxidativo no se considera una categoría terapéutica.
Según lo descrito con anterioridad, el estrés oxidativo es una alteración del balance reducción-oxidación (redox) a favor de la sobreproducción de ERO; pero ¿de cuál o cuáles ERO se trata?, ¿cuál o cuáles de los mecanismos antioxidantes endógenos no está cumpliendo sus funciones? Finalmente, ¿cuál sería el mejor antioxidante, según las respuestas a las preguntas anteriores? Es decir, no basta con diagnosticar la existencia de estrés oxidativo, según los marcadores químicos antes descritos, sino de hacer "un traje a la medida del paciente", lo cual añade una dificultad insalvable a la hora de diseñar el protocolo de ensayo clínico, según las normativas de las agencias reguladoras. Todos los artículos publicados sobre ensayos clínicos bajo el término "terapia antioxidante" han sido hechos bajo esas normativas, lo cual les imparte un sesgo que, desde su concepción, limita el alcance de sus resultados, lo cual se discute a continuación
Las primeras evidencias de la relación entre estrés oxidativo y los factores de riesgo se notificaron para el sistema cardiovascular. Sin embargo, más de 25 años después de dicho estudio epidemiológico (la paradoja francesa) aún se afirma:
Las evidencias de los estudios observacionales sugieren que la administración de antioxidantes puede disminuir el riesgo de enfermedades cardiovasculares. Pero las limitaciones de esos estudios implican que aún se deben ver esos resultados como observaciones preliminares de efectos que necesitan estudios ulteriores en ensayos controlados aleatorizados.91
Una revisión reciente de la terapia antioxidante en el sistema nervioso central (SNC),92 puede ilustrar, a modo de ejemplo, lo expresado con anterioridad:
1. El daño cerebral en el SNC se produce, en lo fundamental, por el ataque del radical-anión superóxido y el NO.
2. Los resultados obtenidos, tanto en la prevención del infarto cerebral como en la recuperación del daño posinfarto, mediante la suplementación con vitaminas C o E, b-caroteno, N-acetilcisteína, ubiquinona (coenzima Q10) y acido lipoico, son contradictorios y no permiten arribar a conclusiones. Un dato interesante es que se exhorta aplicar estos tratamientos donde el estrés oxidativo sea leve. Se recomienda nuevos ensayos clínicos a partir de las experiencias de dichos resultados.
3. El único producto antioxidante que mostró efectos significativos notables, tanto como neuroprotector (profiláctico) como en la mejoría del paciente posinfarto (administración dentro de las 24 h posteriores al infarto durante un mes) fue el Ebselen (sal orgánica de selenio).
En general, los antioxidantes deben administrarse de acuerdo con e€l origen fisiológico del estrés oxidativo, el lugar de generación de ERO, así como el tipo de ERO involucrado en el daño oxidativo y la severidad de dicho daño. Como recomendación: utilizar en la terapia del daño al SNC un cocktail de antioxidantes, con una probabilidad alta de efectos sinérgicos y el diseño de nuevos antioxidantes sintéticos, a partir del estudio de las bases moleculares en la relación entre estrés oxidativo y las bases fisiológicas del daño cerebral.
Quizás la mayor controversia actual de la terapia antioxidante se encuentra en el tratamiento del cáncer. Mientras unos reclaman que la terapia antioxidante se debe evitar durante la quimio y la radioterapia, lo cual puede reducir la eficacia de la terapia antitumoral,93 otros dicen todo lo contrario y recomiendan el uso de antioxidantes,94 tanto en la quimioprevención del cáncer (de lo cual el selenio es un magnífico ejemplo), como en la reducción de los efectos secundarios de la quimio y radioterapia y en la potenciación del efecto de la terapia del cáncer con los métodos convencionales. Una información reciente de un equipo de investigadores de la Universidad "Thomas Jefferson", EE. UU., publicado en julio de 2006, concluye, de forma acertada, que:
Los antioxidantes se usan de forma rutinaria para atenuar la toxicidad de los agentes quimioterapéuticos y la radioterapia, mientras preservan la eficacia de dicha terapia". Esto fundamenta el argumento que la suplementación con antioxidantes naturales puede ser combinada, de forma segura, con la quimio y radioterapias. No obstante, se reconoce que se deben diseñar ensayos clínicos controlados y aleatorizados para determinar la dosis óptima y el tiempo de administración de antioxidantes durante estos tratamientos.
CONSIDERACIONES FINALES
La realidad es que un número cada vez más creciente de ensayos clínicos demuestran la importancia de la terapia antioxidante en enfermedades tales como la preeclampsia en el embarazo71,infertilidad,95artritis, 96prostatitis,97 diabetes98 y queratitis,99 por solo citar algunos ejemplos recientes. Sin embargo, los ensayos clínicos controlados, aleatorizados, a doble-ciego con productos naturales antioxidantes que surgen de la medicina tradicional o práctica etnomédica son aún insuficientes. Probablemente, la mayor limitación se encuentra en la falta de recursos financieros para una adecuada investigación preclínica y clínica, donde el mayor flujo de estos recursos disponibles se destina a la publicidad y a la promoción, muchas veces con absoluta falta de ética por parte de las casas comerciales más interesadas en las ganancias que el verdadero potencial terapéutico de los antioxidantes. No menos importante, es la práctica generalizada de solo considerar como válidos aquellos metabolitos aislados de fuentes naturales, con una identidad y pureza similares a los productos de síntesis química, donde los conceptos de las agencias reguladoras occidentales predominan sobre los de la milenaria cultura oriental en la aplicación de la medicina tradicional, con el uso de extractos crudos o mezclas de probada efectividad e inocuidad.100
Por último, un reciente trabajo publicado en una revista médica de EE. UU.,101 resultados de un metaanálisis de 68 ensayos clínicos con productos antioxidantes en más de 230 mil pacientes en los últimos 20 años, arriba a la conclusión de que la terapia con productos antioxidantes incrementa la mortalidad en alrededor del 5 %, excepto para los productos que contienen selenio donde, por el contrario, la mortalidad se reduce en una cifra similar.
En lo que todos los autores coinciden, tanto los que están en contra como a favor de la terapia antioxidante, es que se requiere mayor experimentación clínica, diseñada de una forma correcta, de acuerdo con el nivel de conocimiento actual del estrés oxidativo.
REFERENCIAS BIBLIOGRÁFICAS
1. Renaud S, De Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992;339:1523-6.
2. Demrow HS, Slane PR, Folts JD. Administration of wine and grape juice inhibits in vivo platelet activity and thrombosis in stenosed canine coronary arteries. Circulation. 1995;91:1182-8.
3. Lotito SB, Frei B. Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: cause, consequence, or epiphenomenon? Free RadicBiol Med. 2006;41:1727-46.
4. Frankel EN, Kanner J, German JB, Parks E, Kinsella JE. Inhibition of oxidation of human low density lipoproteins by phenolic substances in red wine. Lancet. 1993;341:454-7.
5. Fuhrman B, Lavy A, Aviram M. Consumption of red wine and meals reduces the susceptibility of human plasma and low-density lipoprotein to lipid peroxidation. Am J Clin Nutr. 1995;61:549-54.
6. Cutler RG. Antioxidants and aging. Am J ClinNutr. 1991;53:373S-9S.
7. Pitot HC, Dragan YP. Facts and theories concerning the mechanisms of carcinogenesis. FASEB J. 1991;5:2280-6.
8. Kehrer JP. Free radicals as mediators of tissue injury and disease.Crit Rev Toxicol. 1993;23:21-48.
9. Halliwell B. Oxidative stress, nutrition and health. Experimental strategies for optimization of nutritional antioxidant intake in humans. Free Radic Res. 1996;25:57-94.
10. Hertog MG, Kromhout D, Aravanis C, Blackburn H, Buzina R, Fidanza F, Giampaoli S, Jansen A, Menotti A, Nedeljkovic S. Flavonoid intake and long-term risk of coronary heart disease and cancer in the seven countries study. Arch Intern Med. 1995;155:381-6.
11. Elejalde Guerra JI. Oxidative stress, diseases and antioxidant treatment. An Med Interna (Madrid). 2001;18:50-9.
12. Scandalios JG. The molecular biology of free radical scavenging systems., Clairview, NY: Cold SpringHarbor Press;1992.
13. Mohanakumar KP, Thomas B. Nitric oxide: an antioxidant and neuroprotector. Ann NY Acad Sci. 2002;962:389-401.
14. Spatz L, Bloom AD,editors. Biological consequences of oxidative stress. Implications for cardiovascular disease and carcinogenesis. Massachusets: Conte Inst Environm Health; 1992.
15. Young IS, Woodside JV. Antioxidants in health and disease.ClinPathol. 2001;54:174-86.
16. Barry EM, Kohen R. Is the biological antioxidant system integrated and regulated? Exptl Physiol. 1997;82:291-5.
17. Ahmad S, editor. Oxidative stress and antioxidant defenses in Biology. Boston: Kluwer Acad Publ;1995.
18. Forman HJ, Cadenas E, editors Oxidative stress and signal transduction. Boston: Kluwer Acad Publ; 1997.
19. Montagnier L, Oliviewr R, Pasquier C, editors. Oxidative stress in cancer, AIDS and neuro degenerative diseases. New York: M. Dekker; 1998.
20. Kumpulainen JT, Salonen JT, editors. Natural antioxidants and anticarcinogenesis in Nutrition, Health and Diseases. New York: CHIPS; 1999.
21. Oldham KM, Braun PE. Oxidative stress in critical care: Its antioxidant supplementation beneficial? J Am Diet Assoc. 1998;98:1001-8.
22. Cross JV, Templeton DJ. Regulation of signal transduction through protein cysteineoxidation. Antiox Redox Signal. 2006;8:1819-27.
23. Beck MA. Nutriitional-induced oxidative stress. Effect on viral disease. Am J Clin Nutr. 2000;72:1082-6.
24. Lorgeril M, Richard MJ. Increased production of reactive oxygen species in pharmacologically-immunosuppresed patients. Chem Biol Interact. 1994;91:159-64.
25. Clarkson PM. Antioxidantsd and physical performance. Crit Rev Food Sci Nutr. 1995;35:131-41.
26. Murray MT. Encyclopedia of Nutritional Supplements. California: Prima Pub; 1996.
27. Whitton PS. Inflammation as a causative factor in the aetiology of Parkinson´s disease. Br J Pharmacol. 2007;150:963-76.
28. Cadenas E, Packer L, editors. Handbook of Antioxidants. New York: M. Dekker Inc;1996.
29. Combs CF, Gray WP. Chemopreventive agents: selenium. Pharmacol Ther. 1998;79:179-92.
30. Bray T, Scoene N,editors. Models and methods in cell signalling and gene expression. Application to oxidative stress research. London: OICA Interntl; 2000.
31. El-Bayoumy K, Upadhyaya P, Chae YH, Sohn OS, Rao CV, Fiala E, Reddy BS. Chemoprevention of cancer by organo selenium compounds. J Cell Biochem.1995;22 (Suppl):92-100.
32. Patrick L. Selenium biochemistry and cancer: A review of the literature. Alt Med Rev. 2004;9:239-58.
33. Baum MK, Shor-Posner G, Lai S, Zhang G, Lai H, Fletcher MA, Sauberlich H, Page B. High risk of HIV-related mortality is associated with selenium defficiency. J Acquir Immune Defic Syndr Hum Retrovirol. 1997;15:370-4.
34. Yamaguchi T, Sano K, Takahura K, Saito L, Shinohara T, Asano T, Yasukura M; Ebselen study group. Ebselen in acute ischemic stroke: A placebo-controlled, double-blind, clinical trial. Stroke. 1998;29:12-7.
35. Ogana A, Yoshimoto T, Kikuchi H, Sano K, Saito I, Yamaguchi T, Yasuhara H. Ebselenin acute middle cerebral artery occlusions: A placebo-controlled, double-blind, controlled trial. Cerebrovasc Dis. 1999;9:112-8.
36. Peretz A, Siderova V, Neve J. Selenium supplementation in rheumatoid arthritis investigated in a double-blind placebo-controlled trial. Scand J Rheumatol. 2001;30:208-12.
37. Gazdik F, Kabrabova J, Gazdikova K. Decreased consumption of corticosteroids alters selenium supplementation in corticoid-dependent asthmatics. Bratisl Lek Listy. 2002;103:22-5.
38. Hawkes WC, Turek PJ. Effects of dietary selenium on sperm motility in healthy men. Androl. 2001;22:764-72.
39. Karaküçük S, ErtugrulMirza G, FarukEkinciler O, Saraymen R, Karaküçük I, Ustdal M.Selenium concentrations in serum, lens and aqueous humor of patients with senile cataracts. ActaOphthalmol Scand. 1995;73:329-32.
40. Packer L, Kraemer K, Rimbach G. Molecular aspects of lipoic acid in the prevention of diabetes complications. Nutrition. 2001;17:888-95.
41. Henriksen EJ. Exercise training and the antioxidant alpha lipoic acid in the treatment of insulin resistance and type 2 diabetes. Free Rad Biol Med. 2006;40:3-12.
42. Sachse G, Willms B. Efficacy of thioctic acid in the therapy of peripheral diabetic neuropathy. En: Gries FA, editor. Aspects of Autonomic Neuropathy in Diabetes. Stuttgart: ThiemeVerlag; 1980. p. 105-8.
43. Dworkin BM, Wormser GP, Axelrod F, Pierre N, Schwarz E, Schwartz E, Seaton T. Dietary intake in patients with acquired immunodeficiency syndrome (AIDS), patientswith AIDS-related complex, and serologically positive human immunodeficiency viruspatients: correlations with nutritional status. J Parenter Enteral Nutr. 1990;14:605-9.
44. Fuchs J, Schöfer H, Milbradt R, Freisleben HJ, Buhl R, Siems W, Grune T. Studies on lipoate effects on blood redox state in human immunodeficiency virus infected patients. Arzneimittelforschung. 1993;43:1359-62.
45. Berkson BM. A conservative triple antioxidant approach to the treatment of hepatitis C. Med Klin. 1999;94:84-9.
46. Maitra I, Serbinova E, Trischler H, Packer L. Alpha lipoic acid prevents buthionine sulfoximine-induced cataract formation in newborn rats. Free Rad Biol Med. 1995;18:823-9.
47. Stoll S, Hartmann H, Cohen SA, Müller WE. The potent free radical scavenger alphalipoic acid improves memory in aged mice: putative relationship to NMDA receptor deficits. Pharmacol Biochem Behav. 1993;46:799-805.
48. Thomas SR, Stocker R. Molecular action of vitamin E in lipoprotein oxidation: Implications for atherosclerosis. Free Rad Biol Med. 2000;28:1795-2005.
49. Steinberg D. Antioxidant vitamins and coronary heart disease. N Engl J Med. 1993;328:1487-9.
50. Gey KF, Stähelin HB, Eichholzer M. Poor plasma status of carotene and vitamin C is associated with higher mortality from ischemic heart disease and stroke: Basel prospective study. Clin Investig. 1993;71:3-6.
51. Sies H. Oxidative stress: oxidants and antioxidants. Exptl Physiol. 1997;82:291-5.
52. Juranek I, Bezek S. Controversy of free radical hypothesis: reactive oxygen species-causeor consequence of tissue injury? Gen Physiol Biophys. 2005;24:263-78.
53. Agudo A, Cabrera L, Amiano P, Ardanaz E, Barricarte A, Berenguer T, et al. Fruit and vegetable intakes, dietary antioxidant nutrients, and total mortality in Spanish adults: findings from the Spanish cohort of the European Prospective Investigation into Cancer and Nutrition (EPIC-Spain). Am J ClinNutr.2007;85:1634-42.
54. Miller NJ, Johnston JD, Collis CS, Rice-Evans C. Serum total antioxidant activity after myocardial infarction. Ann Clin Biochem. 1997;34:85-90.
55. O'Brien SF, Watts GF, Powrie JK, Shaw KM, Miller NJ. Lipids, lypoproteins, antioxidants and glomerular and tubular dysfunction in type I diabetes. Diabetes Res Clin Pract. 1996;32:81-90.
56. Heliovaara M, Knekt P, Aho K, Aaran RK, Alfthan G, Aromaa A. Serum antioxidants and risk of rheumatoid arthritis. Ann Rheum Dis. 1994;53:51-3.
57. Sharma RK, Agarwal A. Role of reactive oxygen species in male infertility. Urology.1996;48:835-50.
58. Ebadi M, Srinivasan SK, Baxi MD. Oxidative stress and antioxidant therapy in Parkinson's disease. Prog Neurobiol. 1996;48:1-19.
59. Portal BC, Richard MJ, Faure HS, Hadjian AJ, Favier AE. Altered antioxidant status and increased lipid peroxidation in children with cystic fibrosis. Am J Clin Nutr. 1995;61:843-7.
60. Rozzilli P, Visalli N, Signore A, Baroni MG, Buzzeti R, Cavballo MG, et al. Double-blind trial of nicotinamide in recent-onset IDDM. Diabetologia. 1995;38:848-52.
61. Heller B, Burkart V, Lampeter E, Kolb H. Antioxidant therapy for the prevention of type I diabetes. Adv Pharmacol. 1997;38:629-38.
62. Vivekananthan DP, Penn MS, Sapp SK, Hsu A, Topol EJ. Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomized trials. Lancet. 2003;361:2017-23.
63. Sowers JR. Hypertension, angiotensin II and oxidative stress. N Engl J Med. 2002;346:199-201. 54 Nakamura H, Nakamura K, Yodai J. Redox regulation of cellular activation. Ann RevImmunol. 1997;15:351-69.
64. Nakamura H, Nakamura K, Yodai J. Redox regulation of cellular activation. Ann Rev Immunol. 1997;15:351-69.
65. Cutter RC, Rodríguez H, editors. Critical reviews of oxidative stress and aging. Vol. I , II. London: World Scientific; 2002.
66. Sayre LM, Smith MA, Perry G. Chemistry and biochemistry of oxidative stress in neurodegenerative disease. Curr Med Chem. 2001;8:721-38.
67. Schulz JB, Lindenau J, Seyfried J, Dichgans J. Glutathione, oxidative stress and neurodegeneration. Eur J Biochem. 2000;267:4904-11.
68. Pratico D, Clark CM, Liun F, Rokach J, Lee VY, Trojanowski JQ. Increase of brain oxidative stress in mild cognitive impairment. A possible predictor of Alzheimer disease. Arch Neurol. 2002;59:972-6.
69. Klein JA, Longo CM, Rossman MP, Seburn L, Hurd RE, Frankel WN, et al. The harlequin mouse mutation down regulates apoptosis-inducing factor. Nature. 2002;419:367-74.
70. Boldyrev AA. Discrimination between apoptosis and necrosis of neurons under oxidative stress. Biochemistry (Mosc). 2000;65:834-42.
71. Rahman I, Tomasi A. 2nd International Meeting on Free Radicals in Health and Disease.The role of oxidants and antioxidants in the regulation of chronic diseases, may 8-12,2002, Istanbul, Turkey. Free Radic Res. 2003;37:349-54.
72. Morel Y, Barouki R. Repression of gene expression by oxidative stress. Biochem J. 1999;342:481-96.
73. Benzie IFF, Strain JJ. Ferric reducing/antioxidant power assay: Direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurements of total antioxidant power and ascorbic acid concentration. Methods Enzymol. 1999;299:15-27.
74. Esterbauer H. Estimation of peroxidative damage. A critical review. Pathol Biol. 1996;44:25-8.
75. Albertini R, Abuja PM. Monitoring of low density lipoprotein oxidation by low-level chemiluminescence. Free Radic Res. 1998;29:75- 83.
76. Biaglow JE, Manevich Y, Uckum F, Held KD. Quantitation of hydroxyl radicals produced by radiation and copper-linked oxidation of ascorbate by 2-deoxy-D-ribosemethod. Free Radic Biol Med. 1997;22:1129-38.
77. Halliwell B, Kaur H. Hydroxylation of salicylate and phenylalanine as assays for hydroxyl radicals: A cautionary note visited for the third time. Free Radic Res. 1997;7:239-44.
78. Zhang Y, Chen SY, Hsu T, Santella RM. Immunohistochemical detection of malondialdehyde-DNA adducts in human oral mucosa cells. Carcinogenesis. 2002;23:207-11.
79. Halliwell B, Gutteridge JM. Free Radicals in Biology and Medicine, third edition. Midsomer Norton, Avon, England: Oxford University Press; 1999.
80. Amano F, Noda T. Improved detection of nitric oxide radical (NO) production in an activated macrophage culture with a radical scavenger, carboxy PTIO and Griessreagent. FEBS Lett. 1995;368:25-8.
81. Sutherland JC, Monteleone DC, Trunk JG, Bennett PV, Sutherland BM. Quantifying DNA damage by gel electrophoresis, electronic imaging and number-average lengthanalysis. Electrophoresis. 2001;22:843-54.
82. Levine RL, Wehr N, Wikkiams JA, Stadtman ER, Shacter E. Determination of carbonyl groups in oxidized proteins. Methods Mol Biol. 2000;99:15-24.
83. Kutham H, Ullrich V, Estabrook RW. A quantitative test for superoxide radicals produced in biological systems. Biochem J. 1982;203:551-8.
84. Pastore A, Federici G, Bertini E, Piemonte F. Analysis of glutathione: implication in redox and detoxification. Clin Chim Acta. 2003;333:19-39.
85. Motchnik PA, Frei B, Ames BN. Measurment of antioxidants in human blood plasma. Methods Enzymol. 1994;234:269-79.
86. Shishehbor MH, Hazen SL. Antioxidant studies need a change of direction. Clev J Clin Med. 2004;71(4):285-8.
87. Gey KF. Free radicals in the environment, medicine and toxicology. En: Cody B, Middleton E, Harborne JB,editors. New York: A.R. Liss; 1994. p. 15-24.
88. Kohen R, Nyska A. Oxidation of biological systems: oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification. Toxicol Pathol. 2002;30:620-50.
89. Galati G, O'Brien PJ. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radic Biol Med. 2004;37:287-303.
90. Zamora ZB, Borrego A, López OY, Delgado R, González R, Menéndez S, Hernández Schulz S. Effects of ozone oxidative preconditioning on TNFá release and antioxidant prooxidant intracellular balance in mice during endotoxic shock. Med Inflamm. 2005;16-22.
91. Hasnian BJ, Mooradian AD. Recent trials of antioxidant therapy: What should we be telling our patients? Clev Clin J Med. 2004;71(4):327-4.
92. Gilgun Sherki Y, Rozenbaum Z, Relamed E, Offen D. Antioxidant therapy in Acute Central NervousSystem Injury: Current State. Pharmacol Rev. 2002;54:271-84.
93. D`Andrea GM. Use of antioxidants during chemotherapy and radiotherapy should be avoide. Cancer J Clin. 2005;55:319-21.
94. Prasad KN, Cole WC. Antioxidants in chemotherapy. J Clin Oncol. 2006;24(6):8-9.
95. Agarwal A, Saleh A. Utility of oxidative stress in the male infertility clinic. Natl J Androl. 2002;8:1-9.
96. McAlindon TE, Biggee BA. Nutritional factors and osteoarthritis: recent developments. Curr Opin Rheumatol. 2005;17:647-52.
97. Pasqualotto FF, Sharma RK, Potts JM, Nelson DR, Thomas AJ, Agarwal A. Seminal oxidative stress in patients with chronic prostatitis. Urology. 2000;55: 881-5.
98. Manzella D, Barbieri M, Ragno E, Paolisso G. Chronic administration of pharmacological doses of vitamin E improves the cardiac autonomic nervous system in patients with type 2 diabetes. Am J ClinNutr. 2001;73:1052-7.
99. Vertugno M, Maino A, Cardia G, Quaranta MG, Cardia L. A randomised, double masked, clinical trial of a high dose of vitamin A and vitamin E supplementation after photorefractive keratectomy. Br J Ophthalmol. 2001;85:537-9.
100. Núñez Sellés AJ. Antioxidants theraphy: Myth or reality? J Braz Chem Soc. 2005;16:699-710.
101. Bjelakovic G, Nikolova D, Lotte-Gluud L, Simonetti RG, Gluud C. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention. JAMA. 2007;297:842-57.