My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Protección Vegetal
Print version ISSN 1010-2752
Rev. Protección Veg. vol.29 no.2 La Habana May.-Aug. 2014
ARTÍCULO ORIGINAL
Desempeño biológico y reproductivo de Oebalus insularis Stal (Hemiptera: Pentatomidae) en diferentes plantas hospedantes
Biological and reproductive performance of Oebalus insularis Stal (Hemiptera: Pentatomidae) on different host plants
Bruno Zachrisson, Pamela Polanco, Onesio Martínez
Instituto de Investigación Agropecuaria de Panamá (IDIAP). Ciudad del Saber, Clayton, edificio 161-162, Apartado Postal 832-2758, Panamá. Correo electrónico: bruno.zachrissons@idiap.gob.pa.
RESUMEN
La obtención de huevos de Oebalus insularis Stal. destinados para la multiplicación de Telenomus podisi Ashmead, depende de la calidad de alimento proporcionado por diversas plantas hospedantes. Por lo que, se determinó el desempeño biológico y reproductivo de O. insularis, en Oryza sativa L. y Echinochloa colona (L.), a 28+2°C de temperatura, 80 + 5% de humedad relativa y fotofase de 12 horas. La duración del período de eclosión de la ninfa hasta la emergencia del adulto de O. insularis, fue de 20,9 y 21,2 días, para E. colona y O. sativa, respectivamente. La longevidad de hembras y machos de O. insularis, fue estadísticamente semejante, en ambas plantas hospedantes. La longevidad de la hembra fue superior a la registrada por el macho, de 15 y 12 días, respectivamente. Las hembras de O. insularis alimentadas con E. colona, presentaron mayor número de huevos por postura, número total de huevos por hembra y la tasa de eclosión de ninfas fue superior. Los parámetros biológicos y reproductivos de este insecto, confirman su adaptación al hospedante alternativo E. colona, optimizando la producción de huevos sometidos al parasitismo de T. podisi.
Palabras clave: Oebalus insularis, Oryza sativa, Echinochloa colona, desempeño biológico, desempeño reproductivo.
ABSTRACT
Obtaining eggs of Oebalus insularis Stal., for the multiplication of Telenomus podisi Ashmead depends on the quality of the food provided by diverse host plants. Therefore, the biological and reproductive performance of O. insularis on Oryza sativa L. and Echinochloa colona (L.) was determined at 28+2°C, 80 + 5% of relative humidity and 12 hours photophase. The duration of the period of nymph eclosion until the emergence of the adult of O. insularis varied between 20,9 and 21,2 days, for O. sativa and E. colona, respectively. The longevity of the female and male of O. insularis was statistically similar on both host plants. The female longevity was higher than that shown by the male, varying between 15 and 12 days, respectively. The O. insularis female fed with E. colona presented a high number of eggs per batch, total number of eggs per female and the eclosion rate of nymphs was higher. The biological and reproductive parameters of this insect confirmed their adaptation to the alternative host E. colona, optimizing the production of eggs subjected to T. podisi parasitism.
Key words: Oebalus insularis, Oryza sativa, Echinochloa colona, biological performance, reproductive performance.
INTRODUCCIÓN
El arroz (Oryza sativa L.) es uno de los cultivos más importante a nivel mundial, el cual está presente en más de 113 países y contribuye con la alimentación de la mitad de la población del mundo (1). Este rubro aporta el 50% del total de calorías, a la dieta de la población panameña (2). El 12% de la reducción del rendimiento de este cultivo, se atribuye a la incidencia de insectos (3, 4). El ¨chinche del arroz¨ como es conocido Oebalus insularis Stal, es una de las plagas más importantes para este rubro agrícola, en Panamá y América Central (5, 6). La inoculación de toxinas y fitopatógenos, ocurre en la fase de grano lechoso, a través de la inserción del estilete de las ninfas y adultos de O. insularis (7). Este síntoma conocido como ¨manchado de grano¨, guarda relación con las infestaciones de O. insularis, en donde índices superiores de 0,7 insectos panícula-1, afectan cualitativa y cuantitativamente, el rendimiento del cultivo (4, 8).
El control biológico de huevos de O. insularis, por medio de Telenomus podisi Ashmead, es la propuesta más viable para el manejo de esta plaga (7). Por lo que, el protocolo propuesto para la multiplicación de T. podisi, destaca la obtención de posturas de O. insularis para la producción de huevos parasitados (9, 7).
La utilización de diversas especies de malezas, como fuente alternativa para la alimentación de O. insularis (4), pueden influir en su desempeño biológico y reproductivo (9). En América Latina, Echinochloa colona (L.) Link es el principal hospedante alternativo de O. insularis (4), al cual se atribuye la migración temprana del insecto, a las áreas productoras de arroz (10, 11). Por lo cual, el presente artículo explica la adaptación de O. insularis, a partir del desempeño biológico y reproductivo en este hospedante alternativo. Además de E. colona, otras especies de malezas como Echinochloa crus-galli (L.) Beauv., Paspalum conjugatum Berglas y Paspalum virgatum (L.) Link, están asociadas con la alimentación y reproducción de Oebalus pugnax (12, 13). La duración del ciclo biológico de O. pugnax, varió de acuerdo al alimento ofrecido, específicamente con O. sativa y Paspalum urvillei Steudel (12). Sin embargo, el número de huevos por hembra de O. pugnax se redujo en 64%, cuando se alimentó de E. cruss-galli y P. urvillei (14, 12). La absorción de enzimas como las proteasas y amilasas, informadas en diferentes especies vegetales, puede afectar el desarrollo biológico o provocar la muerte de especies de pentatomídeos (15, 16). Además, la ingestión de simbiontes por ninfas de primer instar, también pueden influir en el desarrollo de especies de pentatomídeos, al alimentarse de plantas hospedantes alternativas (17, 18, 19, 20).
En la década de 1980, se registraron los parámetros biológicos de O. insularis en arroz, lo cual sirvió para conocer algunos aspectos biológicos, exclusivamente en O. sativa (10, 11, 21). Por lo que, el aporte de este trabajo a la ecología nutricional, destaca la influencia de otras especies de plantas hospedantes, en el desempeño biológico y reproductivo de O. insularis. Además, proporcionó elementos, para el fortalecimiento de programas de control biológico, dirigido a la multiplicación de parasitoides de huevos de O. insularis. Por lo que, el objetivo del presente estudio fue determinar el desempeño biológico y reproductivo de O. insularis, en diferentes plantas hospedantes, en condiciones controladas.
MATERIALES Y MÉTODOS
Los adultos de O. insularis fueron recolectados en parcelas de producción comercial de arroz cultivar. IDIAP-38, libre de la aplicación de insecticida, en la localidad de Chichebre (09007´67¨N 79013´78¨O), provincia de Panamá, Panamá. Posteriormente, fueron transferidos al Laboratorio de Entomología del Instituto de Investigación Agropecuaria de Panamá (IDIAP), Chepo, Panamá. La multiplicación de O. insularis, se inició con adultos provenientes de las áreas de producción de arroz, en condiciones controladas (28+2°C de temperatura, 80+5% de humedad relativa y fotofase de 12 horas). Las espigas de arroz cv. IDIAP-38 y E. colona, que sirvieron de alimento para O. insularis, fueron insertadas en tubos de vidrio conteniendo 10 ml de agua destilada y se colocaron en el interior de las unidades de multiplicación. La recolección de O. sativa y E. colona, fue realizada en parcelas libres de insecticidas y herbicidas, en intervalos de 48 horas. La unidad de multiplicación de O. insularis, constó de un cilindro de PVC transparente, de 15 cm de diámetro x 30 cm de altura, considerando como base una placa Petri cubierta con papel filtro y la parte superior se recubrió con tela de organza.
Inicialmente, la evaluación de los parámetros biológicos y reproductivos de O. insularis, en O. sativa y E. colona, se realizó con posturas provenientes de la primera generación de hembras, multiplicadas en condiciones controladas y alimentadas con arroz cv. IDIAP-38. Los huevos se recolectaron, en cintas de papel toalla, según lo recomendado por Zachrisson et al. (22), que tenían 4 cm de ancho x 20 cm de altura, adheridas a la parte superior de la unidad de multiplicación. Las posturas obtenidas de 10 hembras de O. insularis, confinadas en cada unidad de multiplicación, fueron recolectadas y separadas diariamente. Para evitar la deshidratación de los huevos del insecto se colocó papel filtro humedecido sobre la placa Petri. Posteriormente, a la eclosión de las ninfas de primer instar, estas se mantuvieron en la placa Petri, debido al comportamiento gregario presentado, evitando posibles alteraciones biológicas y fisiológicas (15). Las ninfas de segundo instar, fueron transferidas a las unidades de multiplicación, alimentándose específicamente con cada una de las especies de planta hospedante utilizadas.
Diariamente, se evaluaron los parámetros biológicos y reproductivos de O. insularis, considerando una cohorte inicial de 50 individuos por unidad de multiplicación, para cada especie de planta hospedante. La tasa de sobrevivencia se determinó, a partir de la eclosión de ninfas de primer instar hasta la muerte del adulto. Los parámetros biológicos de O. insularis, determinados en O. sativa y E. colona, fueron: a) duración del ciclo biológico entre la fase de huevo y la emergencia del adulto, b) longevidad del adulto (hembras y machos).
Previamente, a la individualización de las hembras, se estimó un período de cópula de 36 horas, para garantizar la fertilidad de los huevos de O. insularis. El registro de los parámetros reproductivos de las hembras, estuvo condicionado a su individualización, en tubos de PVC transparente de 6 cm de diámetro x 15 cm de altura, cubierto en la parte superior con tela de organza y en la base se utilizó una placa Petri. El papel toalla, de 3 cm de ancho x 8 cm de altura, que sirvió como superficie de oviposición, fue adherido a la parte superior del tubo de PVC. Los parámetros reproductivos determinados, en ambas especies de plantas hospedantes, fueron: a) período de pre oviposición, b) período de oviposición, c) período de post oviposición, d) número de posturas, e) número de huevos por posturas por hembra, f) número total de huevos por hembra.
El diseño experimental utilizado fue completamente al azar, considerando 25 unidades de multiplicación de O. insularis por especie de planta hospedante (O. sativa y E. colona). Los datos correspondientes a los parámetros biológicos, fueron analizados por medio del programa estadístico SANEST, aplicándose la prueba de homogeneidad de varianza y posteriormente, la prueba de «t» de Student para p£0,05. Los datos referentes a los parámetros reproductivos, fueron sometidos a la prueba ¨U¨ de Mann-Whitney a p£0,05, utilizando el programa MSTAT.
RESULTADOS Y DISCUSIÓN
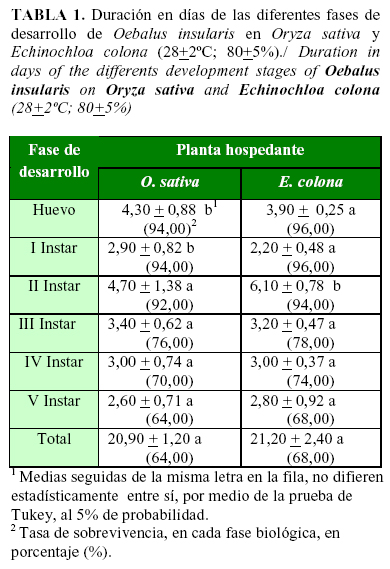
El período de incubación de los huevos provenientes de hembras alimentadas con E. colona, fue inferior al registrado en O. sativa (Tabla 1). La eclosión de ninfas de primer instar, con tasa de sobrevivencia superior a 94%, registrada en ambas plantas hospedantes, confirma las condiciones abióticas ideales para el desarrollo de O. insularis. Por lo cual, la calidad nutricional del alimento ingerido por la hembra de O. insularis, pudo influir en la duración del periodo de incubación, condición confirmada para otras especies de pentatomídeos (15).
La duración del ciclo biológico de O. insularis, fue estadísticamente semejante, en ambas plantas hospedantes (Tabla 1). La composición nutricional, de las especies vegetales evaluadas, presentan proporciones elevadas de azúcares (D-glucosa, D-fructosa, Sucrosa) y de amino ácidos esenciales (Arginina, Alanina, Leucina y Prolina) (23, 24). Las propiedades nutricionales informadas, tanto en O. sativa como en E. colona, sustentan el excelente desempeño biológico de O. insularis. La calidad nutricional de E. colona, también influyó en el desempeño biológico de O. pugnax (13), demostrándose la eficiente interacción trófica entre ambos organismos. Diversos autores confirmaron la influencia de la calidad del alimento ingerido por especies de pentatomídeos, en su desempeño biológico (15, 25, 16).
La sinergia de la composición nutricional de plantas hospedantes, con el complejo de simbiontes identificados en los cecos gástricos de pentatomídeos, favorece su desempeño biológico (17, 18, 20). Por lo que, la adaptación de especies de pentatomídeos a diferentes especies de plantas hospedantes, también depende de la diversidad de simbiontes (20).
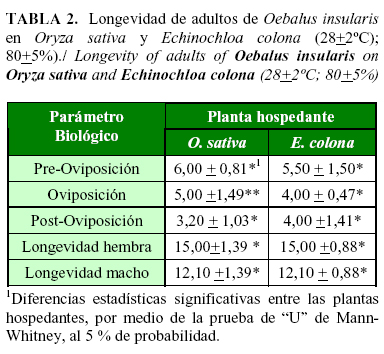
La longevidad de O. insularis, no presentó diferencias estadísticas, en relación a las plantas hospedantes evaluadas (Tabla 2). No obstante, la longevidad de la hembra fue superior a la registrada por el macho, condición que prevaleció, tanto para la población alimentada con O. sativa, como para la que se produjo en E. colona. Resultados semejantes, fueron registrados para diversas especies de pentatomídeos, en donde las propiedades nutricionales del alimento ingerido, influyeron en la longevidad, independientemente del sexo del insecto (15, 16).
El período de oviposición tuvo mayor duración en adultos alimentados con O. sativa (Tabla 2). La variación en el período de oviposición, se puede atribuir a la calidad del alimento ofrecido a las hembras de O. insularis, justificado por la condición constante de los factores abióticos. Este fenómeno se produjo también en estudios de O. pugnax cuando fue alimentada con O. sativa (14).
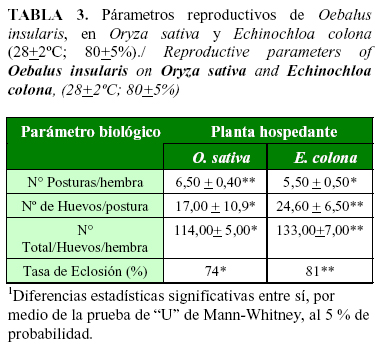
La elevada capacidad reproductiva de O. insularis, al alimentarse de E. colona, se demostró en función del número de huevos por postura, número total de huevos por hembra y por la tasa de eclosión de ninfas de primer instar (Tabla 3). La relación entre la longevidad y el número total de huevos por hembra de O. insularis, observada en E. colona, confirma la adecuación trófica entre el insecto y el hospedante alternativo. La capacidad reproductiva de especies de hemípteras, es variable y depende de la calidad y cantidad del alimento ingerido (15). Sin embargo, factores físicos como el substrato de oviposición, también influye en la capacidad reproductiva de O. insularis (22) y de otras especies de pentatomídeos (15).
El desempeño biológico y reproductivo de O. insularis, confirmó la adecuación nutricional al hospedante alternativo E. colona. Explicada por medio de la eficiente relación entre el costo metabólico de la asimilación de nutrientes de E. colona, con la elevada capacidad reproductiva de O. insularis. No obstante, se deben desarrollar investigaciones futuras, para definir el papel de los endosimbiontes en la nutrición y adaptación de O. insularis, a otras especies de plantas hospedantes. El aporte de estos estudios propoerciona elementos para el manejo de pentatomídeos en el cultivo del arroz.
AGRADECIMIENTOS
Los autores agradecen a la Secretaria Nacional de Ciencia, Tecnología e Inovación (SENACYT), Panamá, República de Panamá, por el financiamiento del proyecto FID07-082, que facilitó el desarrollo de esta investigación.
REFERENCIAS
1. FAO. Seguimiento del mercado del arroz, Roma. 2006. Consultado: 15 ene 2014. Disponible en: http://www.ftp.fao.org/docrep/fao/009/ag068s00.pdf.
2. PUGA BES. (Ministerio de Desarrollo Agropecuario, Panamá). Programa nacional de granos básicos, en el cultivo de arroz mecanizado, secano y riego. Informe final (2008-2009). 2009.
3. Vivas LE, Notz A. Plan de muestreo secuencial de Oebalus insularis Stal (Hemiptera: Pentatomidae), en el cultivo de arroz en Calabozo estado de Guárico, Venezuela. Revista UDO Agrícola. 2009;9:857-892.
4. Vivas LE, Notz A. Distribución espacial en poblaciones de Oebalus insularis Stal (Hemiptera: Pentatomidae) en el cultivo de arroz, estado Guárico, Venezuela. Revista UDO Agrícola. 2011;11:109-125.
5. Cherry R, Nuesly G. Establishment of a new stink bug pest, Oebalus insularis (Hemiptera: Pentatomidae), in Florida rice. Fla Entomol. 2010;93:291-293.
6. Rodriguez PG, Navas D, Medianero E, Chang R. Cuantificación del daño ocasionado por Oebalus insularis (Heteropetra: Pentatomidae) en el cultivo del arroz (Oryzica-1) en Panamá. Rev Col Entomol. 2006;32:131-135.
7. Zachrisson BA, Martínez O. Bioecologia de Telenomus podisi (Ashmead) y Trissolcus basalis (Wollaston) (Hymenoptera: Scelionidae), parasitoides oófagos de Oebalus insularis (Kulghast) (Heteroptera: Pentatomidae). Tecnociencia. 2011;13:65-76.
8. Vivas LE, Notz A. Determinación del umbral y nivel de daño económico del chinche vaneador del arroz, sobre la variedad cimarrón en Calabozo estado de Guárico, Venezuela. Agron Trop. 2010;60:271-281.
9. Zachrisson BA. IDIAP, Bioecología, daños y muestreos de plagas, en el cultivo del arroz. 1ra ed. Panamá; 2010. 22 p.
10.Gutiérrez A, Meneses R, Arias A, Hernández M, Amador M. La chinche del arroz en Cuba. Arroz en las Américas, 1991;12(2):2-4.
11.Meneses RA, Gutiérrez A, García G, Antigua J, Gómez F. FLAR, Guía para el trabajo de campo en el manejo integrado de plagas de arroz. 4ta ed., Colombia; 2001. 76 p.
12.Naresh JS, Smith CM. Development and survival of rice stink bugs (Hemiptera: Pentatomidae) reared on different hosts plants at four temperatures. Environ Entomol. 1983;12:1496-1499.
13.Rashid T, Johnson DT, Bernhardt JL. Feeding preference, fecundity and egg hatch of rice stink bug on artificial diet, rice and alternative host grasses. Southwest Entomol. 2005;30(4):257-262.
14.Nilhake SS. Overwintering, survival, fecundity, and mating behaviour of the rice stink bug. Ann Entomol Soc Am. 1976;69(4):717-720.
15. Panizzi AR, Silva FA. Insetos sugadores de sementes (Heteroptera). En: Panizzi AR, Parra JR, editores. Bioecologia e nutricao de insetos: Base para o manejo integrado de pragas. Embrapa Informação Tecnológica; Brasil: 2009. p. 465-522.
16.Vendramin JD, Guzo EC. Resistencia de plantas e a bioecologia e nutricao de insetos. En: Panizzi AR, Parra JR, editores. Bioecologia e nutricao de insetos: Base para o manejo integrado de pragas. Embrapa Informação Tecnológica; Brasil: 2009. p. 1055-1105.
17.Hirose E, Panizzi RA, Prado SS. Symbionts and nutrition insects. En: Panizzi AR, Parra JR, editores. Bioecologia e nutricao de insetos: Base para o manejo integrado de pragas. Embrapa Informação Tecnológica; Brasil: 2009. p. 145-156.
18.Prado SS, Almeida R. Role of simbiotic gut bacteria in the development of Acrosternum hilare and Murgantia histrionica. Entomol Exp et Appl. 2009;132:21-29.
19.Prado SS, Golden M, Follet PA, Daugherty MP, Almeida RPP. Demography of gut symbiotic and aposymbiotic Nezara viridula L. (Hemiptera: Pentatomidae). Environ Entomol. 2009;38(1):103-109.
20.Prado SS, Zucchi TD. Hosts-symbionts interactions for potentially managing heteropteran pest. Psyche. 2012; 1-9.
21.King ABS, Saunders JL. The invertebrate pests of annual food crops in Central America. 1st ed. London; 1984. 166 p.
22.Zachrisson BA, Polanco P, Martínez O. Efecto de las dietas naturales y del sustrato de oviposición, en la producción de huevos de Oebalus insularis (Heteroptera: Pentatomidae), como base para un programa de multiplicación de Telenomus podisi (Hymenoptera: Platygastridae). En: García DID, Segura IG, Agatón FT, Castro EH, editores. Resumen de la 80 Congreso Latinoamericano de Entomología; 480 Congreso Nacional de la Sociedad de Entomología. 2013. Ixtapa, Ziguatenejo, México; 23-27 Junio 2013. p. 1034-1035.
23.Mandelbaum CI, Barbeau WE, Hilu KW. Potein, calcium and iron content of wild cultivation species of Echinochloa. Plant food for Human Nutrition. 1995;47:101-108.
24.Sridhar R, Lakshminarayana G. Lipid class contents and fatty acid composition of small millets: Little (Panicum sumatrense), kodo (Pasaplum scrobiculatum) and barnyard (Echinochloa colona). J Agric Food Chem. 1992;40:2131-2134.
25.Panizzi AR, Parra JR. A bioecologia e nutricao de insetos, como base para o manejo integrado de pragas. En: Panizzi AR, Parra JR, editores. Bioecologia e nutricao de insetos: Base para o manejo integrado de pragas. Brasil: Embrapa Informção Tecnológica; 2009. p. 1107-1137.
Recibido: 13-5-2014.
Aceptado: 18-6-2014.