My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Protección Vegetal
Print version ISSN 1010-2752
Rev. Protección Veg. vol.29 no.3 La Habana Sept.-Dec. 2014
ARTÍCULO ORIGINAL
Composición química del aceite esencial de Piper hispidum Sw. y actividad antimicrobiana sobre Xanthomonas albilineans (Ashby) Dowson y Xanthomonas campestris pv. campestris (Pammel) Dowson
Chemical composition of the essential oil of Piper hispidum Sw. and antibacterial activity against Xanthomonas albilineans (Ashby) Dowson and Xanthomonas campestris pv. campestris (Pammel) Dowson
Yaíma Sánchez PérezI, Teresa M. Correa VidalII, Yudith Abreu MachadoI, Lázaro Cotilla PelierIII, Georgina Berroa NavarroIII, Oriela Pino PérezI
ICentro Nacional de Sanidad Agropecuaria (CENSA) Apartado 10, San José de las Lajas, Mayabeque. Teléfono: 47863014 ext-180. Correo electrónico: ysanchez@censa.edu.cu.
IILaboratororio Anti-doping, Instituto de Medicina Deportiva (IMD). Dirección Postal: 100 y Aldabó, Boyeros, Ciudad de La Habana. Teléfono: 547677-79.
IIICentro de Desarrollo de la Montaña, Limonar de Monte Ruz. El Salvador. Guantánamo.
RESUMEN
Los aceites esenciales son una alternativa potencial para el control de bacterias fitopatógenas. Los objetivos de este trabajo fueron determinar la composición química del aceite esencial de Piper hispidum Sw. y su actividad antibacteriana sobre Xanthomonas albilineans (Ashby) Dowson y Xanthomonas campestris pv. campestris (Pammel) Dowson. La composición del aceite de las hojas de esta especie, obtenido por hidrodestilación empleando un equipo Clevenger, se investigó por Cromatografía Gaseosa-Espectrometría de Masas (CG/EM). El efecto antibacteriano se evaluó utilizando el método de difusión en agar. El aceite esencial de P. hispidum (rendimiento 0,17%) es una mezcla compleja de 101 componentes. Como componente principal se identificó al trans-a- bisaboleno (11,28%) y se destacan otros como: b-pineno (8,20%), a-pineno (4,76%), allo-aromadendreno (4,92%), (-) espatulenol (3,65%) y L-linalol (3,61%). El aceite presentó una actividad antibacteriana ligera sobre X. campestris pv. campestris y marcada sobre X. albilineans, por lo que puede ser considerado como un candidato para la obtención de antimicrobianos destinados al manejo de esta última bacteria.
Palabras clave: aceite esencial, Piper hispidum, Xanthomonas campestris pv. campestris, Xanthomonas albilineans, composición química, actividad antibacteriana.
ABSTRACT
The essential oils are a potential alternative to the control of phytopathogenic bacteria. The aims of this work to determine the chemical composition of the essential oil of Piper hispidum Sw. and to established it´s antibacterial activity against Xanthomonas albilineans (Ashby) Dowson and Xanthomonas campestris pv. campestris (Pammel) Dowson. The composition of the leaves essential oil of this plant, obtained by hydrodistillation in a Clevenger-type apparatus, was researched by Gas Chromatography- Mass Spectrometry (GC/MS). The antibacterial effect of the essential oil was evaluated using the agar diffusion method. The essential oil (yield 0,17%) is a complex oil that have trans- a- bisabolene (11,28%) as the principal component and there are others like: b-pinene (8,2%), a-pinene (4,76%), allo-aromadendrene (4,92%), (-) spatulenol (3,65%) and L-linalool (3,61%). The oil shown a weak antibacterial activity against X. campestris pv. campestris and strong against X. albilineans, for that it is may consider as a candidate for the management of this last bacterium.
Key words: essential oil, Piper hispidum, Xanthomonas campestris pv. campestris, Xanthomonas albilineans, chemical composition, antibacterial activity.
INTRODUCCIÓN
La búsqueda de nuevos compuestos con acción plaguicida frente a microorganismos fitopatógenos constituye una prioridad en el sector agrícola, debido a la baja disponibilidad de productos eficaces, así como la aparición de resistencia y efectos secundarios de los agentes disponibles actualmente. Esta situación es evidente en bacterias como Xanthomonas albilineans (Ashby) Dowson y Xanthomonas campestris pv. campestris (Pammel) Dowson, agentes causales de las enfermedades conocidas como escaldadura foliar de la caña de azúcar y la podredumbre negra de las Crucíferas, respectivamente (1,2).
Entre las alternativas a explorar para el manejo de estas enfermedades se encuentran los productos naturales basados en aceites esenciales, debido a su menor impacto en el medio ambiente y la salud humana, considerados generalmente seguros por la Administración de Drogas y Alimentos de EEUU (U.S. Food and Drug Administration) (3,4). Estos aceites esenciales, recientemente, han recibido mucha atención por sus múltiples efectos como insecticidas (3,4,5), acaricidas (6,7), antitumorales (8), antifúngicos (9,10) y antimicrobianos (10,11,12,13). Además, se obtienen por métodos relativamente simples y baratos y algunos de sus principales componentes están exentos de registro (3).
Entre las familias conocidas por sus características aromáticas se encuentran las Piperáceas, particularmente el género Piper. Dentro de este, se encuentra la especie Piper hispidum Sw., presente en toda Cuba (14). Sus extractos se utilizan para el tratamiento de problemas estomacales, para el control de arvenses y como repelente de insectos (15,16). De esta especie se aislaron amidas con actividad fungicida (17) y su aceite esencial presenta actividad contra Bacillus subtilis (Ehrenberg) Cohn, B. cereus Frankland & Frankland, Staphylococcus aureus Rosenbach, S. epidermidis (Winslow & Winslow) Evans, S. saprophyticus (Fairbrother) Shaw et al., Enterococcus faecalis (Orla-Jensen) Schleifer & Kilpper-Bälz, Escherichia coli (Theodore von Escherich) Migula, Proteus mirabilis Hauser, Pseudomonas aeruginosa (Schroeter) Migula y Candida albicans (C.P. Robin) Berkhout (18).
Los objetivos de este trabajo fueron determinar la composición química del aceite esencial de P. hispidum y su actividad antibacteriana sobre X. albilineans y X. campestris pv. campestris.
Obtención del aceite esencial:
Las hojas de P. hispidum se recolectaron en la provincia de Guantánamo, en el mes de mayo del 2009. El material vegetal fresco se seleccionó, de forma tal que no estuviera dañado, y se procesó inmediatamente. El aceite esencial se extrajo por el método de hidrodestilación durante tres horas, empleando un equipo Clevenger (19). El aceite se secó sobre sulfato de sodio anhidro (puro para análisis, AppliChem) y se almacenó a 4ºC hasta su análisis.
Se calculó el rendimiento mediante la expresión: R=(V/M)*100; donde: R: rendimiento (%), V: volumen del aceite esencial (ml) y M: masa fresca del material vegetal (g).
Determinación de la composición química:
La composición química del aceite se determinó en un cromatógrafo de gases de la serie Agilent 6890 con un inyector del tipo «split splitless» (relación de split 20:1), acoplado con un espectrómetro de masas de la serie Agilent 05973; ambos provenientes de la firma Agilent Technologies. Se utilizó una columna capilar SPB-5 (L=15 m; DI=0,25 mm; f=0,10 µm) con una inyección de 2 µl. La temperatura del horno fue programada: 60°C (2 min isotérmicos), seguido de una rampa de calentamiento hasta 100ºC a razón de 4°C.min-1, otra rampa de 10°C.min-1 desde 100ºC hasta 250°C donde finalmente permaneció durante 5 min isotérmicos. Se utilizó helio como gas portador con un flujo constante de 1 ml.min-1. El espectrómetro de masas trabajó en modo scan de adquisición a 70 eV. Se utilizó un analizador cuadrupolar a 150ºC de temperatura del cuadrúpolo, el detector trabajó en un rango de masas de hasta 800 uma y las temperaturas de la interfase y de la fuente fueron 280°C y 230°C, respectivamente. La identificación de los compuestos se llevó a cabo mediante el uso combinado de las bases de datos automatizadas NBS-NISTASCI y Wiley 275.
Ensayos de actividad antibacteriana:
Se utilizaron las bacterias fitopatógenas X. albilineans (cepa JR), X. campestris pv campestris (cepa XC2), pertenecientes al cepario de bacterias del Laboratorio de Bacteriología Vegetal del CENSA. La bacteria X. albilineans se aisló de muestras procedentes de la Estación Territorial de Investigaciones de la Caña de Azúcar de Jovellanos y se identificó mediante métodos moleculares; mientras que X. campestris pv. campestris, procedente de muestras de tomate, se aisló y caracterizó mediante técnicas morfológicas y bioquímicas en el Instituto de Investigaciones de Sanidad Vegetal (INISAV).
Las bacterias se sembraron en medio Wilbrink (BDH) y Agar Nutriente (Biocen) respectivamente, y se incubaron a 28ºC durante 48 horas. A partir de las colonias obtenidas, se prepararon suspensiones bacterianas en solución salina estéril (Cloruro de sodio (Merck) al 0,85%), hasta lograr una concentración de inóculo de 1-2 x 1010 Unidades Formadoras de Colonias (UFC) .ml-1, equivalente a una densidad óptica de 1, a una longitud de onda de 540 nm en un espectrofotómetro (T90 + UV/Vis Spectrometer PG Instruments Ltd). De este inóculo se tomaron alícuotas de 20 µl y se colocaron en placas Petri estériles de 9 cm con 20 ml del medio correspondiente para cada bacteria.
Para evaluar la sensibilidad de estos microorganismos al aceite esencial se empleó el método de difusión en agar según la técnica estandarizada por el Instituto de Estándares de Laboratorios y Clínicas (CLSI; 2012) (20). Para ello, 4 discos de papel de filtro de 6 mm de diámetro se depositaron cuidadosamente de forma equidistante sobre el medio inoculado con las suspensiones bacterianas. Se colocaron dos papeles tratados con las dosis 10; 5; 2,5 y 1 µl del aceite y dos papeles control (sin extracto) por placa. Se empleó un control del crecimiento bacteriano y un control positivo de Kanamicina (10 µg.disco-1), producido por el Ministerio de Salud Pública (MINSAP, Cuba), para ambas bacterias. La temperatura de incubación fue de 28°C durante 48 horas. Una vez transcurrido este tiempo se midió el halo de inhibición del crecimiento bacteriano. La evaluación se realizó por cuatriplicado para cada tratamiento.
RESULTADOS Y DISCUSIÓN
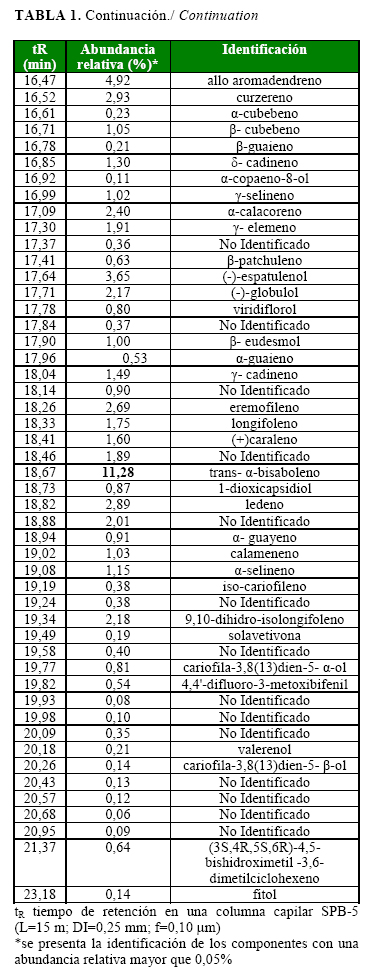
El aceite esencial de P. hispidum (rendimiento fresco de 0,17%) es una mezcla compleja de 101 componentes, de los cuales se identificaron el 92,62% de su abundancia relativa. De ellos, el 16,18% corresponde a hidrocarburos moterpénicos, el 25,27% son compuestos oxigenados y el mayor porcentaje (51,17%) es de hidrocarburos sesquiterpénicos. Este aceite se caracteriza por la presencia de varios compuestos con cantidades relativas bajas (entre 2 y 12%); tiene una mayor abundancia relativa el trans-a- bisaboleno (11,28%) y se destacan otros como: b-pineno (8,2 %), a-pineno (4,76%), allo-aromadendreno (4,92%), (-) espatulenol (3,65%) y L-linalol (3,61 %) (Tabla 1a, Tabla 1b, Figura).
Trabajos precedentes han revelado la presencia de b-eudesmol (17,5%) y trans-3,6-dimetil-5-isoprenil-6-vinil-4,5,6,7-tetrahidrobenzofurano (12,9%) como principales constituyentes del aceite esencial de las hojas de P. hispidum recolectado en Cuba (21). De la misma especie recolectada en Brasil se informan b-pineno (19,7%), a-pineno (9,0%), s-3-careno (7,4%), a-cadinol (6,9%), espatulenol (6,2%), óxido de cariofileno (4,0%) y b-eudesmol (3,9%) (22). En Brasil también se identificaron el b-pineno (12%), khusimeno (12,1%) y g- cadineno (13,2%) como componentes principales de esta especie (23). Delgado y Cuca (24) informan como componentes mayoritarios del aceite de los frutos de la planta recolectada en Colombia al limoneno, a y b- pineno y en Venezuela se informó este aceite rico en a-pineno (15,3 %), b-pineno (14,8%), b-elemeno (8,1 %), óxido de cariofileno (7,8 %) y s-3-carene (6,9 %) (18). Nuestros resultados coinciden con algunos de los planteados por estos autores en cuanto a la presencia de a y b- pineno, espatulenol, limoneno (1,65%), g- cadineno (1,49%), b-eudesmol (1,00%) y b-elemeno (0,19%); no así con el resto de los componentes principales del aceite.
Estas diferencias se deben fundamentalmente a factores genéticos, ecológicos y de condiciones de extracción. En los aceites esenciales, al igual que todos los metabolitos secundarios, su rendimiento, composición química y, por consiguiente, su actividad biológica, son muy sensibles a cambios de este tipo (25).
El aceite mostró actividad antibacteriana frente a X. albilineans, con una inhibición significativamente superior a la observada en el control positivo de Kanamicina; sin embargo, X. campestris pv. campestris fue más resistente, con solo una ligera inhibición a la máxima dosis evaluada (Tabla 2). Investigaciones anteriores demostraron el efecto antibacteriano frente a X. albilineans y X. campestris pv. campestris de otras especies de este género (13,26,27,28,29) y coinciden en cuanto a la mayor sensibilidad de X. albilineans. En estos casos el efecto antibacteriano estuvo asociado a los componentes mayoritarios de los aceites estudiados, todos compuestos oxigenados.
El aceite de P. hispidum está constituido fundamentalmente por hidrocarburos sesquiterpénicos, menos activos dentro del grupo que compone a los aceites esenciales (30,31); aunque en algunos estudios se ha comprobado que un mayor contenido de hidrocarburos sesquiterpénicos pueden ser más activos que los monoterpenos frente a ciertos microorganismos, siempre que tengan mayor cantidad de dobles enlaces (32). Es probable que la actividad antibacteriana del aceite esté relacionada con su contenido de compuestos sesquiterpénicos o, preferiblemente, con la acción combinada de todos los componentes del aceite esencial. Dentro de ellos, existe un grupo que tiene informada actividad antibacteriana como son el linalol, a-pineno y b-pineno, b-elemeno, germacreno, p-cimeno, g-terpineno, mirceno, entre otros (33).
La actividad antibacteriana del aceite de P. hispidum, considerando su gran variedad de componentes, no debe ser atribuible a un mecanismo específico, sino a la acción combinada de varios de ellos sobre diferentes dianas en la célula (33,34). Una importante característica de los aceites esenciales y sus componentes es su hidrofobicidad. Esta incide en la ruptura de los lípidos en la membrana celular bacteriana y las mitocondrias; como resultado puede desestabilizarse la estructura y hacerse más permeable (35,36), ocurrir pérdida de iones y otros contenidos de las células (34,37), afectar la membrana citoplasmática, alterar la fuerza motriz protónica, el flujo de electrones, el transporte activo y la coagulación del contenido celular (38,39).
El aceite esencial de P. hispidum tiene niveles altos de actividad contra X. albilineans, cumpliendo con uno de los criterios más importantes para ser escogido en la etapa inicial de investigación y continuar su desarrollo hasta la posible obtención de un producto antibacteriano. Este aceite esencial, puede ser considerado como principio activo o ser parte de mezclas de principios activos para el manejo de la escaldadura foliar de la caña de azúcar. Su compleja composición química aumenta sus posibilidades de tener varios modos de acción y por tanto disminuye la aparición de resistencia en los organismos diana, elementos importantes para la obtención de antimicrobianos competitivos en el mercado.
REFERENCIAS
1. Jiménez O, Contreras N. Nota técnica Respuesta de 11 variedades de caña de azúcar a la escaldadura foliar (Xanthomonas albilineans (Ashby) Dowson) y evaluación de dos métodos de inoculación. Bioagro. 2009;21(2):139-142.
2. Bermúdez-Cañete MC, Nieto RPR. El papel biológico de las xantomonadinas en Xanthomonas campestris pv. campestris. Serie Fisiología Vegetal. 2009;2(3):108-112.
3. Jiang Z, Akhtar Y, Bradbury R, Zhang X, Isman MB. Comparative toxicity of essential oils of Litsea pungens and Litsea cubeba and blends of their major constituents against the Cabbage Looper, Trichoplusia ni. J Agric Food Chem. 2009;57:4833-4837.
4. Isman MB, Miresmailli S, Machial C. Commercial opportunities for pesticides based on plant essential oils in agriculture, industry and consumer products. Phytochem Rev. 2010;10:197-204.
5. Jiang Z, Akhtar Y, Zhang X, Bradbury R, Isman M B. Insecticidal and feeding deterrent activities of essential oils in the cabbage looper, Trichoplusia ni (Lepidoptera: Noctuidae). J Appl Entomol. 2012;136:191-202.
6. Pino O, Sánchez Y, Rodríguez H, Correa TM, Demedio J, Sanabria JL. Caracterización química y actividad acaricida del aceite esencial de Piper aduncum subsp. ossanum frente a Varroa destructor. Rev Protección Veg. 2011a;26(1):52-61.
7. Pino O, Sánchez Y, Rojas MM, Rodríguez H, Abreu Y, Duarte Y, et al. Composición química y actividad plaguicida del aceite esencial de Melaleuca quinquenervia (Cav) S.T. Blake. Rev Protección Veg. 2011b;26(3):177-186.
8. Dung NT, Bajpai VK, Yoon JI, Kang SC. Antiinflammatory effects of essential oil isolated from the buds of Cleistocalyx operculatus (Roxb) Merr and Perry. Food Chem Toxicol. 2009;47:449-453.
9. Wang H, Jiang Z, Feng J, Zhang X. Inhibitory effects of seven essential oils against Botrytis cinerea. Plant Prot. 2007;33:111-114.
10.Reichling J, Schnitzler P, Suschke U, Saller R. Essential oils of aromatic plants with antibacterial, antifungal, antiviral, and cytotoxic properties - an overview. Forsch Komplementmed. 2009;16:9-90. DOI: 101159/000207196.
11.Pino O, Sánchez Y, Rojas MM, Abreu Y, Correa TM. Composición química y actividad antibacteriana del aceite esencial de Pimpinella anisum L. Rev Protección Veg. 2012;27(3):181-187.
12.Rojas MM, Sánchez Y, Abreu Y, Espinosa I, Correa TM, Pino O. Caracterización química y actividad antibacteriana de aceites esenciales de Ocimum basilicum L. y Ocimum basilicum var. genovese L. Rev Protección Veg. 2012;27(2):130-134.
13.Sánchez Y, Correa TM, Abreu Y, Pino O. Efecto del aceite esencial de Piper auritum Kunth y sus componentes sobre Xanthomonas albilineans (Ashby) Dowson y Xanthomonas campestris pv. campestris (Pammel) Dowson. Rev Protección Veg. 2013;28(3):204-210.
14.Saralegui H. Piperaceae. En: Jreuter W& Rankin R (eds). Flora de la República de Cuba. Serie A, Plantas vasculares. Fascículo 9(3). Koenigstein: Koeltz Scientific Books; 2004. p. 94.
15.Burke B, Nair M. Phenylpropeneo, benzoic acid and flavonoid derivatives from fruits of Jamaican Piper species. Phytochemistry. 1986;25(6):1427-1430.
16.Chávez DC, Pérez YJ. Efectos alelopáticos de extractos de Piperaceae sobre germinación y emergencia de arvenses y plantas cultivadas bajo condiciones controladas (Tesis). Facultad de Ciencias Agropecuarias, Universidad de Cundinamarca, Fusagasugá, Colombia. 2008. p. 96.
17.Navickiene HMD, Morandim AA, Alécio AC, Regasini LO, Bergamo DCB, Telascrea M, et al. Composition and antifungal activity of essential oils from Piper aduncum, Piper alboreum and Piper tuberculatum. Quim Nova. 2006;29(3):467-70.
18.Morales A, Rojas J, Moujir LM, Araujo L, Rondón M. Chemical composition, antimicrobial and cytotoxic activities of Piper hispidum Sw. essential oil collected in Venezuela. J App Pharm Sci. 2013;3(06):16-20.
19.Santos AS, Alves SM, Figueirêdo FJC, Neto OGR. Descrição de sistema e de métodos de extração de óleos essenciais e determinação de umidade de biomassa em laboratório. Comunicado Técnico, 99. Embrapa Amazônia Oriental, ISSN 1517-2244, Belém, PA; 2004. p. 6.
20.Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk susceptibility test, 11th Edition. Approved Standard M02-A11. CLSI, Wayne, Pa; 2012.
21.Pino JA, Marbot R, Bello A, Urquiola A. Composition of the essential oil of Piper hispidum Sw. from Cuba. J Essent Oil Res. 2004;16(5):459-460.
22.Potzernheim M, Bizzo HR, Agostini-Costa TS, Vieira RF, Carvalho-Cilva M, Gracindo LAMB. Chemical caracterization of seven Piper species (Piperaceae) from Federal District, Brazil, based on volatile oil constituents. Rev Bras Pl Med. 2006;8:10-12.
23.Assis A, Brito V, Bittencourt M, Silva L, Oliveira F, Oliveira R. Essential oils of four Piper species from Brazil. J Essent Oil Res. 2013;25(3):203-209.
24.Delgado AW, Cuca SLE. Composición química del aceite esencial de Piper hispidum. Revista Productos Naturales. 2007;1(1):5-8.
25.Murray BI, Paluch G. Needles in the Haystack: Exploring Chemical Diversity of Botanical Insecticides. En: López Ó, Fernández-Bolaños JG, editores. Royal Society of Chemistry; Green Trends in Insect Control. 2011. p. 248-265.
26.Sánchez Y, Pino O, Correa TM, Naranjo E, Iglesia A. Estudio químico y microbiológico del aceite esencial de Piper auritum Kunth (caisimón de anís). Rev Protección Veg. 2009;24(1):39-46.
27.Sánchez Y, Pino O, Jorge FL, Abreu Y, Naranjo E, Iglesia A. Actividad promisoria de aceites esenciales de especies pertenecientes a la tribu Pipereae frente a Artemia salina y Xanthomonas albilineans. Rev Protección Veg. 2011;26(1):45-51.
28.Sánchez Y, Correa TM, Abreu Y, Martínez B, Duarte Y, Pino O. Caracterización química y actividad antimicrobiana del aceite esencial de Piper marginatum Jacq. Rev Protección Veg. 2011;26(3):170-176.
29.Sánchez Y, Correa TM, Abreu Y, Pino O. Efecto del aceite esencial de Piper marginatum Jacq. y sus componentes sobre Xanthomonas albilineans (Ashby) Dowson. Rev Protección Veg. 2012;27(1):39-44.
30.Sinha K, Gulati BC. Antibacterial and antifungal study of some essential oils and some of their constituents. Indian Perfum. 1990;34:204-208.
31.Srivastava A, Shukla YN, Kumar S. Recent development in plant derived antimicrobial constituents A Review. J Med Arom Plant Sci. 2000;22:349-405.
32.Sasidharan I, Menon AN. Comparative chemical composition and antimicrobial activity fresh and dry Ginger oils (Zingiber officinale roscoe). Int J Curr Pharm Res. 2010;2(4):40-43.
33.Burt S. Essential oils: their antibacterial properties and potential applications in foods-a review. Int J Food Microbiol. 2004;94:223-253.
34.Carson CF, Mee BJ, Riley TV. Mechanism of action of Melaleuca alternifolia (tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage and salt tolerance assays and electron microscopy. Antimicrob. Agents Ch. 2002;46(6):1914-1920.
35.Knobloch K, Weigand H, Weis N, Schwarm H-M, Vigenschow H. Action of terpenoids on energy metabolism. En: Brunke EJ (Ed.), Progress in Essential Oil Research: 16th International Symposium on Essential Oils. De Gruyter, Berlin; 1986.p. 429- 445.
36.Sikkema J, De Bont JAM, Poolman B. Interactions of cyclic hydrocarbons with biological membranes. J Biol Chem. 1994;269(11):8022-8028.
37.Ultee A, Bennink MHJ, Moezelaar R. The phenolic hydroxyl group of carvacrol is essential for action against the food-borne pathogen Bacillus cereus. Appl Environ Microb. 2002;68(4):1561-1568.
38.Sikkema J, De Bont JAM, Poolman B. Mechanisms of membrane toxicity of hydrocarbons. Microbiol Rev. 1995;59(2):201-222.
39.Davidson PM. Chemical preservatives and natural antimicrobial compounds. En: Doyle MP, Beuchat LR, Montville TJ (Eds.), Food Microbiology: Fundamentals and Frontiers. ASM, Washington; 1997. p. 520-556.
Recibido: 13-2-2014.
Aceptado: 15-7-2014.