INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) se cultiva en diversas partes del mundo, pues posee importancia socioeconómica, al constituir un alimento básico vinculado a la seguridad alimentaria de numerosas poblaciones, ser fuente de trabajo y rubro de exportación; se considera una fuente principal de proteínas en la dieta humana en aquellos países donde el consumo de proteína animal es limitado (1,2,3).
En Cuba, el frijol común representa un componente básico de la dieta diaria y se consume, fundamentalmente, en forma de potaje, arroz congrí y moros y cristianos. Este grano goza de gran preferencia con relación a otros alimentos similares, por constituir una rica fuente de hierro y proteínas (4). En el año 2015, se destinaron 30 485 ha para el cultivo del frijol que han contribuido al incremento de su producción en los últimos cinco años. Sin embargo, Meloidogyne incognita (Kofoid y White) Chitwood influye de forma negativa en los rendimientos de este cultivo (5).
Los nematodos agalleros (Meloidogyne spp.) representan factores limitantes de la producción de frijol común a nivel mundial (6) y en Cuba, aunque no se realizaron estudios de daños y pérdidas en condiciones de producción, se sabe que el nematodo agallero M. incognita afecta de forma considerable al cultivar ‛Cuba Cueto 25-9’ de amplia extensión en el país (7).
El manejo de esta plaga se realiza combinando varias tácticas, entre las que se destaca el uso de cultivares resistentes. Esta alternativa constituye una forma más efectiva, económica y ambientalmente segura (8). Sin embargo, en muchas ocasiones no se cuenta con estos cultivares o con suficiente información sobre su comportamiento frente a nematodos formadores de agallas (5).
El uso de marcadores enzimáticos permite conocer aspectos relacionados con la resistencia de las plantas y el efecto de ciertos patógenos sobre el metabolismo de las mismas, a nivel bioquímico (9). Entre los sistemas enzimáticos que más se emplean con este fin se encuentran las Peroxidasas (PO), Fenilalanina amonio liasas (PAL), Quitinasas y β-1,3-Glucanasas (10,11).
En la actualidad, se conoce que los cultivares `BAT-306´ y `Triunfo-70´, utilizados con frecuencia en Cuba, se comportan como susceptible y resistente, respectivamente, frente a Meloidogyne incognita (5). No obstante, no existen informes sobre su comportamiento desde el punto de vista bioquímico. El objetivo del presente estudio fue evaluar el comportamiento de los cultivares de frijol BAT-306 y Triunfo-70 frente a Meloidogyne incognita utilizando marcadores enzimáticos relacionados con la defensa de la planta.
MATERIALES Y MÉTODOS
El experimento se realizó en los aisladores biológicos del Centro Nacional de Sanidad Agropecuaria (CENSA) (25±2°C, humedad relativa entre el 80 y el 85 % y fotoperiodo natural). Las semillas de ambos cultivares se sembraron en cajuelas que contenían una mezcla de suelo y materia orgánica en proporción 3:1. A los siete días de germinadas (15 cm de longitud y al menos dos hojas verdaderas) se inocularon con 2000 juveniles de segundo estadio (J2), obtenidos a partir de una población pura de Meloidogyne incognita, utilizando el método de Baermann modificado (12) y que permite recuperar solo juveniles activos. Como controles se utilizaron plantas sin inocular.
Se realizaron la determinación de actividad enzimática específica Peroxidasa (PO), Fenilalanina amonio liasa (PAL), Quitinasa y Glucanasa, así como la detección de isoenzimas PO según métodos descritos por Peteira et al. (13). Para todos los análisis se tomaron muestras foliares a los 1; 3; 5; y 7 días después de la inoculación y se realizaron tres réplicas y tres repeticiones para cada tratamiento (planta sin inocular y planta inoculada con el nematodo para cada cultivar). Los datos se compararon a través de un Análisis de Varianza y la Prueba de Rangos Múltiples de Duncan (p<0,05) usando el programa InfoStat versión 2017 (14).
RESULTADOS Y DISCUSIÓN
En todos los sistemas enzimáticos analizados, los tratamientos inoculados mostraron niveles superiores de actividad en comparación con sus controles, lo que evidencia la inducción de estas enzimas cuando la planta se encuentra en presencia del nematodo.
El cultivar ´BAT-306` alcanzó los mayores valores de actividad PO; sin embargo, ´Triunfo-70` mostró niveles elevados de actividad de forma más prolongada en el tiempo. En la actividad PAL se destacó el cultivar ´Triunfo-70`, pues alcanzó, de forma más rápida, el mayor valor de actividad enzimática detectado durante la dinámica, mientras que ´BAT-306` solo mostró un ligero aumento de la actividad en el tiempo. Los dos cultivares tuvieron comportamientos similares en cuanto a la enzima Quitinasa, alcanzaron los mayores niveles de actividad a los tres días. No obstante, ´Triunfo-70` aumentó en dos veces su actividad y ´BAT-306` solo lo hizo una vez. En la actividad Glucanasa, a diferencia del resto de las actividades enzimáticas analizadas, los valores máximos de actividad para ambos cultivares aparecen al quinto día posterior a la inoculación. En este caso, no se encontraron diferencias significativas entre los valores de actividad en los cultivares para este momento; no obstante, ´Triunfo-70` fue el primero en alcanzar niveles elevados de actividad enzimática (tercer día).
Desde los momentos iniciales, en ´Triunfo-70` se indujeron aumentos considerables en los niveles de actividad de todos los sistemas enzimáticos y, en algunos, estos incrementos estuvieron más sostenidos en el tiempo o se produjeron más tempranamente que en el cultivar ´BAT-306`. (Figura 1)
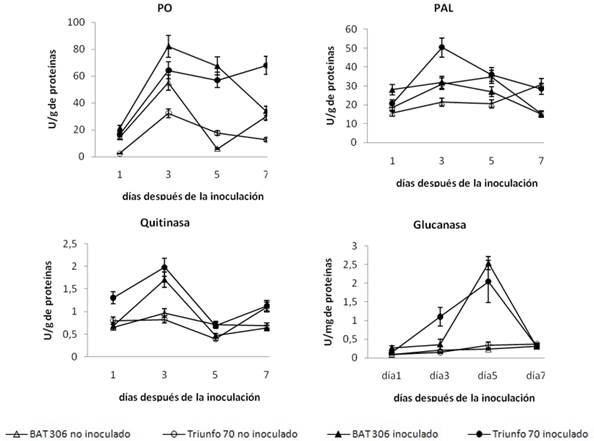
FIGURA 1 Efecto de Meloidogyne incognita en los mecanismos de defensa en los genotipos de frijol estudiados. Los genotipos se compararon entre ellos y con sus respectivos controles. / Effect of Meloidogyne incognita on the defense mechanisms in the bean genotypes studied. The genotypes were compared among them and with their respective controls.
El tiempo requerido para activar los mecanismos de defensa es importante para la supresión de la invasión por los patógenos y explica, en parte, el hecho de que las plantas se comporten como resistentes o susceptibles frente a los mismos. La inducción temprana de actividad enzimática y altos niveles de expresión de las enzimas influyen positivamente en la disminución de la severidad de la infección provocada por los patógenos (15,16,17).
Los resultados del presente estudio pudieran ser la causa por la cual el cultivar ´Triunfo- 70` se comporta como pobre hospedante frente a Meloidogyne incognita (5). Las enzimas analizadas están involucradas en diferentes respuestas de defensa. Entre estas respuestas se encuentran: el reforzamiento de las paredes celulares mediante la formación de lignina y suberina, el efecto antinutritivo de las plantas (como resultado de la generación de sustancias citotóxicas para los patógenos), la inhibición de las enzimas hidrolíticas que estos emplean para la infección y el establecimiento y la desintegración de las células hospedantes. También participan en otros procesos como la síntesis de fenilpropanoides, compuestos que son necesarios para el crecimiento y desarrollo normal de las plantas, y de compuestos relacionados con la defensa de las mismas, como son los compuestos fenólicos (10,18).
Durante el análisis de las isoenzimas PO se detectaron cinco isoformas en total, de las cuales tres fueron comunes para todos los tratamientos. Las mismas mostraron menor intensidad en los controles, lo que se corresponde con los niveles de actividad enzimática detectada. En los tratamientos que expresaron las cinco isoformas, se observó el mismo patrón de bandas, aunque existieron diferencias en la intensidad. Se destacó el cultivar ´BAT-306` con bandas más intensas, muy similar a los resultados obtenidos para la determinación de actividad enzimática en solución. (Figura 2)
Se informaron con anterioridad resultados variables relacionados con el número de isoenzimas PO en frijol y detectaron 3; 4 o 5 isoformas. Esto ha estado en correspondencia con la parte de la planta analizada y con el tipo de estrés al que se sometieron las mismas. En todos los casos existieron diferencias entre los tratamientos y sus controles, ya sea en cuanto a la intensidad de las bandas o al número de isoformas detectadas (19,20,21).
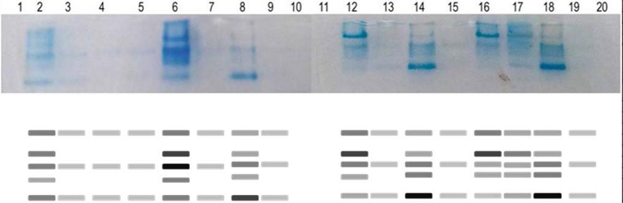
FIGURA 2 Gel de electroforesis y zimograma para las isoenzimas PO en los genotipos de frijol estudiados. Líneas 1, 10, 11 y 20: Agua; 2: BAT-306 inoculada día 1; 3: BAT-306 no inoculada día 1; 4: Triunfo-70 inoculada día 1; 5: Triunfo-70 no inoculada día 1; 6: BAT-306 inoculada día 3; 7: BAT-306 no inoculada día 3; 8: Triunfo-70 inoculada día 3; 9: Triunfo-70 no inoculada día 3; 12: BAT-306 inoculada día 5; 13: BAT-306 no inoculada día 5; 14: Triunfo-70 inoculada día 5; 15: Triunfo-70 no inoculada día 5; 16: BAT-306 inoculada día 7; 17: BAT-306 no inoculada día 7; 18: Triunfo-70 inoculada día 7; 19: Triunfo-70 no inoculada día 7 / Gel electrophoresis and zymogram for the PO isoenzymes in the bean genotypes studied. Lane 1; 10, 11 and 20: Water; 2: BAT-306 inoculated on day 1; 3: BAT-306 not inoculated on day 1; 4: Triumph-70 inoculated on day 1; 5: Triumph-70 not inoculated on day 1; 6: BAT-306 inoculated on day 3; 7: BAT-306 not inoculated on day 3; 8: Triumph-70 inoculated on day 3; 9: Triumph-70 not inoculated on day 3; 12: BAT-306 inoculated on day 5; 13: BAT-306 not inoculated on day 5; 14: Triumph-70 inoculated on day 5; 15: Triumph-70 not inoculated on day 5; 16: BAT-306 inoculated on day 7; 17: BAT-306 not inoculated on day 7; 18: Triumph-70 inoculated day on7; 19: Triumph-70 not inoculated on day 7.
En general, ´Triunfo-70` mostró los mejores resultados. Teniendo en cuenta la función que estos sistemas enzimáticos cumplen en los mecanismos de defensa de las plantas, se pudiera plantear que este cultivar se encuentra mejor preparado, desde el punto de vista bioquímico, para enfrentar el ataque de Meloidogyne incognita. Este resultado corrobora lo obtenido anteriormente por Hernández et al. (5) y constituye un elemento a tener en cuenta, tanto para los programas de mejoramiento como para los sistemas de producción del cultivo del frijol en Cuba.














