My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Archivo Médico de Camagüey
On-line version ISSN 1025-0255
AMC vol.18 no.4 Camagüey July.-Aug. 2014
ARTÍCULOS ORIGINALES
Estabilidad de un suero control para proteínas totales como controlador bioquímico en los laboratorios clínicos
Stability of a control serum for total proteins used as a biochemical controller in clinical laboratories
MSc. Yadira Falcón Almeida; Dr. MV. Lidyce Quesada Leyva; Lic. Odalys Sosa Mendoza; Lic. Sandra Fernández Torres; Dr. MV Zaddys Ruiz Hunt; Téc. Ludmila García Chaviano
Universidad de Ciencias Médicas. Camagüey, Cuba.
RESUMEN
Fundamento: una de las vías fundamentales para garantizar la calidad en los laboratorios clínicos es mediante el uso del suero control o controlador. El alto costo de estos productos en el mercado nacional es una problemática hoy en día.
Objetivo: evaluar la estabilidad de un suero bovino adulto para proteínas totales como controlador bioquímico en los laboratorios clínicos.
Método: se realizó un estudio cuasiexperimental, mediante muestreo probabilístico durante tres años (enero de 2010-diciembre de 2012). Se evaluó la estabilidad a tiempo real del suero enriquecido con proteínas totales durante 12 meses a dos temperaturas (refrigeración y congelación). El estudio quedó diseñado para tres lotes por mes y tres determinaciones por lote, para un número total de muestra del estudio (N=63).
Resultados: se obtuvo un suero control líquido para proteínas totales. La concentración de proteínas totales, en el producto obtenido en condiciones de refrigeración y congelación se mantuvieron estables por un tiempo de 12 meses. El producto obtenido al compararse con el suero control de la firma OLYMPUS, mostró fluctuaciones similares con respecto a la concentración de proteínas totales.
Conclusiones: se logró un material de referencia como controlador estable por un período de 12 meses.
DeCS: SUERO/química; ESTÁNDARES DE REFERENCIA; ANÁLISIS DE SECUENCIA DE PROTEÍNA; CONTROL DE CALIDAD; EPIDEMIOLOGÍA EXPERIMENTAL.
ABSTRACT
Background: one of the main ways to guarantee the quality in clinical labs is by using a control serum or controller. A problem we face is the lack of these products in the domestic market due to their high cost.
Objective: to evaluate the stability of an adult bovine serum for total proteins as a biochemical controller in clinical labs.
Method: a quasiexperiment was conducted during three years (January 2010-December 2012) through a probabilistic sampling. The stability in real time of the serum enriched with total proteins was evaluated during 12 months under two temperatures (refrigeration and freezing). The study was designed for three batches per month and three determinations per batch, for a total number of sample of the study (N=63).
Results: a liquid control serum for total proteins was obtained. The concentration of total proteins in the product obtained under refrigeration and freezing conditions kept stable for 12 months. The obtained product, when compared to the control serum from the company OLYMPUS, showed similar fluctuations regarding the concentration of total proteins.
Conclusions: a reference material was obtained as a stable controller for a period of 12 months.
DeCS: SERUM/chemistry; REFERENCE STANDARDS; SEQUENCE ANALYSIS, PROTEIN; QUALITY CONTROL; EPIDEMIOLOGY EXPERIMENTAL.
INTRODUCCIÓN
La química clínica es la rama del laboratorio clínico que estudia las alteraciones cuantitativas y cualitativas que ocurren en las sustancias del organismo desde el punto de vista químico valiéndose de métodos analíticos. Este estudio se hace con los objetivos siguientes; investigar, diagnosticar, seguir la evolución de las enfermedades, controlar los efectos de medicamentos.1, 2
Los métodos analíticos se utilizan en química clínica para conocer la presencia o concentración de las múltiples sustancias y elementos que componen o existen en los seres humanos, aunque puede ser utilizado con los mismos objetivos en animales, e incluso algunos de estos en las plantas.3,4 Para que los resultados de estos métodos sean altamente confiables cada laboratorio debe poseer un sistema bien establecido y organizado para controlar la precisión y exactitud, lo cual tiene un largo historial de aplicación en los laboratorios de diagnóstico clínico.5-8
Para las investigaciones en la química clínica, existen actualmente varios fabricantes reconocidos de sueros controles para diagnóstico y patrón, dentro de ellos se encuentra la firma oliympus y la human diagnostica que producen un control químico líquido a partir del suero bovino, ajustándole analitos con varios extractos animales y otros analitos no proteicos. 9-12
A pesar de los esfuerzos hechos durante la década pasada, la situación actual de los laboratorios clínicos de Latinoamérica se caracteriza por un nivel insuficiente de confiabilidad en los resultados, lo que se ha observado en datos de garantía de calidad en países miembros de la Confederación Latinoamericana de Bioquímica Clínica (COLABIOCLI). En muchos países subdesarrollados los laboratorios están en desventajas en virtud de la no disponibilidad o alto costo de estos productos, por lo que la Organización Mundial de la Salud (OMS) alienta a la producción local de materiales de control de calidad para asegurar su disponibilidad.13-15
La falta de estandarización y de criterios unificados en materia de calidad, sugieren indicar la dirección que asegure la eficacia del trabajo y facilite la labor de los laboratorios clínicos, para lograr resultados que sean clínicamente útiles.15-19
El objetivo del trabajo fue evaluar la estabilidad de un suero control para ser utilizado como controlador bioquímico en los laboratorios clínicos.
MÉTODOS
Se realizó un estudio cuasiexperimental, mediante muestreo probabilístico desarrollado durante tres años (enero de 2010 - diciembre de 2012), la evaluación del producto se realizó en el Centro de Inmunología y Productos Biológicos (CENIPBI) de la Universidad de Ciencias Médicas de Camagüey (UCM-C). La materia prima (sangre) se extrajo de la Unidad de Productos Biológicos (UPB) situada en el kilómetro 8 del primer anillo, municipio Jimaguayú, de la provincia de Camagüey. El estudio quedó diseñado para tres lotes por mes y tres determinaciones por lote, para un número total de muestra del estudio (N=63).
En la investigación se han observado cuidadosamente los diseños metodológico y experimental, reconocidos por diferentes autores como claves para alcanzar resultados verdaderamente confiables y científicos, y punto de partida de una práctica investigativa verdaderamente ética y responsable.
Análisis estadístico
Se empleó el paquete estadístico SPSS 15 para Windows del 2003. Las variables independientes seleccionadas para este estudio fueron: tiempo y temperatura y la variable dependiente: concentración de proteínas totales.
Se tuvo en cuenta que la concentración de las proteínas totales tiene una distribución normal, se diseñó un análisis paramétrico. Se aplicó el ANOVA simple y la prueba de Tukey, se compararon las medias. 3,20,21
Especie animal utilizada
La especie seleccionada para estos estudios fueron 20 bovinos adultos de la raza Cebú, con certificado de salud emitido por el Instituto de Medicina Veterinaria (IMV). El peso corporal promedio de los animales fue de como 340,9 kg, con una edad promedio de cinco años, donados por la Unidad de Obtención de Productos Biológicos pertenecientes al Centro de Inmunología y Productos Biológicos (CENIPBI).
Preparación del suero control con preservante
Se utilizó el persevante comercial etilenglicol (Koch-Light Laboratorios Ltd Cod.337.918.478080) en una concentración final en el suero del 15 %. Al suero descongelado y en reposo se le extrajo el 15 % del volumen total, el cual fue restituido por el preservante.
- Preparación de los lotes para el estudio de estabilidad
Con el pool de suero procesado se conformaron tres lotes, según las Normas del CECMED (Centro nacional de sanidad agropecuaria).18
Se realizó la dispensación del suero en viales de 5 mL limpios, secos, de color ámbar, bien tapados, esterilizados y etiquetados; este proceso se realizó bajo condiciones de esterilidad en un flujo laminar.8-10
Diseño del estudio de estabilidad
El estudio quedó diseñado para tres lotes por mes y tres determinaciones por lote, para un número total de muestra del estudio (N=63). 18
Las pruebas para demostrar estabilidad del producto se realizaron teniendo en cuenta el estudio a largo plazo o a tiempo real con una duración de 12 meses y una frecuencia de ensayo en los meses 0, 1, 2, 3, 6, 9 y 12. Las temperatura probadas fueron (4 ºC) refrigeración y (-20ºC) congelación. 18
Se evaluó la estabilidad del producto a través de la determinación de proteínas totales, para ello se utilizó el método Biuret 19 que tiene un intervalo de referencia 40-80 g/L. La concentración de la muestra se determinó a través de un cálculo matemático según los resultados analíticos de: absorbancia de la muestra, absorbancia y concentración de la solución de referencia albumina. Los valores de absorbancia fueron medidos en el espectrofotómetro de fabricación japonesa modelo ERMA AE-600 a una longitud de onda de 530 nm.
RESULTADOS
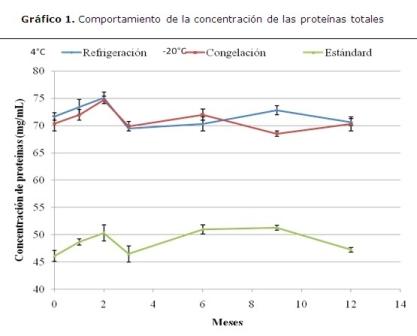
El comportamiento de la concentración de las proteínas totales para el producto obtenido y conservado refrigeración (4 ºC) y congelación (-20 ºC) durante 12 meses y el comportamiento del estándar internacional de la firma OLYMPUS. Se trabajaron tres lotes por mes, con tres determinaciones por lote (N=63). Se realizó un ANOVA simple p<0,05. El eje de las “y” mostró la concentración de proteínas totales que se expresa en mg/mL. El eje de las “x” muestra el tiempo en meses. (Gráfico 1)
Esta figura demuestra que existieron fluctuaciones en las concentraciones durante el tiempo y como se discute más adelante, no están asociadas a la estabilidad del producto ya que mantienen su comportamiento dentro del rango permisible, por lo que podemos asumir que el producto mantiene su estabilidad durante los estudios realizados.
Las medias de las concentraciones en las proteínas totales se distribuyen alrededor del valor medio, pero con una ligera tendencia a la disminución. Esto puede estar causado por el proceso de degradación de las proteínas que tiene lugar en dos etapas: la desnaturalización y la degradación, esta última implica la pérdida total de la actividad de la proteína. Existen factores desnaturalizantes de las proteínas como la urea, incremento de la temperatura, cambios de pH y fuerzas iónicas o de lo contrario que exista un error de tipo sistemático en los ensayos de laboratorio.3,21,22
Por tanto, una disminución en los valores de concentración podrán tenerse en cuenta en la estabilidad de las proteínas totales en un tiempo prolongado. Este parámetro puede ser usado como controlador en la química clínica para determinaciones en humanos pues los valores fluctúan en el rango entre (68, 5 – 75, 07) g/L, cifras que se corresponden con los valores de referencia en la especie bovina (67 – 75) g/L.23
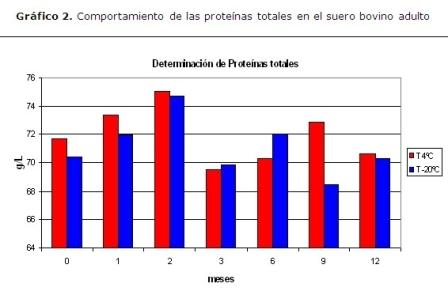
Por otra parte, se procedió a evaluar la estabilidad a tiempo real realizado en 12 meses, se representó comportamiento de las proteínas totales en el suero bovino adulto conservados en refrigeración (4 ºC) y congelación (-20 ºC). Se trabajaron tres lotes por mes, con tres determinaciones por lote (N=63). Se realizó un ANOVA simple p<0,05. El eje de las “y” muestra la concentración de proteínas totales que se expresa en g/L. El eje de las “x” muestra el tiempo en meses, no reveló diferencias significativas entre ambas temperaturas (p<0.05), se demostró que el almacenamiento tanto en condiciones de refrigeración como en condiciones de congelación no afectó la estabilidad de las proteínas totales en el suero; algunos autores plantean que la mayoría de los constituyentes, incluido las proteínas totales de los sueros estabilizados con Etilenglicol al 15 %, pueden preservarse tanto a –20 ºC como a 4 ºC indistintamente, e incluso son estables a temperaturas mayores (25 y 37 ºC) por cortos períodos de tiempo.10 (Gráfico 2)
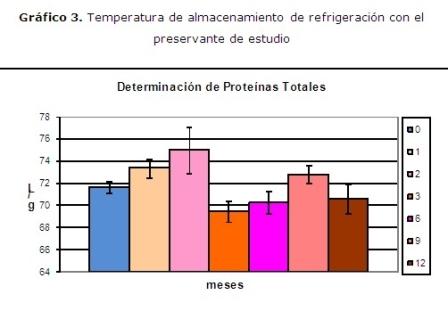
Un resultado interesante se observó cuando se evaluó el empleo del preservante en el suero control. Para eso se realizó un estudio en las diferentes temperaturas en estudio refrigeración (4 ºC) y congelación (-20 ºC).
El estudio de la variable tiempo a una temperatura de almacenamiento de refrigeración con el preservante de estudio (etilenglicol), no existió diferencias significativas en la concentración de proteínas totales entre los meses estudiados para una p=0.34. Se trabajaron tres lotes por mes con tres determinaciones por lote para N=9. Se realizó un ANOVA simple para p<0,05. (Gráfico 3)
DISCUSIÓN
La confiabilidad en la precisión y exactitud de los resultados que brinda el laboratorio clínico en los análisis de las muestras que en él se estudian, depende de un complejo sistema que engrana múltiples factores y estrategias. La implementación del sistema de aseguramiento de la calidad (SAC) incluye aspectos diversos y muy complejos que no son objetos de estudio en el presente trabajo. Sin embargo, pueden considerarse alternativas y decisiones con la finalidad de lograr tal objetivo, entre tanto se implemente el SAC, las cuales ayuden a la obtención de resultados confiables para clínicos y pacientes. Uno de estos aspectos es trabajar en la obtención de controles de referencia.
El objetivo del trabajo fue evaluar la estabilidad de un suero control para ser utilizado como controlador bioquímico en los laboratorios clínicos. Por este motivo, es importante brindar un controlador de referencia que presente condiciones químicas muy similares a las reportadas por la literatura, 10 donde tendrá lugar la reacción específica para cada uno de los instrumentos de medición, así como los procederes, influirán sobre la conmutabilidad del resultado. De esta forma los laboratorios clínicos tendrían valores estandarizados con un calibrador estable, a falta de estándares internacionales. 24
Este sistema de controles constituye un eslabón de una compleja estructura que asegura en parte, el proceso de calidad del método por ellos empleados. Es importante hacer énfasis en este aspecto, pues se observa en la práctica diaria, la variabilidad entre los ensayos de diferentes laboratorios, que en muchas ocasiones llega a ser superior al 25 % de forma tal que describe el nivel de desempeño alcanzado, en el área del laboratorio abarcado por el programa de evaluación externa de la calidad (EEC). Al utilizar correctamente los programas externos de la calidad se estimula el desarrollo de la garantía de calidad, el control interno de la calidad (CIC) dentro de los laboratorios participantes.25-26
Los programas de evaluación externa de la calidad (EEC) y el control interno de la calidad (CIC) serán vistos como componentes de una política general que incluye otros aspectos tales como duración del ciclo entre la toma de muestra y entrega del informe, errores groseros, el entrenamiento del personal del laboratorio, seguridad del personal y el uso apropiado del laboratorio por parte de los autores que incluye la interpretación de los datos. Los costos de la implementación de programas de calidad tienen que ser evaluados frente al desperdicio de recursos de trabajo; la EEC permite la comparación de la calidad entre los laboratorios de forma tal que describe el nivel de desempeño alcanzado, en el área del laboratorio abarcado por el programa de EEC. 17,25
En el año 2003 Westergard, et al, 26 expusieron lo siguiente: el principio del control interno de la calidad radica en que las variaciones observadas representan variaciones tales como: la variabilidad de un frasco a otro y la estabilidad de los lotes de materiales controladores reducen la capacidad de determinar errores.
Para que estos programas sean exitosos y provean datos objetivos e independientes y funcionen como un impulso educativo para mejorar, los participantes deben tener confianza en la validez científica del diseño del proyecto como también confianza en sus operaciones.
Existe una tendencia en el mundo a la preparación de los estándares de referencia de origen biológico para el caso de la enzima fosfatasa alcalina, se hace la extracción de la placenta humana, tiene esta enzima las mismas características que la fosfatasa alcalina que se encuentra en el suero del paciente para usar este como control.27-31
Para la elaboración de suero control líquido para química clínica existen varias vías: filtración, liofilización y estabilización por adición de sustancias químicas.
En el último caso es muy apropiado el etilenglicol como preservante aunque se estudiaron también el timerosal, borato, fluoruro, azida sódica y antimicrobianos; es recomendado como fuente de materia prima el suero bovino pero hay países que no lo pueden utilizar y entonces se recomienda el suero equino o porcino.10
Se plantea que aquellos sueros restituidos con etilenglicol al 15 %, presentan una estabilidad de todos los componentes al menos durante ocho meses, lo cual no se observa en las enzimas cuya estabilidad está reportada hasta cuatro meses.10
Con respecto al uso de preservantes para productos biológicos se encontraron reportes de la conservación de un hemolisado a partir de sangre bovina estabilizado con etilenglicol (EG), propilenglicol (PG) y sorbitol(S). También fue notificado el uso del propilenglicol al 15 % como reconstituyente para suero líquido estabilizado.32-34
En la literatura revisada no se encontraron estudios del efecto de los preservantes propilenglicol y etilenglicol, sobre la actividad de las enzimas transaminasas pirúvica (TGP), transaminasas oxalacética (TGO), fosfatasa alcalina (FA) y amilasa. Los resultados observados evidenciaron la incapacidad de estos productos de mantener la estabilidad de la actividad enzimática en el tiempo, al no diferir significativamente de las muestras carentes de ambos preservos. Un hemolisado humano que contiene etilenglicol almacenado a -20 ºC, mantuvo las concentraciones constantes de hemoglobina durante 372 días; en cambio, a 4 ºC la estabilidad del preparado solo fue por 15 días y descendió a dos días cuando se mantuvo a temperatura ambiente.34
CONCLUSIONES
El suero control obtuvo la estabilidad esperada al utilizar el etilenglicol como preservante, se logró el efecto protector esperado sobre la actividad del suero control. Por tal motivo, el suero control propuesto en el trabajo presentó una estabilidad de 12 meses, aspecto a tener en cuenta para su futura comercialización.
REFERENCIAS BIBLIOGRÁFICAS
1. Más Martín JC, Corral Almonte JF, Fernández Soto M, Vidal Vidal I, Araña FA, Zamora MJ, et al. Hematología. En: Más Martín JC, editor. Laboratorio Clínico. 2 ed. La Habana: Científico- Técnica; 1980. p. 414-83.
2. Hernández Betancourt O, Fernández Torres S, Vázquez Reyes N, Quesada Leyva L, Falcón Almeida Y, Torres Romo U. Estabilidad de un suero control multienzimático utilizado como material de referencia en los laboratorios clínicos. Rev Cubana Inv Bio. 2012 Feb;31(2):226-42.
3. Thielman K. Principios de Metodología de Bioquímica. La Habana: Organismos; 1973.
4. Sonnenwith A, Jarret L, Grandwohl M. Métodos y diagnósticos del Laboratorio Clínico. T 1. La Habana: Científico Técnica; 1983.
5. Frances F. A manual of laboratory and Diagnostic test. 4ta ed. Washington: JB Lippencott Company. Chemestry Studies; 1992.
6. Pascual C, Torres W. Control de Calidad Bioquímica Clínica. Ciudad de la Habana: Ciencias Médicas; 1989.
7. Guzel O, Guner EI. Requirements for quality and competence of medical laboratories, experience of a laboratory I. Clin Biochem [Internet]. 2009 Mar [citado 12 Abr 2014];42(4-5):[aprox. 5 p.]. Disponible en: http://preview.ncbi.nlm.nih.gov/pubmed/19863920
8. Handbook Standards. Control and Linearity Reagents. Ginebra: SIGMA Diagnostics; 1994.
9. Castillo de Sánchez ML, Fonseca-Yerena ME. Mejoría continúa de la calidad. Guía para los laboratorios de América Latina [Internet]. México DE: Editorial Médica Panamericana; 1995 [citado 12 Abr 2014]. Disponible en: http://redalyc.uaemex.mx/src/inicio/ArtPdfRed.jsp?iCve=57611572001
10. Browing DM, Hill PG, Vázquez DA, Rodríguez Olaz'abal DA V'azquez de; World Health Organization. Health Laboratory Technology Unit. Preparation of stabilized liquid quality control serum to be used in clinical chemistry. Geneva: World Health Organization; 1986.
11. Burtis CA, Ashwood ER. Textbook of clinical chemistry. Philadelphia: WB Saunders Company; 2002.
12. Meludle N. Olympus America Inc, two comparate center drive. Washington: America Inc; 2001.
13. Loeb WF, Quinby FW. The Chemical Chemistry of Laboratory Animals. Philadelphia: Pergamon Press; 1990.
14. Marijana M, imundic AM, tefanovic M, Ferenec DR, Kvaternik M, Topic E, et al. A model for results comparison on two different biochemistry analyzers in laboratory accredited according to the ISO 15189. Bio Med [Internet]. 2009 [citado 12 Abr 2014];19(3):[aprox. 6 p.]. Disponible en: http://dx.doi.org/10.11613/BM.2009.027
15. Hill P, Uldall A, Wilding P. Fundamento de la Evaluación Externa de Calidad. México: COLABIOCLI; 2000.
16. Badrick T. The Quality Control System. Clin Biochem Rev. 2008 Aug;29 Suppl 1:S67-70.
17. Guglielmone R, de Elías R, Kiener O, Collino C, Barzón S. Verificación de métodos en un laboratorio acreditado y planificación del control de calidad interno. Acta Bioquím Clín Latinoam [Internet]. 2011 [citado 12 Abr 2014];45(2):[aprox. 12 p.]. Disponible en: http://www.scielo.org.ar/pdf/abcl/v45n2/v45n2a12.pdf.
18. CECMED. Regulación No. 24-00. Requisitos de los estudios de estabilidad para el registro de nuevos ingredientes farmacéuticos activos. La Habana: CECMED; 2000.
19. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976 May 7;72:248-54.
20. Barón López FJ, Téllez Montiel F. Apuntes de bioestadísticas: Tercer ciclo en Ciencias de la Salud y Medicina [Internet]. Málaga: Universidad de Málaga; 2004 [citado 12 Abr 2014]. Disponible en: http://www.bioestadistica.uma.es/baron/apuntes/ficheros/cap01.pdf
21. Sigarroa A. Biometría y diseño experimental. La Habana: Pueblo y Educación; 1985.
22. Voet D, Voet JG. Biochemistry. 4th ed. New York: John Wiley & Sons; 2010.
23. Fraser CG, Petersen PH, Ricos C, Haeckel R. Proposed quality specifications for the imprecision and inaccuracy of analytical systems for clinical chemistry. Eur J Clin Chem Clin Biochem [Internet]. 1992 May [citado 12 Abr 2014];30(5):[aprox. 7 p.]. Disponible en: http://preview.ncbi.nlm.nih.gov/pubmed/?term=Proposed+quality+specifications+for+the+imprecision+and+inaccuracy+of+analytical+systems+ for+clinical+chemistry.
24. Schiele GF JM, Lessinger J. Henny Harmonisation des pratiques: application à la mesure d'activités enzymatiques utilisées en prévention, dépistage, diagnostic et surveillance thérapeutique. Anna Bio Clin. 2001;59(3):291-7.
25. Infusino I, Panteghini M. Panteghini M. Traceability in clinical enzymology. Clin Biochem Rev [Internet]. 2007 [citado 12 May 2014];28(4):[aprox. 6 p.]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2282404/pdf/cbr28_4p155.pdf
26. Westergard JO, Richterich R, Klinische C, Karger B. Clinical chemistry. New York: Academic Press; 2003.
27. Lessinger JSF, Vialle A, Férard G, Myara A, Guéchot J, Imbert-Bismut F, et al. Le calibrage en enzymologie clinique: principe, conditions d'application et resultants. Anna Bio Clin [Internet]. 2002 [citado 12 Abr 2014];60(3):[aprox. 6 p.]. Disponible en: http://www.jle.com/fr/revues/bio_rech/abc/e-docs/00/00/C4/95/article.phtml
28. Gulderen Y. ISO 15189 Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory II. Clin Biochem. 2009 Mar;42(4-5):279-83.
29. Goldstein D, Harris H. Expression of alkaline phosphatase loci in mammalian tissues. Proc Nat Acad Sci USA. 1980 May;77(5):2857–60.
30. Franzini C. Ethylene glycol-stabilized haemolysates as control material in haemoglobinometry. Clin Chim Acta. 1983 Dec 15;135(2):175-9.
31. Pazhang MKK, Ranjbar B, Hosseinkhani S. Effects of water-miscible solvents and polyhydroxy compounds on the structure and enzymatic activity of thermolysin. J Biotechnol. 2006 Dec 15;127(1):45-53.
32. Nascimento C, Lino PR, Ramos L, Almeida AJ, de Almeida IT, Leandro P. Polyol additives modulate the in vitro stability and activity of recombinant human phenylalanine hydroxylase. Appl Biochem Biotechnol. 2010 Sep;162(1):192-207.
33. Feng S. Effects of glycerol on the compaction and stability of the wild type and mutated rabbit muscle creatine kinase. Proteins. 2008;71(2):844-54.
34. Toussaint B, Emons H, Schimmel HG, Bossert-Reuther S, Canalias F, Ceriotti F, et al. Traceability of values for catalytic activity concentration of enzymes: a certified reference material for aspartate transaminase. Clin Chem Lab Med. 2010 Jun;48(6):795-803.
Recibido:19 de junio de 2014
Aprobado: 8 de julio de 2014
Yadira Falcón Almeida.Licenciada en Química. MSc. en Humanidades Médicas. Investigador Agregado. Departamento en Innovación y Evaluación de Tecnología. Universidad de Ciencias Médicas. Camagüey, Cuba. Email: yafalcon@finlay.cmw.sld.cu.