My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Archivo Médico de Camagüey
On-line version ISSN 1025-0255
AMC vol.19 no.2 Camagüey Mar.-Apr. 2015
ARTÍCULOS ORIGINALES
Ética en el diseño, conducción y monitoreo de ensayos clínicos con SURFACEN® en Cuba
Ethics in the design, conduction and monitoring of clinical trials with SURFACEN® in Cuba
Dra. Yisel Ávila Albuerne I; Dr. Yinet Barrese Pérez I; Dr. Andrés Armando Morilla Guzmán II; Dr. Valentín Santiago Rodríguez Moya III; Dra. Nora Lim Alonso IV; Dra. Elaine Díaz Casañas V
I Centro Nacional Coordinador de Ensayos Clínicos. La Habana, Cuba.
II Hospital Materno Infantil Dr. Ángel Arturo Aballí. La Habana, Cuba.
III Policlínico Docente Comunitario Ignacio Agramonte Loynaz. Camagüey, Cuba.
IV Hospital Clínico Quirúrgico Hermanos Ameijeiras. La Habana, Cuba.
V Centro Nacional de Sanidad Agropecuaria. Mayabeque, Cuba.
RESUMEN
Fundamento: el Centro Nacional Coordinador de Ensayos Clínicos, el Centro Nacional de Sanidad Agropecuaria y unidades de cuidados intensivos cubanas, ejecutaron ensayos clínicos con SURFACEN® para tratar el síndrome de dificultad respiratoria.
Objetivos:describir la actuación ética en el diseño, conducción y monitoreo de estos ensayos clínicos, así como determinar su validez interna y externa.
Métodos: se realizó un estudio prospectivo y descriptivo entre 2004 y 2014. Se diseñaron protocolos, cuadernos de recogida de datos, consentimiento informado; se planificaron sitios clínicos, recursos humanos y materiales; se capacitaron investigadores clínicos y se monitoreó la ejecución de ensayos clínicos fase II, III y IV, que evaluaron el efecto, la eficacia, efectividad y seguridad del SURFACEN® para tratar el síndrome de dificultad respiratoria en tres grupos poblacionales: neonatos, niños (entre 28 días y 18 años de edad) y adultos.
Resultados: participaron 41 unidades de cuidados intensivos (17 de neonatología, 7 de pediatría y 17 de adultos). Se evaluaron 1 413 pacientes y se incluyeron 306. Se capacitaron en Buenas Prácticas Clínicas 709 profesionales de la salud. Del monitoreo, revisión de la documentación y los procederes realizados, se evidenció el cumplimiento de las normas éticas para la investigación en humanos. La validez interna de los resultados se demostró con la objetividad de la observación, comparación recurrente y asignación aleatoria de tratamientos, planificación y ejecución conforme a las Guías de Buenas Prácticas Clínicas. La validez externa se evidenció en la modificación del registro sanitario del producto con la aprobación de tres nuevas indicaciones: en el síndrome de dificultad respiratoria aguda en pediatría y adultos, así como el uso temprano (primeras 2 horas de vida) en recién nacidos pre-términos.
Conclusiones: el diseño, la conducción y el monitoreo de ensayos clínicos con SURFACEN® cumplimentó los principios éticos básicos para la investigación clínica y garantizó la validez interna y externa de los resultados.
DeCS: SÍNDROME DE DIFICULTAD RESPIRATORIA DEL ADULTO; ENSAYO CLÍNICO FASE II; USOS TERAPÉUTICOS; ÉTICA; EPIDEMIOLOGÍA DESCRIPTIVA.
ABSTRACT
Background: the Coordinating National Center of Clinical Trial, the National Center of Agricultural Health and the Cuban intensive care units carried out clinical trials with SURFACEN® to treat respiratory distress syndrome.
Objective: to describe the ethical in the design, conduction and monitoring of these clinical trials, as well as determine its internal and external validity.
Methods: a descriptive, prospective study was conducted between 2004 and 2014. Protocols, data collecting notebooks and informed consent were designed; clinical sites, human and material resources were planned; clinical investigators were trained; also, the implementation of clinical trials stages II, III, and IV that evaluated the effect, effectiveness and security of SURFACEN® to treat respiratory distress syndrome in three population groups: newborn babies, infants, children (up to 18 years old) and adults, was monitored.
Results: forty-one intensive care units participated (17 of neonatology, 7 for pediatric patients and 17 for adults), 1 413 patients were evaluated and 306 were included and 709 health professionals were trained in Good Clinical Practice. The performance of the ethical norms for the investigation in human beings could be shown in the monitoring, the revision of the documentation and the carried-out procedures. The internal validity of the results could be shown through the objectivity of the observation, the recurrent comparison and the random assignment of treatments, and through the planning and performance according to the Guides of Good Clinical Practice. The external validity could be shown in the change of the legislation of the product with the approval of three new indications: for the acute respiratory distress syndrome in pediatric patients and adults and for preterm babies with an early use (two hours old).
Conclusions: the design, conduction and monitoring of clinical trials with SURFACEN® performed the basic ethical principles for the clinical investigation and guaranteed the internal and external validity of the results.
DeCS: RESPIRATORY DISTRESS SYNDROME, ADULT; CLINICAL TRIAL, PHASE II; THERAPEUTIC USES; ETHICS; EPIDEMIOLOGY, DESCRIPTIVE.
INTRODUCCIÓN
Los avances en distintas ramas científicas en el siglo XX favorecieron el surgimiento de un nuevo paradigma relacionado con la práctica médica. Este paradigma se basa en evidencias científicas y permite ofrecer servicios médicos de mayor calidad.
El ensayo clínico (EC) es considerado el pilar metodológico más importante sobre el que se sustenta la investigación clínica moderna, constituye un motor impulsor para la medicina basada en evidencias y es uno de los primeros niveles de evidencia científica.1 Es por ello que constituyen una etapa fundamental en el desarrollo clínico de los medicamentos.
Como parte del perfeccionamiento acelerado de la industria biotecnológica y farmacéutica en Cuba, el Centro Nacional de Sanidad Agropecuaria (CENSA) desarrolla y produce el surfactante pulmonar SURFACEN® para la terapia de reemplazo en condiciones de disfunción del sistema surfactante pulmonar, como el síndrome de dificultad respiratoria (SDR) en el recién nacido pretérmino (RNPT). 2, 3
En 1995 con la aprobación del registro sanitario (0800) de SURFACEN®, emitida por Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), se introdujo en la práctica medica habitual en todas las unidades de cuidados intensivas neonatales (UCIN) del país. Como parte del desarrollo clínico de este medicamento y en la búsqueda de evidencias científicas que permitieran extender su uso a otros grupos etarios, a partir del 2004 y hasta el 2014 el CENSA de conjunto con el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) y el Sistema Nacional de Salud Pública han llevado a cabo EC fase II, III y IV, para el tratamiento del Síndrome de Dificultad Respiratoria Aguda (SDRA).
El SDRA, descrito por Ashbaugh et al, 4 como fracaso respiratorio agudo con hipoxemia refractaria, infiltrados pulmonares difusos y membranas hialinas pulmonares similares a las del síndrome respiratorio del recién nacido, es una enfermedad frecuente en las unidades de cuidados intensivos (UCI) tanto de adultos como pediátricas. 5 La incidencia del SDRA en niños es del 1 % al 4 % de ingresos en las unidades de cuidados intensivos pediátricas (UCIP) y es menor que en adultos donde aproximadamente el 40 % de los pacientes requieren de ventilación mecánica y cerca del 14 % de ellos, sufren de falla respiratoria aguda hipoxémica. 6, 7 Aunque estas cifras no parecen alarmantes, la mortalidad es del 20-62 % en pediatría y de 29-42 % en adultos. 8 Generalmente la mortalidad se eleva, principalmente porque cursan con síndrome de disfunción orgánica múltiple (SDOM). 9, 10
Los objetivos de este trabajo fueron describir la actuación ética en el diseño, conducción y monitoreo de los ensayos clínicos realizados con SURFACEN®, y determinar su validez interna y externa.
MÉTODOS
Se realizó un estudio prospectivo y descriptivo desde el 2004 al 2014, que incluyó el diseño, planificación, ejecución y monitoreo de tres EC, multicéntricos nacionales.
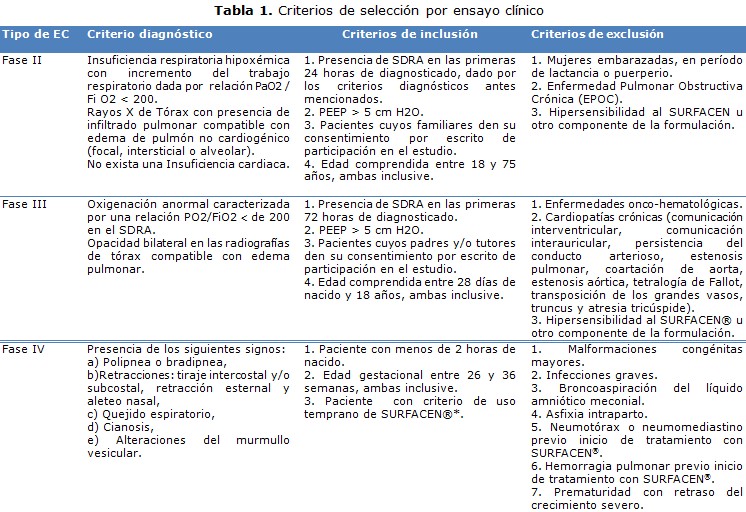
El procesamiento estadístico se realizó mediante el sistema automatizado de cómputo SAS para Windows, versión 9.1.3. El análisis estadístico se dividió en diferentes secciones. Implicó un análisis descriptivo del diseño de cada EC según la fase, incluso respecto a la consideración de tres de los pilares básicos: objetividad en la observación, comparación recurrente y asignación aleatoria de los tratamientos, de aspectos éticos, y de la estandarización de los criterios diagnósticos del SDR/SDRA; también con relación a la capacitación en Buenas Prácticas Clínicas (BPC) de investigadores y co-investigadores.Se realizó un análisis de inclusión (criterios de selección para describir los aspectos generales del reclutamiento de pacientes en el curso de cada EC (pacientes evaluados e incluidos); así como un un análisis exploratorio para estudiar el comportamiento de las variables de interés: relación de la presión parcial de oxígeno/ fracción inspirada de oxígeno (PaO2/FiO2), mortalidad, días de intubación endotraqueal, días de ventilación mecánica, días de estancia en la UCI, el cual involucró además un análisis descriptivo y de homogeneidad de los grupos de tratamiento en los EC fase II y III; así comoun análisis del efecto (fase II), la eficacia (fase III), la efectividad (fase IV) y la seguridad (tabla 1). 11, 12, 13
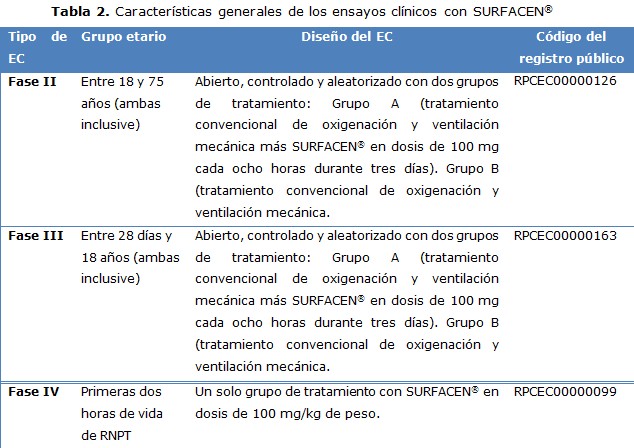
Se muestran las características generales de cada EC. El diseño de los protocolos de investigación y documentación complementaria de cada EC se realizó según establecen las directrices sobre BPC en Cuba, los principios éticos para las investigaciones médicas en seres humanos (Declaración de Helsinki) y enmendada por la 52a y 59ª Asamblea Médica Mundial de Edimburgo, Escocia, 2000 y Seúl, Corea, 2008, respectivamente (tabla 2). 11-15
Los Comités de Ética para la Investigación de los sitios clínicos que participaron en estos EC, aprobaron el protocolo del estudio en cada caso, las fechas en que fueron emitidas dichas actas están publicadas en el Registro Público Cubano de Ensayos Clínicos. Los EC fase II y III, se iniciaron cuando se obtuvo por escrito la autorización del CECMED y en el caso de fase IV se notificó a dicha autoridad regulatoria.
Para la inclusión de los pacientes en cada EC se les solicitó por escrito, a los representantes legales (padres o tutores) en caso de los niños y a los familiares de primera línea de consanguinidad en caso de los adultos, la firma del consentimiento informado de participación, luego de brindarle la información oral y escrita respecto a la investigación en presencia de un testigo. La información relacionada con la identificación de los pacientes se trató confidencialmente mediante un código de identificación y no por el nombre completo y no se publicarán datos que permitan la identificación de los mismos.
RESULTADOS
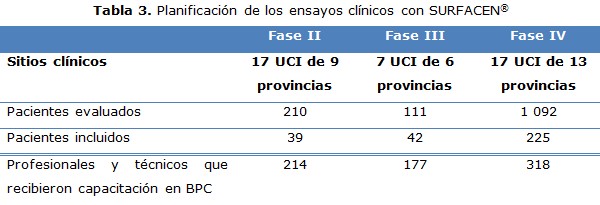
En cada EC se seleccionaron los sitios clínicos y los equipos de investigación en cada institución. Se constató en cada sitio clínico la disponibilidad de servicios (UCI, laboratorios clínicos para gasometría arterial, farmacia hospitalaria), equipamiento (ventiladores, gasómetros, equipo portátil para rayos X, refrigeradores), recursos materiales (SURFACEN®, reactivos, misceláneas, material gastable) y humanos (médicos y enfermeros especialistas en terapia intensiva, analistas y técnicos de laboratorio, técnicos de rayos X y farmacéuticos) que hicieron posible la ejecución de cada EC.
La capacitación en BPC a todos los involucrados se evidenció a través de:
- Los cursos-talleres nacionales de unificación de criterios, de actualización y finales de discusión de los resultados; así como reuniones de inicio y monitoreo sistemático en cada sitio clínico. Los programas científicos incluyeron la actualización en el conocimiento del SDR, su incidencia, tratamiento convencional y farmacológico, mortalidad, así como aspectos relacionados con el producto en estudio.
- Los procederes a cumplimentar para la inclusión y los relacionados para la aleatorización en el caso de los EC fase II y III.
- El completamiento y manejo de la documentación generada.
Se evolucionaron y revisaron un total de 306 historias clínicas como registro primario e igual número de cuadernos de recogida de datos (CRD) de todos los pacientes incluidos durante el periodo de estudio. Se completaron tres bases de datos (una para cada EC) que facilitaron el procesamiento y análisis estadístico de los resultados (tabla 3).
Se puso de manifiesto el cumplimiento de las BPC, con evidencias documentadas obtenidas durante el monitoreo, auditorias e inspecciones realizadas por el CENCEC, el centro promotor CENSA y el CECMED, respectivamente. Se verificó la existencia de todos los consentimientos informados de los pacientes incluidos, los que recibieron el cuidado médico habitual y ante la aparición de eventos adversos (EA) se tomaron las medidas correspondientes de acuerdo a la naturaleza e intensidad de los mismos. La información relacionada con dichos eventos se describió y registró en las historias clínicas y los CRD. En el caso particular de los EA graves/serios e inesperados independientemente de su relación de causalidad, se cumplimentó la notificación al CECMED en los períodos de tiempo previstos según lo descrito en cada protocolo de investigación.
Se exponen los elementos que demostraron la validez interna y externa de los EC con SURFACEN® (tabla 4). 11-13
DISCUSIÓN
El tamaño de la muestra en los EC fase II y III no fue elevado; sin embargo, sí fue suficiente para obtener resultados estadísticamente confiables, cumpliéndose la hipótesis formulada en cada protocolo de investigación. El hecho de que la incidencia del SDRA no sea elevada y que los criterios de selección en estos ensayos, principalmente en el EC fase II, fueron restrictivos contribuyó a este comportamiento. Es una estrategia del centro promotor continuar evaluando la seguridad y eficacia de SURFACEN® en la práctica habitual, e involucrar a mayor número de pacientes lo que confirmará los resultados obtenidos. En el EC fase IV, la muestra estuvo en correspondencia con la tendencia actual del incremento de la prematuridad. 16, 17
El trabajo desplegado a través de los EC con SURFACEN® ha desempeñado una función vital en el desarrollo de nuevas terapias para el tratamiento del SDRA, ya que constituyen la base de una investigación clínica reconocida. Dichos ensayos aseguraron el estricto cumplimiento ético, de acuerdo con tres principios básicos: respeto por las personas, beneficencia y justicia, lo que se demostró en todo el proceso con evidencias documentadas según establecen las BPC. 16-21
La validez de los resultados se manifiesta en el beneficio de la función pulmonar medido a través de la mejoría de la oxigenación. En el EC con adultos no se logra influir en la mortalidad; sin embargo, en pediatría y neonatología si hubo reducción significativa de la mortalidad, lo que se corresponde con lo que demostraron Wilson et al, 18 y Barreto et al, 22 respectivamente.
Los indicadores hospitalarios, tiempo de intubación endotraqueal, días de ventilación, estadía en la UCI tampoco se modifican, pero ese comportamiento era esperado según lo que reporta la literatura especializada. 18-21
El hecho de que el CECMED, después de evaluar toda la documentación generada en cada EC, aprobara la modificación del registro sanitario de SURFACEN® para ampliar las indicaciones terapéuticas de este medicamento, es la garantía de la seguridad y eficacia del producto, así mismo de la calidad y rigor científico de las investigaciones clínicas que dieron lugar a tal modificación. Estos resultados han despertado el interés de la comunidad científica y gobiernos de países en vías de desarrollo por introducir, en sus sistemas y programas de salud, al producto SURFACEN® y contribuir con ello al cumplimiento a los Objetivos de Desarrollo del Milenio (ODM), de los cuales, el cuarto consiste en reducir en dos terceras partes la mortalidad de los niños menores de 5 años, dentro de la cual, la mortalidad neonatal representa un 40 %. Por tal motivo, se han establecido estrategias por parte de los organismos y agencias internacionales para disminuir las muertes ocurridas en los menores de 28 días de edad. 23
CONCLUSIONES
Se demostró que en el diseño, conducción y monitoreo de los ensayos clínicos realizados con SURFACEN®, se cumplimentaron los principios éticos básicos para la investigación clínica y se garantizó la validez interna y externa de los resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Devereaux PJ, Manns BJ, Ghali WA, Quan H, Guyatt GH. The reporting of methodological factor in randomized controlled trial and the association with a journal policy to promote adherence to the Consolidated Standards of Reporting Trial (CONSORT). Control Clin Trials. 2012 Aug;23:380-8.
2. Manzanares Tapia D, Díaz Casañas E, Alfonso Lorenzo WC, Escobar Medina AC, Colomé Dagnesses H, Muñoz Pérez MC, et al. Centro Nacional de Sanidad Agropecuaria. Surfactante pulmonar natural de origen porcino. Patente de la República de Cuba A61K 35/42. 1997 Dic 24.
3. Moreno Vázquez O, Lee López M, Domínguez Dieppa F, Pascual López MA, Alonso Abad A, Jiménez Rivero G, et al. Estudio de la eficacia del Surfacén en el distress respiratorio del recién nacido. Rev Cubana Pediatr [Internet]. Jun 1999 [citado 14 Ene 2015];71(2):[aprox. 11 p.]. Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75311999000200002&lng=es
4. Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet. 1967 Aug;2(7511):319-23.
5. Murray JF, Matthay MA, Luce JM, Flick MR. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1989 Sep;139(4):1065.
6. Bellingan GJ. The pulmonary physician in critical care: The pathogenesis of ALI/ARDS. Thorax. 2002 Jun;57(6):540-6.
7. Manteiga Riestra E, Martínez González O, Frutos Vivar F. Epidemiología del daño pulmonar agudo y síndrome de distrés respiratorio agudo. Med. Intensiva. May 2006;30(4):151-161.
8. Ju-Ming J, Foong T, Testoni D, Guan J, Hui Y, Hau J. Epidemiology of pediatric acute respiratory distress syndrome in Singapore: risk factors and predictive respiratory indices of mortality. F Ped. 2014 Jul;2:1-6.
9. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994 Mar;149(3 Pt 1):818-24.
10. Dahlem P, Van Aalderen WM, Bos AP. Pediatric acute lung injury. Paediatr Respir Rev. 2007 Dec;8(4):348-62.
11. Hidalgo OA, Barrese Pérez Y, Díaz Casañas E, Uranga Piña R, Fernández Limia O, Avila Albuerne Y, et al. Informe final del ensayo clínico fase II Evaluación de la eficacia y la seguridad del SURFACEN en el tratamiento del Síndrome de Distress Respiratorio Agudo en el Adulto. La Habana, Cuba: MINSAP; May 2011.
12. Morilla Guzmán A, Barrese Pérez Y, Díaz Casañas E, Uranga Piña R, Avila Albuerne Y, et al. Informe final del ensayo clínico fase IV Evaluación de la efectividad y seguridad del uso temprano del SURFACEN en recién nacidos pretérminos con Síndrome de Distress Respiratorio. La Habana, Cuba: MINSAP; Nov 2013.
13. Rodríguez Moya VS, Barrese Pérez Y, Díaz Casañas E, Uranga Piña R, Avila Albuerne Y, Blanco Hidalgo O, et al. Informe final del ensayo clínico fase III Evaluación de la eficacia y la seguridad del SURFACEN en el tratamiento del Síndrome de Distress Respiratorio Agudo en edades pediátricas. La Habana, Cuba: MINSAP; Abr 2014.
14. Centro para el Control Estatal de los Medicamentos, Equipos y Dispositivos Médicos. Ministerio de Salud Pública de Cuba. Directrices sobre Buenas Prácticas Clínicas en Cuba. La Habana, Cuba: ECIMED; 2000 [citado 8 Ago 2014]. Disponible en: http://www.cecmed.cu/Pages/Reg_DispGen.htm
15. Asociación médica mundial. Declaración de Helsinki. Principios éticos para las investigaciones médicas en seres humanos [citado 8 Ago 2014]. Disponible en: http://www.wma.net
16. Morilla Guzmán AA, Tamayo Pérez VI, Carro Puig E, Fernández Braojos LS. Enfermedad de la membrana hialina en Cuba. Rev Cubana Pediatr [Internet]. Jun 2007 [citado 13 Ene 2015];79(2):[aprox. 12 p.]. Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312007000200008&lng=es
17. Ministerio de Salud Pública. Dirección Nacional de Estadísticas. Registro de morbilidad continúa. Servicios cerrados de Neonatología. 2008-2012. La Habana: Oficina Nacional de Estadísticas del MINSAP;2008-2012.
18. Willson DF, Thomas NJ, Markovitz BP, Bauman LA, DiCarlo JV, Pon S, et al. Effect of exogenous surfactant (calfactant) in pediatric acute lung injury: a randomized controlled trial. JAMA. 2005 Jan 26;293(4):470-476.
19. Raghavendran K, Willson D, Notter RH. Surfactant Therapy of ALI and ARDS. Crit Care Clin. 2011 Jul 1;27(3):525–59.
20. Tortorolo L, Chiaretti A, Pulitanò S, Genovese O, Conti G. Diluted porcine surfactant lung lavages in children with severe ARDS. Signa Vitae. 2009;4(2):16-9.
21. Guerin C, Debord S, Leray V, Delannoy B, Bayle F, Bourdin G. Efficacy and safety of recruitment maneuvers in acute respiratory distress syndrome. Annals of Intensive Care. 2011;1:9.
22. Barreto S, Bejarano L. Características epidemiológicas y sobrevida de RN de muy bajo peso al nacer tratados con ventilación mecánica. Rev Hosp Mat Inf Ramón Sardá [Internet]. 2010 [citado 12 Oct 2011];29(2):[aprox. 10 p.]. Disponible en: http://www.redalyc.org/articulo.oa?id=91213730002
23. Zahle Oestergaard M, Inoue M, Yoshida S, Retno Mahanani W, Gore FM, Cousens S, et al. Neonatal Mortality Levels for 193 Countries in 2009 with Trends since 1990: A Systematic Analysis of Progress, Projections, and Priorities. PLoS Med. 2011;8(8):23-34.
Recibido: 21 de enero de 2015
Aprobado: 4 de marzo de 2015
Dra. Yisel Ávila Albuerne. Centro Nacional Coordinador de Ensayos Clínicos. La Habana, Cuba.