Introducción
En una investigación, Gustavo Mora Ríos F et al. 1 expuso que los casos de tumores óseos se han documentado desde tiempos remotos, pero no es hasta principios del siglo XIX cuando existe un verdadero interés científico en ellos.
Todos los componentes del hueso provienen del mesodermo y por ello los tumores óseos pueden estar compuesto de cualquiera de los cuatro tipos de células originales, que son fibroblastos, condroblastos y osteoblasto (serie de células mesenquimatosas), y la serie reticulomielógena. 2 Tecualt Gómez R et al. 3 citan en su artículo, que desde el punto de vista clínico y morfológico, los tumores óseos se dividen en dos grandes grupos: malignos y benignos. Los benignos crecen autónomos, pero sus células no son atípicas, ni ellos se infiltran o metastizan. Los malignos son subdivididos en tumores de baja y de alta calidad. Los de baja calidad crecen despacio, metastizan en una etapa atrasada, cuando son de alta calidad crecen muy rápido, sus células muestran poca diferenciación y son muy polimorfas. Su crecimiento es invasor, destructor e infiltrante. La metástasis ocurre en una etapa temprana.
Sánchez Torres LJ et al. 4) describen que los tumores óseos tienen edades de presentación, localización e imágenes radiológicas características, hay ciertos tipos de tumores óseos que se caracterizan por ser más frecuentes en la población pediátrica, así como otros se caracterizan por ser más frecuente en la población esquelética madura y otros en la población de adultos mayores.
Rodríguez Rodríguez EI et al. (5 en su artículo refieren que, las series existentes de tumores óseos son analizadas según su frecuencia en la población en general, de acuerdo a las variedades histológicas, sin abordar en específico al grupo de edad pediátrica que es el afectado en su mayoría. (5 Los autores se propusieron realizar esta revisión, con el objetivo de profundizar en los conocimientos más esenciales de los tumores óseos en edad pediátrica.
Métodos
La búsqueda de la información se realizó en un periodo de cinco meses (primero de agosto de 2017 al 31 de diciembre de 2018) y se emplearon las siguientes palabras: bone neoplasms y child, a partir de la información obtenida se realizó una revisión bibliográfica de un total de 246 artículos publicados en las bases de datos PubMed (119), Hinary (67), Medline (53) y SciELO (7), mediante el gestor de búsqueda y administrador de referencias EndNote, de ellos se utilizaron 50 seleccionadas para realizar la revisión, 40 de ellas de los últimos cinco años, donde se incluyeron dos libros.
Desarrollo
En Estados Unidos se estima que en el 2014 se diagnosticaron alrededor de 3 000 casos de cáncer óseos de los cuales, alrededor del 55 % fueron de sexo masculino y 45 % femenino, de estos tumores corresponden, un 0,18 % del total de casos de cáncer diagnosticados en el mismo año. 6 Cuando se tienen en cuenta solo a niños y adolescentes el porcentaje puede subir a 4 y 7 %, respectivamente. (7
Entre los tumores óseos benignos en edad pediátrica el osteocondroma es el más frecuente, 8,9) el cual fue descrito por primera vez en el año 1818 por Astley Cooper, citado por Kumar M et al. 10 mientras que en los malignos los más frecuentes son el tumor de Ewing, 11,12) y el osteosarcoma o sarcoma osteogénico. 13,14
Rodríguez Rodríguez EI et al. 15 en su artículo refieren que el sarcoma de Ewing fue descrito por el norteamericano James Stephen Ewing. En 1920 publicó su primer trabajo sobre un nuevo tipo de osteoma maligno, que denominó primero como mieloma endotelial y que después alcanzaría el nombre de sarcoma de Ewing.
Para el diagnóstico de los tumores es necesario interrelacionar el cuadro clínico junto con los complementarios imagenológicos, anatomía patológica y suplementando con investigaciones bioquímicas y hematológicas.
Se debe realizar una adecuada exploración clínica para saber las condiciones que se encuentra el paciente, es importante conocer el motivo de consulta pues ello a veces nos puede llevar a un diagnóstico, por ejemplo, el dolor nocturno que se alivia con la aspirina puede hacer pensar en el osteoma osteoide, 16 el niño que estaba jugando pelota y al lanzar siente dolor en el brazo con aumento de volumen e impotencia funcional, se puede pensar en un quiste óseo solitario o esencial. 17 En la palpación, un paciente con múltiples tumores duros no movibles y antecedentes familiares con el mismo cuadro clínico, puede ser una exostosis múltiple hereditaria (Figura 1). (18
La edad es el factor más importante para hacer un diagnóstico diferencial cuando un radiólogo se enfrenta a una lesión ósea. 19) Los tumores óseos pueden aparecer a cualquier edad pero cada tipo histológico tiene una franja de edad de presentación característica, por ejemplo el quiste óseo solitario o esencial aparece entre los 10 a 15 años, 20 el Ewing entre ocho y 16 años, 12 el osteosarcoma de 10 a 25 años. (14 Los tumores típicos de la edad pediátrica no son exclusivos de la misma, sino que la mayoría suelen darse en adultos jóvenes también.
La radiografía es la mejor: modalidad de elección en el estudio de tumores óseos. Esta técnica permite generar la densidad de todos los puntos de una lesión en una imagen de dos dimensiones. (21) Los aspectos a evaluar al abordar una radiografía cuando se analiza una lesión ósea incluyen: localización, márgenes, reacción perióstica, tamaño, mineralización y compromiso de tejidos blandos. (22
Localización
Al evaluar una lesión ósea se deben tener en cuenta la localización de la lesión en el esqueleto y la ubicación específica de la lesión en el hueso afectado. Si se trata de una lesión central, excéntrica o yuxtacortical y si es una lesión única o múltiple La consideración de estos factores ayudará a reducir los diagnósticos diferenciales. (22
Características del borde
La evaluación de los márgenes de la lesión es crucial para determinar si ésta es de crecimiento lento (posible benigno) o de crecimiento rápido (agresivo). Las lesiones de crecimiento lento tienen un borde esclerótico bien definido; mientras las lesiones agresivas o malignas tienen bordes muy mal definidos e irregulares, con mínimo o sin esclerosis reactiva. (22
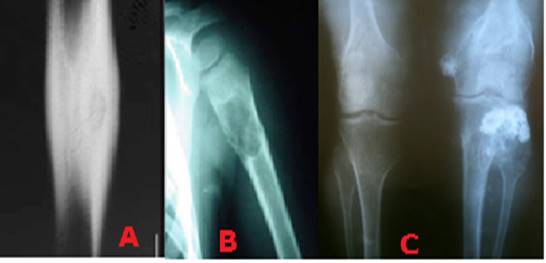
Las lesiones óseas menos agresivas son la tipo I o geográficas de forma ovoide y a su vez, se dividen en tres subtipos según las características de sus bordes: A. Bordes nítidos con anillo esclerótico. B. Bordes nítidos sin anillo. Lesión lítica de bordes mal definidos. Las lesiones tipo IA son las menos agresivas, las IB, son de naturaleza indeterminada y las IC, las de mayor agresividad. Las lesiones tipo II y III son lesiones no geográficas y de bordes mal definidos (Figura 2).
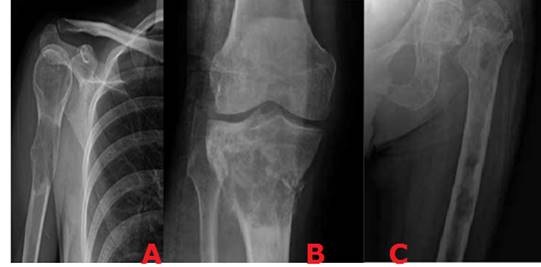
Figura 2. Lesión geográfica o tipo 1: A) Lesión lítica de bordes nítidos con anillo esclerótico B) Lesiones múltiples líticas de bordes nítidos donde no se observa anillo esclerótico C) Lesión líticade bordes mal definidos.
Las lesiones óseas tipo II se describen como lesiones apolilladas y se componen de múltiples focos osteolíticos que varían en forma y tamaño. Las lesiones óseas tipo III son las más agresivas y se describen como lesiones permeativas, múltiples y de carácter lítico, por lo general, sin áreas de respeto entre las mismas (Figura 3). (22

Figura. 3. Lesión no geográfica: A) Lesión apolillada de la tibia tipo II.B) Lesión lítica del húmero mal definida de aspecto permeativo tipo III.
Reacción perióstica
Representa el extenso compromiso de la región cortical por el tumor o su anillo reactivo. La reacción perióstica puede ser positiva en donde el periostio se eleva por formación de nuevo hueso o puede ser negativa, cuando existe reabsorción del hueso como en el caso en la reabsorción subperióstica, en el hiperparatiroidismo. Existen varios tipos de reacción perióstica que incluyen: sólida o unilaminada, multilaminada o en cebolla, en sol naciente y el triángulo de Codman. La interrupción del periostio en las formas multi o unilaminadas sugieren procesos agresivos que rompen el periostio (Figura 4). 22

Figura 4. A) Reacción sólida o unilaminada B) en capas de cebolla C) en rayos de sol D) triángulo de Codman.
Tamaño y número
Las lesiones múltiples por lo general indican enfermedad metástasica, muy pocas veces debido a una lesión primaria maligna como osteosarcoma o sarcoma de Ewing presentan enfermedad multifocal. Las lesiones benignas por otro lado tienden a afectar múltiples sitios, como lo hace los osteocondromas múltiples. Algunas lesiones solitarias de los huesos tubulares muestran una propensión marcada a desarrollarse en localizaciones específicas, como las epífisis, metáfisis y diáfisis. (22)
Tipo de matriz tumoral
Mineralización: el término matriz se refiere al tipo de tejido del tumor (osteoide, condral, fibroso, adiposo) y mineralización, a la calcificación de la matriz. Este concepto de mineralización de la matriz es importante, ya que este patrón puede ser útil en el diagnóstico. Diferentes tejidos presentan un patrón determinado al mineralizarse lo cual depende de su componente cartilaginoso, óseo o fibroso, entre otros. (22
Compromiso de tejidos blandos
Por lo general los tumores benignos no exhiben extensión de tejido blando, por lo cual una masa de tejido blando nos sugiere lesión agresivamaligna. Las tres más comunes con componente de tejidos blandos son osteosarcoma, sarcoma de Ewing y linfoma. (20 Ciertas enfermedades no neoplásicas como la osteomielitis pueden afectar tejido blando. La ausencia de una masa evidente de tejidos blandos en la radiografía convencional no sugiere benignidad, dada la limitada capacidad de esta modalidad para detectar lesiones de tejidos blandos. Si hay evidencia radiográfica de una lesión agresiva de hueso o disrupción cortical se sugiere correlacionar el hallazgo con imagen de resonancia magnética. 22
Otros estudios de tipo imagenológicos son importantes para el diagnóstico positivo y diferencial de los tumores óseos, entre estos exámenes se encuentran: tomografía axial computarizada, gammagrafía, tomografía por emisión de positrones y angiografía.
Tomografía axial computarizada
La importancia de este estudio radica en la identificación de ruptura de la cortical y la consecuente invasión a las estructuras blandas circundantes. Permite conocer las densidades intralesionales del tumor, además de proporcionar orientación topográfica importante para la planeación tanto de la biopsia como del tratamiento definitivo. (23
Imagen de resonancia
Representa el mejor estudio para valorar la extensión focal y estadiaje local de una lesión. Por su excelente resolución de contraste y capacidad multiplanar, permite evaluar la extensión intra y extracompartimental de la neoplasia, hacia tejido muscular y graso, hacia estructuras neurovasculares y el grado de afección de la médula ósea, lo cual es de suma importancia para determinar la existencia de metástasis o establecer el límite quirúrgico de la neoplasia a resecar. (24
A todo paciente con sospecha de un tumor óseo primario maligno debe realizársele una resonancia magnética para poder evaluarla totalidad del hueso afectado.
Gammagrafía
Es un método de diagnóstico no específico pero muy sensible en la identificación de lesiones esqueléticas; mientras la radiografía convencional puede requerir hasta 50 % de pérdida de la mineralización ósea para poder detectar lesiones, la gammagrafía ósea es un excelente medio para detectarlas, cuando aún no pueden ser detectadas en la radiografía convencional. (25)
Tomografía por emisión de positrones
La tomografía por emisión de positrones, usa el análogo de la glucosa 18Ffluordesoxi-glucosa (18F-FDG PET/TC), ha ganado amplia aplicación en el diagnóstico, estadificación y seguimiento de pacientes con cáncer y ha demostrado ser una herramienta eficaz para el diagnóstico más preciso que los métodos convencionales. (26
Angiografía
La angiografía, que antes se usaba para determinar las relaciones de las neoplasias con los vasos sanguíneos, ha sido sustituida por la imagen de resonancia magnética, sin embargo, es útil para descartar el origen no neoplásico, como los seudoaneurismas o las malformaciones arteriovenosas y para la embolización preoperatoria de lesiones muy vascularizadas como el quiste óseo aneurismático. (24
Estudios de laboratorio
Con fines preoperatorios es necesario conocer parámetros hemáticos simples como la fórmula roja, la blanca y los elementos que intervienen en la coagulación. En el diagnóstico de las lesiones primarias malignas de hueso, los estudios de laboratorio son de poca ayuda hasta ahora; la fosfatasa alcalina se puede encontrar elevada en neoplasias que producen osteoide, pueden acompañarse de anemia y una velocidad de sedimentación globular elevada. 27
Elevación del calcio sérico, así como de la fosfatasa alcalina o la fosfatasa ácida, son sugestivos de malignidad. Hay que recordar que la fosfatasa alcalina se encuentra por lo regular elevada en los niños, por lo que se debe examinar si una elevación es fisiológica o patológica. La elevación de deshidrogenasa láctica en pacientes con sarcoma de Ewing se asocia a mal pronóstico. (4
Biopsia
La biopsia es un paso clave en el diagnóstico de los tumores óseos y de partes blandas. Una biopsia realizada a destiempo puede disminuir las posibilidades de llegar a un diagnóstico adecuado, tiene un impacto negativo en la sobrevida de los pacientes, así como requerir de una amputación para lograr márgenes de resección adecuados. Las biopsias pueden ser abiertas o cerradas. Las técnicas abiertas se llevan a cabo mediante incisiones quirúrgicas, mientras que las cerradas, también llamadas percutáneas, son realizadas mediante agujas finas y gruesas. (28
Inmunohistoquímico
Es un procedimiento especial de coloración con tinta que se realiza para esclarecer la histogénesis en neoplasias indiferenciadas y en tumores de células pequeñas y azules. Las neoplasias óseas en este grupo en pediatría son: sarcoma de Ewing, tumor neuroectodérmico primitivo periférico, osteosarcoma de células pequeñas, leucemia, linfoma, condrosarcoma mesenquimal y rabdomiosarcoma. 29
Microscopia electrónica de transmisión
Es un estudio útil, complementario a la inmunohistoquímica en el diagnóstico de cierto tipo de tumores no osteosarcoma y como alternativa en tumores de células
pequeñas y redondas en los que la inmunohistoquímica no ha sido convincente. También es útil en neoplasias de células fusiformes, neoplasias vasculares y tumores metastásicos que no son frecuentes en niños. (29
Marcador tumoral
El marcador tumoral, también denominado marcador biológico o biomarcador, se define como una molécula, una sustancia o un proceso que se altera cualitativa o cuantitativo como resultado de una condición precancerosa o un cáncer, detectable mediante una prueba de laboratorio en sangre, en líquidos orgánicos o en tejidos. (30
La primera referencia histórica a un marcador tumoral es referida al descubrimiento por Bence Jones en 1846 de un precipitado de la orina en pacientes afectados de lo que antes se denominaba mellitis osseum (osteomalacia), y que hoy se conoce como proteínas de Bence Jones la historia de los marcadores tumorales arranca en la segunda mitad del siglo XX; hay que tener en cuenta que diversas sustancias que luego se utilizaron como marcador tumoral han sido descubiertas hace poco tiempo.
Los marcadores tumorales son en muy pocas ocasiones diagnósticos y no pueden reemplazar a la biopsia para establecer un diagnóstico de cáncer. Un resultado elevado de un marcador tumoral no indica necesariamente un determinado cáncer, pero proporciona algún dato sobre su posibilidad. Los resultados dentro de límites normales no excluyen malignidad o progresión. El uso principal de los marcador tumoral existentes está en la vigilancia postoperatoria y en la monitorización tras la quimioterapia, terapia hormonal o radioterapia. (31
Tratamiento general
La terapéutica de los tumores óseos en la actualidad es multidisciplinaria y está constituida por ortopédicos, rehabilitadores, radiólogos, oncólogos patólogos y radioterapeutas. Los tumores benignos se pueden tratar por métodos conservadores y quirúrgicos. En el tratamiento conservador se tiene al defecto fibroso cortical el cual cura espontáneo con el crecimiento ya que no se observa en la edad adulta, el quiste óseo esencial aunque se ha tenido tendencia al tratamiento quirúrgico mediante curetaje de la cavidad y relleno con hueso esponjoso, el índice de recidiva es alto por no extirpar toda la membrana del interior del quiste, en la actualidad la inyección de metilprednisolona (3 mg / cm3 de volumen quístico, se hace tres veces, separadas por un mínimo de cuatro meses) en su interior es un método seguro. 32 El quiste óseo aneurismático, el tratamiento es quirúrgico con curetaje óseo y relleno con hueso esponjoso si no es agresivo o se realiza resección en bloque si tiene agresividad, 33 también se hace resección en bloque al osteoma osteoide y el osteoblastoma, en el osteocondroma solitario solo se extirpa si molesta, se fractura su base o si hay sospecha de malignización. Ante todo osteocondroma que crezca o duela después de finalizar la maduración esquelética debe sospecharse una transformación maligna. Los hallazgos radiológicos que la sugieren son la irregularidad del contorno óseo, áreas focales radiolúcida dentro de la lesión, erosión o destrucción del hueso adyacente y una tumoración de partes blandas, con frecuencia de manera pacial calcificada. 34
En la osteocondromatosis múltiple, la posibilidad de malignización es del 0,5-5 % Los criterios radiológicos de transformación maligna son, el aumento de tamaño del osteocondroma, el aumento de grosor del recubrimiento cartilaginoso por encima de 2cm, la irregularidad de la superficie ósea, una masa de partes blandas de densidad y señal propias del cartílago tumoral y calcificaciones fuera de los límites esperados del tumor. 34
Los tumores primitivos malignos del hueso son poco frecuentes y en general de evolución muy rápida, los más habituales son el sarcoma de Ewing y el osteosarcoma, 35 en su tratamiento se combina la quimioterapia pre y post operatoria, la radioterapia y cirugía conservadora y posterior cirugía radical). (36
Conclusiones
Para el diagnóstico de los tumores óseos es imprescindible una adecuada correlación entre los hallazgos clínicos, imagenológicos e histológicos, ya que cada especialista al hacerlo individual puede errar el diagnóstico y en consecuencia el tratamiento. Los tumores óseos benignos son los de mayor incidencia que los malignos, entre los benignos al osteocondroma es el más frecuente y en los malignos el sarcoma de Ewing y el sarcoma osteogénico.