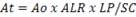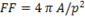Introducción
El cáncer constituye un problema social que aumenta de manera considerable, se ha mantenido como primera y segunda causa de muerte en Cuba según grupo de edades, de 15 a 65 años pertenecen al grupo de la primera causa y más de 65 años es superada por las enfermedades cardiovasculares.
El cáncer de piel engloba a un conjunto de enfermedades neoplásicas como: el carcinoma basocelular, el carcinoma de células escamosas y el tipo más grave el melanoma maligno. (1
El melanoma es una neoplasia maligna, puede presentarse en cualquier tejido al cual hayan migrado células derivadas de la cresta neural (aparato uveal del ojo, mucosa del sistema gastrointestinal, genitourinario y otros).
La primera descripción de melanoma se atribuye a René Laënnac quien, en 1806 en la Facultad de Medicina de París, discutió la melanosis (del griego melas-negro) como una enfermedad de difícil tratamiento por su agresividad y elevada mortalidad. (2) En la actualidad, la incidencia de esta lesión ha ido en aumento, se estima que es de un tres a 7 % por año, pero varía en las diferentes poblaciones mundiales que llega a un 10 %. (3
En Cuba, en el 2019 según el anuario estadístico causaron 491 defunciones por algún tipo de cáncer de piel, de ellos 305 del sexo masculino para una tasa de 5,5 y 186 del sexo femenino para una tasa de 3,3 las edades más afectadas en el sexo masculino fueron de 60-79 años y en el sexo femenino se comportó de 80 y más para una tasa de 4,2 por 100 000 habitantes. 4
En la provincia Holguín en el quinquenio 1980-1984 se reportaron 20 casos para una incidencia de 0,41 x 100 000 habitantes. En el primer quinquenio de la década del 90 continuó el incremento de pacientes con un total de 43 nuevos casos, lo que representó una tasa de 0,84 x 100 000 habitantes. 5
Entre los factores de riesgos para la aparición del melanoma maligno están: la exposición a los llamados rayos ultravioletas procedentes de la luz solar, el envejecimiento de la piel, antecedentes de haber padecido algún tipo melanoma u otro tumor cutáneo, así como la propensión genética hereditaria. 6,7,8
La piel recubre la superficie del cuerpo, es uno de los mayores órganos, alcanza el 16 % del peso corporal y está constituida por los cuatro tejidos básicos, se organizan en las capas: epidermis, dermis e hipodermis, esta última considerada por algunos autores. Está compuesta por diversos elementos complejos y variables que se encuentran en incesante renovación y transformación. De manera singular, esto puede apreciarse en las células lábiles de la epidermis, en constante división y expuestas al contacto directo con muchos agentes carcinogénicos ambientales e influencias del medio interno que pueden dar lugar a la formación de lesiones tumorales, neoplasias benignas o malignas u originar cáncer. (8,9
La morfometría y la estereología técnicas poco costosas, permiten obtener indicadores cuantitativos de los componentes celulares y tisulares, su uso rebasa los límites de la experimentación para adentrarse en el campo diagnóstico con posibilidades pronósticas, sobre todo en las enfermedades tumorales, 10) entre esos estudios se encuentran los realizados en el carcinoma ductal invasivo de mama que han permitido establecer un sistema de gradación o estadiamiento de dicha enfermedad a partir de indicadores como el pleomorfismo nuclear y la actividad mitótica lo que permite la clasificación de los pacientes de acuerdo al pronóstico en favorable, intermedio y desfavorable. 11,12) Otros tumores estudiados en la actualidad a través de la morfometría son los tumores cerebrales, 13) el carcinoma papilar de tiroides, 14) entre otros.
Son múltiples los indicadores morfométricos que pueden emplearse en el estudio de los diferentes tipos de melanoma, entre estos se destacan mediciones nucleares: área, perímetro, volumen, factor de forma entre otros, 15,16,17) sin embargo, son escasos los estudios en los que se describen trabajos realizados con aplicación de estos métodos, de igual manera la valoración que se hace de los diferentes indicadores estudiados en las distintas investigaciones no facilita el análisis cualitativo a partir de indicadores cuantitativo.
Según los antecedentes referidos y al tener en cuenta que el melanoma maligno es un tumor con una gran capacidad de invasión y de difícil tratamiento por su elevada agresividad y mortalidad, se hacen necesarios los estudios morfométricos y estereológicos por el valor que aportan en el diagnóstico histológico para mejorar el pronóstico de la enfermedad, la que se conoce en estadios tempranos, es curable.
Métodos
Se realizó un estudio de serie de caso en un universo de 12 pacientes con diagnóstico de melanoma maligno de piel atendidos en la consulta de piel del Centro Oncológico del Hospital Universitario Vladimir Ilich Lenin y Hospital Clínico Quirúrgico Universitario Lucía Iñiguez Landín de la provincia Holguín desde septiembre de 2015 hasta septiembre de 2017, a los cuales se les aplicó el criterio de inclusión: que presentaran un diagnóstico positivo de melanoma maligno de piel a partir de parámetro de calidad de las láminas. El tipo de muestreo fue intencionado en la selección de las biopsias escisionales con diagnóstico confirmado de melanoma maligno de piel en 12 pacientes.
Entre los métodos teóricos se emplearon: la revisión documental, histórico-lógico, análisis-síntesis, inducción-deducción.
Del nivel empírico: la observación y la morfometría que permitió realizar las determinaciones de los indicadores objeto de estudio a partir de imágenes digitalizadas de piel de pacientes portadores de melanoma maligno.
Los indicadores morfométricos estudiados fueron:
Para obtener la muestra se coordinó con los servicios de Anatomía Patológica de los hospitales antes mencionados y se procesó por la técnica clásica de la parafina. Se recepcionaron de estas instituciones de salud los bloques de tejido para su corte, coloración y montaje según los patrones de calidad en los laboratorios de la Universidad de Ciencias Médicas de la provincia Holguín.
Por cada paciente con diagnóstico positivo de melanoma maligno de piel se seleccionó un bloque de tejido, según elementos que respondieran a calidad del proceso de inclusión donde se obtuvieron un total de 12 bloques. De cada uno de ellos se realizaron cinco láminas portaobjeto lo que representó cinco por pacientes para un total de 60 láminas a estudiar.
Los cortes fueron de 10 micrómetros de espesor con un micrótomo vertical HistoLine modelo MR 3 000. Se obtuvieron de forma seriada de manera consecutiva en número de tres por lámina tomadas de regiones diferentes, para lo cual se desechaban cinco cortes entre cada grupo a escoger de forma periódica, que permitió muestrear el tejido en toda su profundidad. Las muestras obtenidas se tiñeron con hematoxilina y eosina. Se establecieron los criterios de calidad de las muestras a partir del principio de la correcta diferenciación de los núcleos en los cortes teñidos y la ausencia de artefactos.
Las imágenes se capturaron con una cámara de video digital Moticam de tres megapíxeles acoplada al microscopio triocular Motic modelo BA-210 con la aplicación digital Motic Image Plus Versión tres de la compañía China Motic S.A. y conectada a una computadora Dell, modelo Optiplex 7 010 de la compañía Dell mediante cable USB.
Para la lectura se procedió a la selección y captura de cinco campos entre los tres cortes de cada lámina para lo cual se desplazó de manera uniforme la platina en un número de dos veces y se digitalizó la imagen que coincidiera con el lente objetivo para un total de 300 campos que cumplieran los requisitos de suficiente tejido, no existencia de artefactos en la preparación que impidieran su observación o interfirieran en sus características. Los aumentos objetivos empleados fueron de 40x y 100x.
Para la realización de las mediciones de los indicadores morfométricos se empleó la aplicación ImageJ, versión 1,49 p del National Institutes of Health, USA, 2015 (Figura 1).
Se procedió a calibrar para cada aumento objetivo con un portaobjeto de calibración milimetrado múltiple de la Motic.
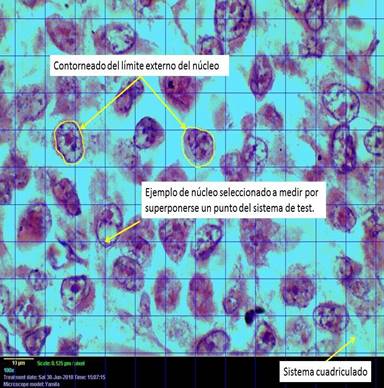
El aumento total (At) de observación de las imágenes capturadas en la computadora se calculó por (Fórmula 1):
Donde:
At: |
Aumento total. |
Ao: |
Aumento objetivo. |
ALR: |
Aumento del lente reductor (0,5). |
LP: |
Largo de pantalla (340 mm). |
SC: |
Sensor de la cámara digital (8mm). |
De esta manera el aumento total con el que se trabajaron las imágenes histológicas fueron de:
Para cumplir el principio esencial de la morfometría la aleatoriedad de las mediciones, se utiliza la opción Grid del submenú Plugins de la aplicación ImageJ que permite superponer sobre la imagen que se estudia un conjunto de herramientas, como un cuadriculado, una malla de puntos, un sistema de líneas paralelas entre otras.
En el estudio se utilizó el cuadriculado, para medir solo aquellos núcleos sobre los que coincidieron puntos de intersección de las líneas de la cuadrícula. El área de cada cuadrado fue de 50 micrómetros cuadrados. Se determinaron indicadores morfométricos como: área nuclear, volumen nuclear, factor de forma nuclear en cada uno de los núcleos que coincidían con la intersección de la cuadrícula (Figura 2).
Procedimiento según indicadores morfométricos:
Área nuclear:
Se obtuvo con la opción de contorneado del borde externo admisible de los núcleos de las células a manos libres del sistema ImageJ. Se midieron 19 456 núcleos.
Volumen nuclear:
Se obtuvo con la opción Fit Elipse, se contorneo el borde externo admisible de los núcleos de las células a manos libres del sistema ImageJ. El sistema devuelve el diámetro mayor y el diámetro menor de forma automática. Estos valores permiten el cálculo del volumen nuclear de las células epiteliales. Se pasaron los datos de los diámetros mayor y menor a una hoja de cálculo de Microsoft Excel y se aplicó la fórmula de Palkovits (Fórmula 2):
Factor de forma nuclear:
Se obtuvo con la opción Shape Descriptor. Se contorneo el borde externo admisible de los núcleos de las células a manos libres del sistema ImageJ, el sistema devuelve el valor de la circularidad o factor de forma, para lo cual utiliza los indicadores de perímetro y área calculados de forma automática por la aplicación.
La fórmula que emplea ImageJ para determinar el factor de forma es (Fórmula 3):
Procesamiento estadístico:
Para el procesamiento de los datos se utilizó la estadística descriptiva. Se determinaron estadígrafos descriptivos como media, desviación estándar, coeficiente de variación e intervalo de confianza para una p ≤ 0,05. El editor estadístico utilizado fue el MyStat versión 12 del 2015 de la compañía SyStat.
En todas las series de datos se realizó la prueba de normalidad de Shapiro-Wilk con vistas a determinar que los datos obtenidos provienen de una población que cumple los parámetros de la distribución normal.
Se realizó la triangulación de la información documental revisada, los datos primarios recopilados y utilización de métodos adecuados de procesamiento estadístico permitió arribar a conclusiones. Los resultados se muestran en figuras y tablas.
Aspectos éticos:
Se tuvo en cuenta los Principios Éticos para la Investigación Médica con datos provenientes de seres humanos de la World Medical Association Declaration of Helsinki y la Guía de OMS para los Comité de Ética de las Investigaciones, establecida por el Council for International Organizations of Medical Sciences (CIOMS) en el 2002.
Resultados
En la tabla, se describen los indicadores morfométricos de área nuclear y el volumen nuclear, los que se comportan de la siguiente manera, el área nuclear presenta una media aritmética de 27,56 (µm2) y el volumen nuclear su media aritmética es de 692,89 (µm3) (Tabla 1).
Tabla1 Comportamiento del área nuclear (µm2) y volumen nuclear (µm3) en el melanoma maligno de piel
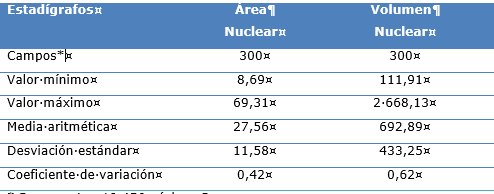
* Representan 19 456 núcleos.
El comportamiento del indicador factor de forma nuclear, muestra un valor promedio de 0,798 (Tabla 2).
Discusión
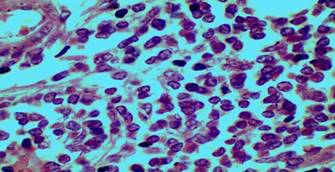
Los resultados de los indicadores morfométricos de área nuclear y el volumen nuclear demuestran que los núcleos en el melanoma maligno de piel son pequeños (Figura 3).
Si se comparan con otros estudios realizados en la provincia Holguín como el de Sánchez Pérez E, 18) donde los núcleos de piel sana envejecida tuvieron un volumen nuclear del estrato basal de la epidermis 880,09 µm3, es el estrato que menos se ha modificado a pesar de ser piel envejecida por eso se toma de referencia, en este se inicia el proceso de diferenciación de los queratinocitos y las dimensiones celulares con relación al estrato basal son menores.
El área nuclear y el volumen nuclear media de las células del melanoma maligno, son válidas para detectar malignidad en las lesiones tumorales. Estos resultados apuntan hacia la idea de estudiar de forma significativa dichos indicadores válidos para el diagnóstico del melanoma maligno. Se discute también por otros autores la correlación encontrada entre el contenido de ácido desoxirribonucleico (ADN) y el volumen nuclear. El contenido de ADN se incrementa con la simetría del cariotipo mientras menos contenido de ADN, el cariotipo es más asimétrico. (19
Este comportamiento a criterio de los autores se corresponde con una de las formas de crecimiento del tejido hiperplásico. Esta clase de diferenciación se caracteriza por el aumento de tamaño de un órgano o tejido, por el aumento del número de células, que implica formación y crecimiento de células nuevas. Este fenómeno sólo tiene lugar en las células con capacidad de división, es por eso que un aumento en el número de células implica mitosis, por lo tanto, solo se produce si la población celular es capaz de sintetizar ADN.
Desde el punto de vista patogenético pueden distinguirse dos grandes grupos de hiperplasias: las secundarias a una hipertrofia y las primarias. Las hiperplasias secundarias se explican por un desequilibrio trófico producido en la célula a medida que aumenta el volumen de la célula, se produce desequilibrio entre la masa protoplasmática y la superficie capilar alrededor de ésta, de la cual depende su nutrición en estas condiciones, las células hipertróficas, aún las fibras del miocardio, se dividen, es decir, se produce una hiperplasia secundaria a la hipertrofia en sentido estricto.
Las hiperplasias primarias, por lo general, se deben a factores endocrinos o irritativos, ocurren por división celular en tejidos de células que conservan su capacidad de proliferar después de la embriogénesis. Ejemplo: los epitelios en general.
Se acostumbra también a clasificar la hiperplasia en fisiológica y patológica. La hiperplasia fisiológica ofrece su mejor ejemplo en la hiperplasia hormonal, que aumenta la capacidad funcional de un tejido que lo necesita (en la proliferación glandular de la mama, tanto en la pubertad como durante el embarazo y la lactancia). La hiperplasia fisiológica también ocurre en las hiperplasias compensadoras que aumenta la masa tisular tras una lesión o resección parcial que se produce cuando se extirpa de manera quirúrgica una parte de un órgano, ante esto tiene lugar un mecanismo de regeneración para compensar la masa de tejido perdida, que consiste en que todas las poblaciones celulares maduras que constituyen el órgano empiezan a proliferar en especial los hepatocitos.
La mayor parte de las hiperplasias patológicas se deben a la actividad de un exceso de hormonas o factores de crecimiento sobre las células que la hacen proliferar y crecer de manera desordenada como es el caso de las enfermedades tumorales. La hiperplasia es una respuesta característica ante determinadas infecciones virales como la asociada al virus del papiloma humano que produce las verrugas cutáneas y varias lesiones mucosas constituidas por masas de epitelio hiperplásico. Por tanto, los factores de crecimiento producidos por los genes virales o por las células infectadas pueden estimular la proliferación celular.
La hiperplasia es consecuencia de la proliferación regulada por los factores de crecimiento de células maduras y en algunos casos del aumento de la formación de nuevas células a partir de las células madre tisulares. 20
En el melanoma maligno la hiperplasia se manifiesta por aumento del número de células en un área determinada, pero el tamaño de sus núcleos es pequeño producto a la intensa actividad mitótica, lo que justifica el alto grado de invasividad, como se mostró en la figura tres.
Cuando la célula se divide existen mutaciones que se propagan a nuevas generaciones de células, si la mutación ocurre justo sobre un protooncogén dará lugar a un oncogén o si se produce en genes supresores tumorales, la velocidad de la mitosis o división celular en con las mutaciones se vuelve descontrolada y conlleva a la formación de un tumor. (21
Está comprobado que los pacientes que presentan un historial de alta exposición a radiaciones ultravioletas (RUV) suelen tener un porcentaje de mutaciones en genes, oncogenes, superior al que poseen los pacientes con una exposición normal o baja.
La secuenciación masiva del genoma en muestras de melanomas metastásicos de pacientes ha permitido detectar distintas mutaciones, no solo mutaciones puntuales, transiciones citocina-timina sino también reordenamientos cromosómicos como delecciones, amplificaciones, así como translocaciones.
Estudios recientes han identificado que los melanomas de mucosas en piel de localización acral (plantas, palmas) y piel con daño solar crónico, es decir, lentigo maligno melanoma presentan frecuentes mutaciones en c-kit. Por tanto, en los melanomas primarios se encuentran distintos patrones de mutaciones genéticas según la localización anatómica y la intensidad de la exposición solar.
Relacionado al respecto en el año 2012 Berger MF et al. (22 realizaron una publicación sobre el genoma del melanoma donde en su análisis reveló pruebas globales genómicas para el papel de la mutagénesis por la (RUV) y se identificaron varios genes mutados y reorganizados que no estaban con anterioridad implicados. El descubrimiento de mutaciones somáticas en el melanoma y de vías de transducción de la señal aberrantes asociadas ha proporcionado datos para el desarrollo de fármacos dirigidos frente a moléculas en los pacientes con melanoma avanzado. (22,23
Otro aspecto importante en el estudio de las neoplasias es el factor de forma nuclear vinculado a factor del núcleo celular, según la tabla dos, el comportamiento de este mostró que hay menor pleomorfismo en el melanoma maligno de piel, mientras el factor de forma nuclear se acerca al valor uno , cifra que constituye el patrón para evaluar una estructura circular, es más redondo el núcleo y por tanto hay menor pleomorfismo, este resultado no se corresponde con García Gutiérrez M et al. 24) que en su estudio las células del melanoma son grandes, con abundante citoplasma eosinófilo y granular, con forma variable: cuboidales, fusiformes, redondeadas, sus núcleos son grandes, con nucleolo prominente, con grumos de cromatina en la periferia, suelen presentar ausencia de maduración nuclear, pero las mitosis son frecuentes.
El factor de forma, proporciona información importante sobre la estructura y la morfología de las células cambios en el ciclo celular, proceso de diferenciación celular, estado del metabolismo durante diferentes estados fisiológicos de la célula y contribuye a estudios diagnósticos y pronósticos.
El pleomorfismo nuclear es un indicador de gran importancia en el momento de evaluar el grado de diferenciación de una neoplasia. Las neoplasias malignas varían desde bien diferenciadas a indiferenciadas. Se dice que las compuestas por células en su totalidad indiferenciadas son anaplásicas, es una característica clave de la transformación maligna. El cáncer bien diferenciado surge de la maduración o especialización que las células indiferenciadas adquieren al proliferar mientras que los tumores malignos indiferenciados derivan de la proliferación sin maduración de las células transformadas.
Tanto las células como sus núcleos poseen un característico pleomorfismo. Pueden encontrarse células mucho más grandes que sus vecinas junto a otras muy pequeñas por esto las células de un mismo tumor no son uniformes sino que varían desde células grandes, muchas veces mayores que las vecinas hasta muy pequeñas como se observó en el estudio, que coincide con Cirón Cirón Martínez G et al. 25
Por otro lado, el tamaño y la forma del núcleo están estrechamente regulados, lo que indica la importancia fisiológica de una morfología nuclear adecuada, aunque los mecanismos y funciones de la regulación del tamaño y la forma nuclear son poco conocidos.
Se conoce de la correlación entre la morfología nuclear alterada y ciertos estados de enfermedad en particular muchos cánceres se diagnostican y estadifican en base a aumentos graduales en el tamaño nuclear, estudios recientes investigan los mecanismos que regulan el tamaño y la forma del núcleo cómo los eventos mitóticos influyen en la morfología nuclear y el papel del tamaño y la forma nuclear en la organización subnuclear de la cromatina y la progresión del cáncer.
En la literatura diversos estudios describen que el melanoma maligno presenta una morfología variable según su grado de diferenciación y de anaplasia con núcleos grandes, de contornos irregulares, con granos de cromatina en la periferia de la membrana nuclear, aspecto que lo caracteriza, los nucléolos son prominentes; crecen en forma de nidos pocos estructurados o como células aisladas, casi siempre hay actividad de mitosis por lo regular en pequeño número; la cantidad de melanina, elemento de gran valor diagnóstico, que puede ser escasa o abundante. 26
En el estudio se observó imagen histológica de melanoma maligno donde las células reflejan similares características a la descritas con anterioridad por la literatura, referida a la morfología según su grado de diferenciación y de anaplasia, se destaca la no coincidencia en las características en el tamaño de los núcleos, contorno, forma y crecimiento, como los núcleos son pequeños, tendentes a la circularidad, con abundantes imágenes de mitosis lo que infiere gran actividad de división, hiperplasia y en correspondencia gran actividad invasiva por el crecimiento desordenado de las células cancerosas (Figuras 4 y 5).
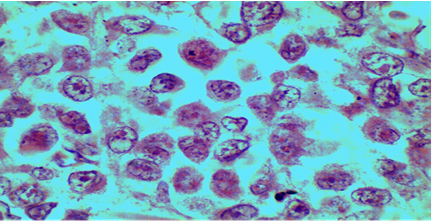
Figura 4 Microfotografías de corte histológico de melanoma maligno. Coloración hematoxilina y eosina. Se aprecian los núcleos de las células tumorales.
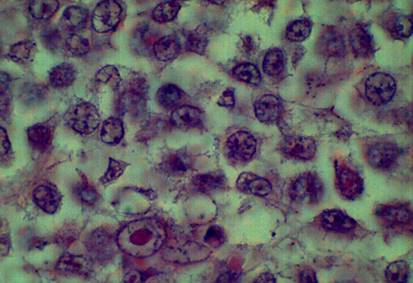
Figura 5 Microfotografías de corte histológico de melanoma maligno. Coloración hematoxilina y eosina. Se aprecian los núcleos de las células tumorales.
Sánchez I et al. (27) consideran la importancia del estudio del número de mitosis por milímetro cuadrado como indicador para estimar por los patólogos en el diagnóstico del melanoma maligno. Las células cancerosas proliferan e invaden territorios reservados para otras células en un proceso conocido como metástasis como resultado de proliferación celular sin posibilidad de control externo.
La invasión es una característica común a todos los tumores malignos y el análisis microscópico resulta evidente, cuando se observa que el tejido vecino a un cáncer, está constituido por células neoplásicas y no neoplásicas. 28,29,30
Conclusiones
El área y volumen nuclear muestra valores pequeños, lo que habla a favor de un comportamiento hiperplásico de este tipo de tejido tumoral. El factor de forma nuclear como indicador de pleomorfismo nuclear presentó valores superiores en los casos del estudio que en los descritos en la literatura