Introducción
La neumonía por COVID-19 es una enfermedad recién conocida que se ha extendido con rápidez por todo el mundo. 1,2,3,4) Los síntomas clínicos de esta infección son similares a los de SARS-CoV y MERS-CoV. La mayoría de los pacientes presentan fiebre, tos seca, disnea y opacidades bilaterales de vidrio esmerilado en las tomografías computarizadas de tórax. 1,5) En los casos de infección grave por COVID-19, los síntomas incluyen el síndrome de dificultad respiratoria aguda, shock séptico, acidosis metabólica, hemorragia y disfunción de la coagulación. 6 La mortalidad de pacientes críticos con neumonía por COVID-19 es alta. Es probable que el término de supervivencia de los no sobrevivientes sea de uno a dos semanas después de la admisión a la Unidad de Cuidados Intensivos. 7
Aunque las manifestaciones clínicas se comprendieron rápido, una vez aparecidos los primeros casos de infección, el conocimiento del fundamento patogénico y de los cambios histopatológicos que provoca el COVID-19 han tardado en generarse debido a la falta de realización sistemática de autopsias de casos confirmados de COVID-19, cuyos resultados contribuirá a esclarecer muchos aspectos tanto clínicos como terapéuticos en de la pandemia; es por ello que resulta oportuno organizar la escasa evidencia histopatológica existente.
Métodos
La evidencia se recopiló mediante una búsqueda en PubMed de publicaciones en idioma inglés, se utilizaron como las palabras claves: coronavirus, COVID-19, autopsy y síndrome de dificultad respiratoria aguda en varias combinaciones en el año 2020.
Solo se hallaron cinco artículos con información sobre los resultados de las autopsias de casos confirmados con COVID-19 (cuatro estudios originales y una revisión).
Desarrollo
1. Antecedentes:
En Wuhan, provincia de Hubei, China, en diciembre de 2019 se informó sobre un brote continuo de neumonía asociada con un nuevo coronavirus, denominado por la Organización Mundial de la Salud como COVID-19. 8 En las siguientes semanas, la infección se extendió por China y otros países del mundo. 9 Las sociedades científicas de salud pública y clínicas de China respondieron rápido, para permitir el reconocimiento oportuno del nuevo virus y compartir la secuencia del gen viral con el resto del mundo. 3,10
Hasta el 15 de febrero, se habían confirmado unos 66 580 casos y más de 1 524 muertes. 1,5) Sin embargo, hasta ese momento no se habían informado las características histopatológicas de la enfermedad para establecer la patogenia de la misma. Recién el 16 de febrero de 2020 en el hospital de Jinyintan, Wuhan se realizaron las dos primeras autopsias de casos de neumonía por COVID-19. 11
Xu Z et al. 12 informaron los resultados a partir de muestras de tejido pulmonar, hepático y cardíaco de un paciente masculino de 50 años ingresado en una clínica el 21 enero del 2020 con síntomas de fiebre, escalofríos, tos, fatiga y dificultad para respirar, luego de una mala evolución, falleció el día 14 de la enfermedad. Tian S et al. 13 realizaron sus estudios en tejidos obtenidos de dos pacientes masculinos de 84 y 73 años de edad, que se sometieron a una operación por cáncer de pulmón y luego se descubrió que estaban infectados con COVID-19; lo que permitió obtener las muestras necesarias para examinar la histopatología de la neumonía por COVID-19. Luego de estas dos publicaciones aparecieron los informes de Yao X et al. 14 y Liu Q et al. 15
Yao X et al. 14 realizaron autopsias invasivas de pulmón, corazón, riñón, bazo, médula ósea, hígado, páncreas, estómago, intestino, tiroides y piel a tres pacientes que murieron en Chongqing, China con polymerase chain reaction (PCR) en tiempo real reverse transcription polymerase chain reaction (RT-PCR) positiva para COVID-19. A dichas muestras aparte de la tinción con hematoxilina y eosina e histoquímica le realizaron tinciones inmunohistoquímica para evaluar la infiltración de las células inmunes, así como la expresión de las proteínas de COVID-19. Y, Liu Q et al. 15) reportaron los resultados de una autopsia de un hombre de 85 años de edad, quién luego de 13 días después de su ingreso hospitalario, resulto positiva la RT-PCR para COVID-19. La tomografía computarizada del día 20 del ingreso mostró que los dos pulmones tenían lesiones parcheadas dispersas con aspecto en vidrio esmerilado y el paciente falleció el día 28 después del ingreso.
2. Hallazgos histopatológicos:
2.1. Pulmón:
Xu Z et al. 12 hallaron daño alveolar difuso bilateral con exudados celulares fibromixoides (Figura 1A y B).

Figura 1. Manifestaciones patológicas de tejido pulmonar derecho (A) e izquierdo (B), tejido hepático en un paciente con neumonía grave causada por COVID-19. 12
El pulmón derecho mostró descamación evidente de neumocitos y formación de membrana hialina, lo que indica el síndrome de dificultad respiratoria aguda (SDRA) y se observó en la figura uno A.
El tejido pulmonar izquierdo mostró edema pulmonar con formación de membrana hialina, sugestiva de SDRA en fase temprana, que se observó en la figura uno B.
Se observaron infiltrados inflamatorios mononucleares intersticiales, dominados por linfocitos, en ambos pulmones. Se identificaron células sincitiales multinucleadas con neumocitos agrandados atípicos caracterizados por núcleos grandes, citoplasma granular anfofílico y nucléolos prominentes en los espacios intraalveolares, que muestran cambios virales citopáticos. No se identificaron inclusiones virales intranucleares o intracitoplasmáticas evidentes. 12
En el primer caso estudiados por Tian S et al. 13) se observaron daños alveolares evidentes, incluidos edema alveolar y exudados proteicos. También se observaron secreciones esféricas o glóbulos prominentes, además de congestión vascular pero infiltración inflamatoria irregular y leve. Se observaron grupos de fibrina focal mezclados con células inflamatorias mononucleares y células gigantes multinucleadas en los espacios aéreos. No hubo infiltración significativa de neutrófilos en el tejido. Se observó hiperplasia de neumocitos en forma parcheado y engrosamiento intersticial, lo que indica un proceso de reparación en curso. Observaron además a diferencia de Xu Z et al. 12 algunas células con imágenes sospechas de inclusiones virales (Figura 2A, B, C y D).

Figura 2 Cambios histológicos de la neumonía por enfermedad por COVID-19 (A) Exudados proteináceos en espacios alveolares, con gránulos; (B) glóbulos de proteínas grandes dispersos (flechas); (C) fibrina intraalveolar con organización temprana, células inflamatorias mononucleares y células gigantes multinucleadas; (D) neumocitos hiperplásicos, algunos con sospecha de inclusiones virales (flecha). 13
Por su histología, en el segundo caso Tian S et al. 13) describieron la presencia de parénquima pulmonar con evidentes exudados proteínicos y de fibrina, con engrosamiento difuso de las paredes alveolares, consistente en fibroblastos intersticiales proliferantes e hiperplasia de neumocitos tipo II. Se observaron además, tapones de fibroblastos focales (flecha) y células gigantes multinucleadas (puntas de flecha) en los espacios aéreos, que indica diversos grados de fase proliferativa del daño alveolar difuso. Algunas áreas tenían abundantes macrófagos alveolares junto con hiperplasia de neumocitos tipo II (Figura 3A, B, C y D).
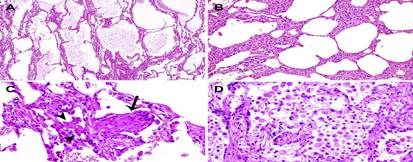
Figura 3 Cambios histológicos de la neumonía por enfermedad por COVID-19. (A) Evidente exudado proteínico y de fibrina; (B) expansión difusa de paredes alveolares y septos debido a proliferaciones fibroblásticas e hiperplasia de neumocitos tipo II, consistente con el patrón de daño alveolar difuso temprano; (C) tapones de fibroblastos proliferantes o bolas de fibroblastos en el intersticio (flecha); (D) abundantes macrófagos que infiltran espacios aéreos e hiperplasia de neumocitos tipo II. 13
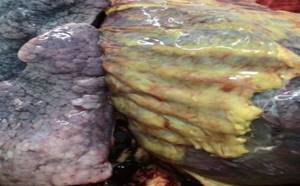
Liu Q et al. 15) al realizar la autopsia descubrieron a nivel de la cavidad torácica alrededor de 150 ml de derrame pleural bilateral en forma de un líquido transparente amarillo pálido. La pleura derecha estaba engrosada y amarilla, con una adherencia severa extensa al pulmón, con impresiones de las costillas en forma de hendiduras en el lado posterior del pulmón derecho; la mayor parte del pulmón izquierdo tenía parches gris-blancos, La congestión pulmonar derecha era intensa, mostraba parches rojo oscuro. El líquido viscoso blanquecino se desbordaba y las hebras de fibra fueron visibles. El lado dorsal del pulmón era negro oscuro e irregular, y el tacto duro. Se observó mucosidad blanca similar a la espuma en la tráquea y mucosa gelatinosa en el bronquio del pulmón derecho (Figura 4).
Microscópicamente los hallazgos de Liu Q et al. 15 fueron consistentes con los de Xu Z et al. 12 con la identificación de membrana hialina en alvéolos pulmonares con áreas de fibrosis intersticial, presencia de células gigantes multinucleadas moderadas, linfocitos mínimos, eosinófilos y neutrófilos y la proliferación significativa de epitelios alveolares tipo II con descamación focal de epitelios alveolares.
En correspondencia de los hallazgos macroscópicos Liu Q et al. 15 describieron la presencia de vasos sanguíneos del tabique alveolar congestionados, edematosos y ensanchados, con una infiltración moderada de monocitos y linfocitos, con trombos hialinos en una minoría de microvasos. Se observó hemorragia focal en el tejido pulmonar y organización de exudados en algunas cavidades alveolares.
Liu Q et al. 15) pudieron precisar por medio de la tinción inmunohistoquímica que la mayoría de los linfocitos infiltrados eran células TCD4 positivos; y que parte del epitelio alveolar y los macrófagos fueron positivos para el antígeno COVID-19. Con microscopio electrónico se observaron partículas de COVID-19 en epitelios de la mucosa bronquial y epitelios alveolares de tipo II.
Los informes de Yao X et al. 14) son muy similares a los descritos por Liu Q et al. 15sin embargo, en el estudio con microscopio electrónico pudieron identificar partículas de COVID-19 en el epitelio de la mucosa bronquial y alveolar y la tinción inmunohistoquímica mostró que parte del epitelio alveolar y los macrófagos fueron positivos para el antígeno COVID-19.
2.2. Sistema cardiovascular:
Xu Z et al. 12 observaron una pequeña cantidad de infiltración inflamatoria de células mononucleares en el tejido cardíaco, sin otra sustancia, lo que sugiere que el virus también afecta el tejido miocárdico (Figura 5).
Liu Q et al. 15 por su parte hallaron una cantidad moderada de líquido amarillo claro en la cavidad pericárdica, el epicardio con edema ligero y la sección del miocardio era rojo grisáceo mate. Masa cardíaca 350 g, paredes ventriculares izquierda y derecha y los grosores del tabique ventricular fueron 1,4; 0,4 y 1,5 cm respectivamente. Placas ateroscleróticas en la arteria coronaria derecha y rama descendente anterior izquierda. Además, se observaron formación de trombos hialinos en pequeños vasos sanguíneos.
2.3. Bazo:
Liu Q et al. 15 observaron una disminución en el número de linfocitos, degeneración celular y necrosis en el bazo.
2.4. Hígado:
Xu Z et al. 12 encontraron en el hepática esteatosis leve y anormalidades lobulares y portales leves, lo que sugiere que puede estar relacionado con daño viral o daño inducido por fármacos (Figura 6).
2.5. Otros órganos:
Se observaron degeneración y necrosis de las células parenquimatosas y cambios patológicos de enfermedades crónicas a nivel del resto de los órganos. No se observó evidencia de infección por COVID-19. 14
Conclusiones
Se ha podido comprobar que el COVID-19 produce en lo esencial daño alveolar, el cual consiste en edema pulmonar con formación de membrana hialina, que se expresa por clínica como un síndrome de dificultad respiratoria aguda que puede evolucionar a la muerte en un corto tiempo sin las medidas adecuadas.
Las autopsias de casos confirmados de COVID-19 y la publicación de sus resultados contribuirían a guiar el tratamiento clínico más eficaz y la no realización de la autopsia favorecería las conductas terapéuticas inadecuadas.