My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
MEDISAN
On-line version ISSN 1029-3019
MEDISAN vol.18 no.1 Santiago de Cuba Jan. 2014
ARTÍCULO ORIGINAL
Tratamiento con trióxido de arsénico en pacientes con leucemia promielocítica aguda
Treatment with arsenic trioxide in patients with acute promyelocitic leukemia
MsC. Lidia Clara Suárez Beyríes, Dra. Yadirka Noa Tamayo, Dr. Inocente Rodríguez Reyes, MsC. Geldris Hernández Galano y MsC. Beatriz O. de la Uz Ruesga
Hospital General Docente "Juan Bruno Zayas Alfonso", Santiago de Cuba, Cuba.
RESUMEN
Se realizó un estudio observacional, descriptivo y transversal de 17 adultos con leucemia promielocítica aguda, atendidos en el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso" de Santiago de Cuba durante un quinquenio, con vistas a evaluar la eficacia del tratamiento de inducción con trióxido de arsénico. En la casuística, la remisión hematológica completa se obtuvo en 82,4 % de sus integrantes a los 42,2 días como promedio. Predominaron la hepatotoxicidad y los dolores óseos como reacciones adversas más comunes, así como también las hemorragias severas como causa principal de muerte. Con este tratamiento se logró la incorporación laboral de quienes mejoraron totalmente y la sobrevida global hasta la fecha es de 76,4 %.
Palabras clave: adulto, leucemia promielocítica aguda, tratamiento de inducción, remisión hematológica completa, atención secundaria de salud.
ABSTRACT
An observational, descriptive and cross-sectional study was conducted in 17 adults with acute promyelocitic leukemia, attended in "Dr. Juan Bruno Zayas Alfonso" General Teaching Hospital of Santiago de Cuba during a five-year period to evaluate the effectiveness of induction therapy with arsenic trioxide. In the case series the complete hematologic remission was obtained in 82.4% of patients at 42.2 days on average. Hepatotoxicity and bone pain prevailed as the most common adverse reactions, as well as severe bleeding as main cause of death. With this treatment the return to work of those who improved completely was achieved and overall survival to date is 76.4%.
Key words: adult, acute promyelocitic leukemia, induction therapy, hematologic complete remission, secondary health care.
INTRODUCCIÓN
La leucemia mieloblástica aguda (LMA) es la más frecuente en el adulto, con 2 picos de incidencia máxima: de 25-30 y de 60-70 años.1 Los jóvenes suelen presentar leucemia de "novo" en contraposición a las LMA en los mayores de edad, frecuentemente precedidas de otras neoplasias hematológicas (llamadas secundarias) y con peor pronóstico.
Por otra parte, la leucemia promielocítica (LPM) representa 10-15 % de los casos de las LMA y tiene características clínicas, citogenéticas, citomorfológicas y tratamientos que la distinguen del resto de las leucemias.2,3
Según la clasificación establecida por el Grupo Franco-Americano-Británico (FAB), esta subvariedad se acompaña de un cuadro purpúrico hemorrágico relevante y se asocia con frecuencia a un síndrome de coagulación intravascular diseminada (CID), que complica el tratamiento citorreductor con episodios de hemorragias graves.4
Hasta finales de la década de los 80 era considerada como la forma más temible y rápidamente mortal de LMA, pero luego de la introducción de nuevos métodos de diagnóstico y tratamiento se ha convertido en el subgrupo de mayor tasa de remisiones completas y curaciones.5 Entre los elementos fundamentales que han contribuido a estos avances figuran la identificación de una aberración cromosómica específica en más de 95 % de los pacientes, dada por la t (15,17) y el gen de fusión PML-RARá, así como también la introducción del ácido transretinoico (ATRA) en el tratamiento de quienes la padecen.2,3
A principio de los años 80 Bernard señaló la sensibilidad de la LPM al uso de algunos agentes citotóxicos como las antraciclinas utilizadas como monoterapia;4-6 sin embargo, no fue hasta 1988 que el grupo Shangai demostró con sus primeras publicaciones la eficacia del ATRA en el tratamiento de esta enfermedad oncohematológica.
Posteriormente, estudios realizados por varios grupos cooperativos de otros países evidenciaron que la administración simultánea de ATRA más quimioterapia (QMT), produce tasas de remisiones completas del orden de 85-95% y sobrevida libre de enfermedad (SLE) de 70-90%, mucho más elevada que los regímenes de quimioterapia intensiva que ocasionan mayor toxicidad y complicaciones fatales.
En 1997 investigadores chinos destacaron la eficacia de un antiguo medicamento, el trióxido de arsénico (TOA), al lograr una nueva remisión en pacientes con LPM en recaída, que anteriormente habían logrado la remisión completa de la enfermedad con tratamiento de inducción con ATRA y mantenimiento con quimioterapia; resultados que fueron corroborados posteriormente por científicos norteamericanos.7,8
Al respecto, el TOA fue utilizado como medicamento en enfermedades hematológicas desde el siglo XIX. Después del resultado alcanzado por algunos autores,9-11 quienes lograron una nueva remisión completa en 14 de 15 pacientes adultos con LPM en recaída, con la utilización del TOA en una infusión endovenosa (10 mg/día), múltiples han sido los estudios que han demostrado su eficacia en el rescate de dichos pacientes. Así, todos los grupos notifican cifras de nuevas remisiones que fluctúan entre 80-100 % de los casos tratados.9,12-17
La acción del TOA sobre el promielocito leucémico no es citotóxica, sino que por diferentes mecanismos afecta numerosas vías de señales de transducción intracelulares y altera la función de las células que inducen la apoptosis. También degrada la proteína de fusión producto del gen PML/RARá, la cual ocasiona el bloqueo de genes responsables de la diferenciación mieloide. Por otra parte, el TOA a concentraciones menores induce la diferenciación celular.3,4,6
Al comprobarse la eficacia del TOA en el tratamiento de la LPM en recaída o resistente al ATRA, varios grupos lo han utilizado como droga de primera línea en pacientes con LPM: al inicio de la enfermedad, como terapia de inducción a la remisión y en la fase de consolidación de esta, ya sea como medicamento único o asociado al ATRA, a una antraciclina, o ambas, así como también junto con anticuerpos monoclonales.
Los resultados registrados oscilan de 80-100 % de remisiones hematológicas, alcanzadas entre los 28-42 días de tratamiento.5-7 Teniendo en cuenta la incidencia de esta variedad en este medio y la elevada mortalidad asociada a complicaciones hemorrágicas cuando el diagnóstico y el tratamiento no se efectúan de forma oportuna, los autores de este artículo decidieron evaluar la eficacia del tratamiento de inducción con trióxido de arsénico en pacientes con leucemia promielocítica aguda.
MÉTODOS
Se realizó un estudio observacional, descriptivo y transversal de 17 adultos con leucemia promielocítica aguda, atendidos en el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso" de Santiago de Cuba durante un quinquenio, con vistas a evaluar la eficacia del tratamiento de inducción con trióxido de arsénico.
A todos los afectados se les administró el TOA (0,15 mg/kg/día, diluido en 200 mL de dextrosa al 5% por vía endovenosa) y el tiempo de infusión fue entre 2 - 4 horas.
El medicamento se mantuvo hasta lograr la remisión hematológica completa. Todos los pacientes recibieron prednisona por vía oral (0,5-1,0 mg/kg/día), los primeros 28 días de tratamiento, y la rubidomicina se les administró de acuerdo con el número total de leucocitos al diagnóstico, es decir si era > 10x109/L, correspondía una dosis de 45 mg/m2/día por vía endovenosa, los días 2, 4, 6 y 8.
La información fue obtenida de las historias clínica y la microhistoria individual, para lo que se empleó una planilla de vaciamiento en la que se recogieron los datos clínicos y de laboratorio necesarios del paciente en el momento del diagnóstico y durante su evolución con el tratamiento de inducción.
RESULTADOS
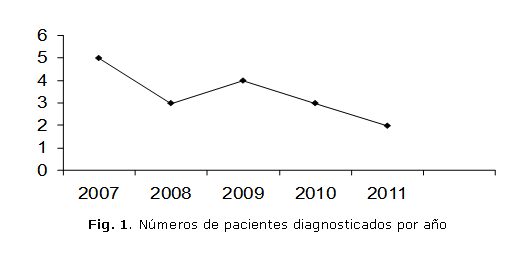
En este centro hospitalario, la LPM representa de 10-15 % del total de las LMA. En la figura 1 se muestra el número de pacientes diagnosticado en el quinquenio estudiado.
En la casuística (tabla), la edad promedio fue de 40,8 años para el sexo masculino y de 37,5 para el femenino, con un rango de 18-57 años.
En relación con los síntomas al inicio del tratamiento, predominaron la visceromegalia, las hemorragias y la fiebre; asimismo las reacciones adversas más frecuentes resultaron ser los dolores óseos (82,4 %), la hepatotoxicidad (64,7 %) y la queratoconjuntivitis (47,1 %).
Se logró a remisión completa en 82,4 % de los integrantes de la serie en 42,2 días como promedio y no se obtuvo respuesta en 17,6 %, los cuales fallecieron por hemorragias severas en el período de inducción.
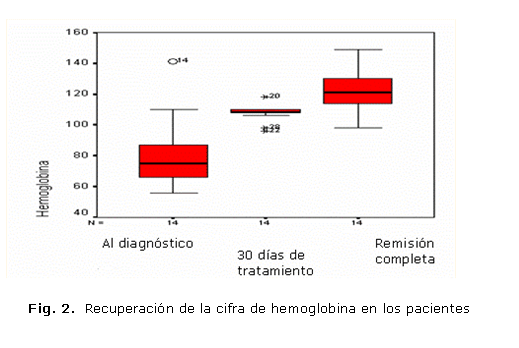
En la figura 2 se observa la evolución de la cifra de hemoglobina durante el tratamiento. La media de la hemoglobina inicial estuvo en 80,4 g/L con un mínimo de 56 g/L y un máximo de 141 g/L; a los 30 días de tratamiento fue de 107,7 g/L con valores mínimo y máximo de 96 y 118 g/L, respectivamente. La hemoglobina media al concluir el tratamiento y lograr la remisión hematológica completa resultó ser de 123 g/L, con un valor mínimo de 98 g/L y máximo de 149 g/L. Este indicador mostró recuperación a los 22,6 días de tratamiento como promedio.
En cuanto al número de plaquetas inicial (figura 3), la media fue de 39,2 x 109/L, con valor mínimo de 5x109/L y máximo de 100 x 109/L. A los 30 días de tratamiento alcanzó un valor medio de 167x 109/L, con valor mínimo de 40 x 109/L y valor máximo de 300 x 109/L y cifras normales superiores a 150 x 109/L a los 25,3 días de tratamiento como promedio. Al lograrse la recuperación completa la media fue de 207,8 x 109/L, con valor mínimo de 170 x 109/L y máximo de 250 x 109/L.
Por su parte, el número de leucocitos (figura 4) tuvo un valor medio inicial de 6,4 x 109/L; a los 30 días tratamiento de 4,4 x 109/L, con valor máximo de 6,8 x 109/L en 11,3 días como promedio y un valor medio en el momento de la RHC de 5,8 x 109/L.
Hasta la fecha los pacientes se mantienen en remisión completa con una supervivencia de 76,4 %.
DISCUSIÓN
Hoy día, el tratamiento con trióxido de arsénico está considerado como una alternativa en pacientes con leucemia promielocítica aguda. Al respecto, estudios nacionales e internacionales7-9 muestran un porcentaje elevado de respuesta hematológica, asociado a una baja incidencia de efectos adversos durante la inducción, con los cuales coinciden los resultados de esta serie.
En esta casuística, la edad promedio fue de 40,8 años y la enfermedad predominó en los pacientes de 18-57 años; hallazgos que apoyan la hipótesis de que la incidencia de la LPM se incrementa proporcionalmente con la edad hasta los 55 años (rango 20-50) y desciende luego de los 60.8 De forma muy similar ocurrió con el sexo, de manera que no existió diferencia significativa y se correspondió con lo descrito por otros autores.7-11
Los pacientes incluidos en el grupo de riesgo bajo, según el conteo inicial de leucocitos, representaron más de la mitad (66,7%) y el resto (33,3%) fueron de riesgo alto. Este resultado se relaciona con lo obtenido por Miller et al,11 quienes refieren, en cuanto a las variantes morfológicas de la LPM, que existe una variante hipergranular asociada con la t (15,17), caracterizada por leucopenia y que representa más de 50 % del resto de dichas variantes.
Todos los pacientes mostraron buena recuperación de las cifras de hemoglobina y plaquetas antes de la RC. Por otra parte, en cuanto al número de leucocitos se observó un valor medio inicial de 6,4 x 109/L; a los 30 días, de 4,4 x 109/L, con un máximo de 6,8 x 109/L en 11,3 días como promedio, así como un valor medio en el momento de la RC de 5,8 x 109/L.
En estudios efectuados por Sanz et al 12 y Mathews et al 13 se halló leucocitosis en 56,7 y 68,4 %, respectivamente, similar a lo encontrado en la presente investigación. En estos casos se administra antraciclina en el momento del diagnóstico para evitar posibles complicaciones.
A diferencia de lo referido en otras publicaciones que muestran mayor porcentaje de CID en el momento del diagnóstico,13-15 en esta solo fallecieron 2 pacientes por presentar hemorragias secundarias, lo cual concuerda con quienes consideran que la trombocitopenia probablemente desempeña una función importante en la aparición de este episodio hemorrágico y que la presencia de CID fue fundamental.14 No se excluye la combinación de otros factores no estudiados como la hiperfibrinolisis y la proteolisis, descritos en publicaciones actuales sobre la fisiopatología de la coagulopatía en la LPM.
Las manifestaciones hemorragíparas estuvieron presente en 10 pacientes (83,3 %), resultado que muestra la importancia de los trastornos de la hemostasia en la LPM, particularmente la CID y su repercusión en el desarrollo clínico de esta enfermedad.
Fallecieron 2 pacientes (16,6%) ambos por hemorragias severas y de forma precoz. En estudio reciente se señala 10,5 % de muerte precoz y la causa más frecuente resultó ser la dificultad respiratoria; asimismo, un paciente falleció por hemorragia intracraneal y otros autores obtuvieron porcentajes similares, aunque todos atribuibles a hemorragias intracraneales por trastornos de la coagulación. No hubo fallecidos después de la primera semana de tratamiento diferente a lo obtenido en series similares que sí describen muertes en el transcurso de la inducción por sepsis graves, hemorragias intracraneales y síndrome de diferenciación celular.13-18
En cuanto a las reacciones adversas primaron los dolores óseos (82,4 %), seguidos de la hepatotoxicidad (64,7 %), esta última solo expresada por el aumento de las enzimas hepáticas, las cuales se normalizaron antes de culminar el tratamiento y en ninguno de los pacientes fue preciso suspender el TOA. Estos resultados son muy similares a los encontrados por otros autores,12,13 quienes señalan 44,7 y 63,7 % de hepatotoxicidad, respectivamente.
Recientemente Mathews et al16 obtuvieron que la hepatotoxicidad fue la reacción adversa más frecuente (33,3 %) y que 6,9 % de estos pacientes tuvieron que suspender el tratamiento por un promedio de 18,2 días (rango 7-28 días). En esta misma publicación se asoció la hepatotoxicidad a una mutación homocigótica del gen MTHFR A1298C vinculado al metabolismo del medicamento a nivel hepático, presente en el 60,3% de los casos13, 14,18
Con menor frecuencia aparecieron otras reacciones como la queratoconjuntivitis, manifestación clínica que no ha sido registrada en otras series.
Las reacciones cardiovasculares, tales como las anomalías en el electrocardiograma, el bloqueo auriculoventricular y otros tipos de arritmias relacionados con el uso del TOA y su asociación con otros medicamentos, capaces de producir alteraciones electrolíticas, han sido registradas con mayor frecuencia por otros autores.
Por su parte, Sanz et al 12 señalaron 15,8 % de cardiotoxicidad y un solo paciente no tuvo que suspender el tratamiento; en otro, la suspensión fue definitiva por lesión isquémica del miocardio y, en el resto, la interrupción fue de 2,5 días como promedio, pero en esta serie se suspendió por 2 días.
En varios estudios se informa la ocurrencia de reacciones adversas que en el nuestro no estuvieron presentes, tales como el síndrome de diferenciación celular, la hiperpigmentacion de la piel, así como las náuseas y/o vómitos que revirtieron al concluir el tratamiento sin necesidad de suspenderlo.16,19
La remisión hematológica completa se logró en 82,4 % a los 42,2 días como promedio y el porcentaje restante obedece a los pacientes que murieron, a pesar de haber iniciado tratamiento oportuno. En concordancia con lo anterior, Tallman et al 19 alcanzó 86,8 % de RC en 41,9 días como promedio.
Al respecto, en publicaciones internacionales se ha analizado el beneficio del TOA como único agente en el tratamiento de los pacientes con LPM de debut, donde la RC ha sido superior a 85 %.10
REFERENCIAS BIBLIOGRÁFICAS
1. Huang M, Ye Y, Chen S, Chai J, Lu J, Zhoa L, et al. Use of all-trans retinoic acid in the treatment of acute promyelocytic leukemia. Blood. 1988; 72: 567-72.
2. Ramos Peñafiel CO, Castellanos Sinco H, Montaño E, Martínez Murillo C, Lavielle P, García Vidrios V. Experiencia del tratamiento de la leucemia promielocítica aguda (LAP) en el Hospital General de México: protocolo LAP 2001. Rev Hematol Mex. 2009; 10 (supl2): 57.
3. Taliman MS, Andersen JW, Schiffer CA. Clinical description of 44 patiens with acute promyelocyticleucemia who Developer the retinoic acid syndrome. Blood. 2000; 95(1):90-5.
4. Zhu J, Okumura H, Ohtake S, Nakamura S, Nakao S. The molecular mechanism of arsenic-induced apoptosis and oncosis in lucemia/lymphoma cell lines. Acta Haematol. 2003; 110 (1):1-10.
5. Ablain J, The H. Revisiting the differentiation paradigm in acute promyelocitic leukemia. Blood. 2011; 117(22): 5795-5802.
6. Sweeney J, Takimoto C, Wood L, Porter JM, Tracevel WG, Darwish M, et al. A pharmacokinetic and safety study of intravenous arsenic trioxide in adult cancer patients with renal impairment. Cancer Chemother Pharmacol. 2010; 66:345-56
7. Grimwade D, Jovanovic JV, Hills RK, Nugent EA, Patel Y, Flora R, et al. Prospective minimal residual disease monitoring to predict relapse of acute promyelocytic leukaemia and direct pre-emptive arsenic trioxide therapy. J Clin Oncol. 2009; 27(22):3650.
8. Ghavamzadeh A, Alimoghaddam K, Rostami S, Ghaffari SH, Jahani M, Iravani M, et al. Phase II study of single-agent arsenic trioxide for the front-line therapy of acute promyelocytic leukemia. J Clin Oncol. 2011; 29(20): 2753-7.
9. Niu C, Yan H, Yu T, Sun HP, Liu JX, Li XS, et al. Studies on treatment of acute promyelocytic leukemia with arsenic trioxide: remission induction, followup, and molecular monitoring in 11newly diagnosed and 47 relapsed acute promyelocytic leukemia patients. Blood. 1999; 94(10):3315-24.
10. Lazo G, Kantarjian H, Estey E, Thomas D, O´Brien S, Cortes J. Use of arsenic trioxide (As2O3) in the treatment of patients with acute promyelocytic leukemia. Cancer. 2003; 97:2218-24.
11. Miller W, Schipper H, Lee J, Singer J, Waxman S. Mechanisms of action of arsenic trioxide. Cancer Res. 2002; 62:3893-903.
12. Sanz M, Fenaux P, Lo Coco F. Arsenic trioxide in the treatment of acute promyelocytic leukemia. A review of current evidence. Haematol. 2005; 90:1231-5.
13. Mathews V, George B, Lakshmi KM, Viswabandya A, Bajel A, Balasubramanian P, et al. Single-agent arsenic trioxide in the treatment of newly diagnosed acute promyelocytic leukemia: durable remissions with minimal toxicity. Blood. 2006; 107(7):2627-32.
14. Jin Zhou, Yingmei Zhang, Jinmei Li, Xiaoxia Li, Jinxiao Hou, Yanqiu Zhao. Single-agent arsenic trioxide in the treatment of children with newly diagnosed acute promyelocytic leukemia. Blood. 2010; 115(9): 1697-1702.
15. Hu J, Liu YF, Wu CF, Xu F, Shere ZX, Zhue YM, et al. Long-term efficacy and safety of all-trans retinoic acid/arsenic trioxide-based therapy in newly diagnosed acute promyelocytic leukemia. Proc Nat Acad Sci. 2009; 106(6):3342-7.
16. Mathews V, Jijina F, Ross C. Single agent arsenic trioxide regimen for the treatment of newly diagnosed acute promyelocytic leukemia: a multicenter randomized controlled study from India to study the optimal duration of arsenic trioxide maintenance therapy (IAPLSG04). Blood. 2009; 114: 822.
17. De la Serna J, Montesinos P, Vellenga E, Rayón C, Parody R, León A, et al. Causes and prognostic factors of remission induction failure in patients with acute promyelocytic leukemia treated with all-trans retinoic acidand idarubicin. Blood. 2008; 111(7): 3395-3402.
18. Ravandi F, Estey E, Jones D, Faderl S, O'Brien S, Fiorentino J, et al. Effective treatment of acute promyelocytic leukemia with all-trans-retinoic acid, arsenic trioxide, and gemtuzumabozogamicin. J Clin Oncol. 2009; 27(4):504-10.
19. Tallman MS, Altman JK. How I treat acute promyelocytic leukemia. Blood. 2009; 114:5126-35.
Recibido: 21 de agosto de 2013.
Aprobado: 13 de septiembre de 2013.
Lidia Clara Suárez Beyríes.Hospital General Docente "Dr. Juan Bruno Zayas Alfonso", avenida Cebreco, km 1½, reparto Pastorita, Santiago de Cuba, Cuba. Correo electrónico:lidia@hospclin.scu.sld.cu