My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Correo Científico Médico
On-line version ISSN 1560-4381
ccm vol.21 no.2 Holguín Apr.-June 2017
ARTÍCULO ORIGINAL
Polimorfismos en los genes MTHFR e IL-10 y factores de riesgo en pacientes con cáncer gástrico del municipio de San José de Cúcuta, Colombia
Polymorphisms in MTHFR and IL-10 Genes and Risk Factors in Patients with Gastric Cancer in the Municipality of San José de Cúcuta, Colombia
Fabián Galvis 1, Esmeralda Rivero-López 2, Denny Cárdenas 1
1. Máster en Biotecnología. Biólogo. Facultad de Ciencias de la Salud. Universidad de Santander UDES. Cúcuta. Colombia.
2. Bacterióloga. Facultad de Ciencias de la Salud. Universidad de Santander UDES. Cúcuta. Colombia.
3. Máster en Ciencias Biológicas. Bacterióloga. Facultad de Ciencias de la Salud. Universidad de Santander UDES. Cúcuta. Colombia.
RESUMEN
Introducción: el cáncer gástrico es una de las neoplasias de mayor interés en el mundo por su incidencia y mortalidad asociada. Se consideran tres factores relacionados con la ocurrencia del carcinoma gástrico: infección por Helicobacter pylori, susceptibilidad genética del huésped y factores ambientales.
Objetivo: evaluar los polimorfismos C677T, A592C y T819C y factores de riesgo en pacientes con cáncer gástrico del municipio San José de Cúcuta.
Métodos: aplicación de encuestas para detectar factores de riesgo, determinación de infección por Helicobacter pylori, genotipificación de polimorfismos mediante PCR-RFLP y análisis estadístico.
Resultados: el análisis de factores de riesgo en los pacientes del grupo de casos mostró un consumo de tabaco, alcohol, y sal en el 68,8%, e infección por Helicobacter pylori de 75%; se determinó que el 68,8% tenían antecedentes familiares de cáncer y el 75% enfermedades gástricas preexistentes. El grupo control presentó un consumo de alcohol y tabaco inferior al de los pacientes del grupo de casos, alto consumo de verduras (64%) y valor similar de infección por Helicobacter pylori (80%). El análisis del polimorfismo C677T mostró mayor frecuencia en los pacientes del grupo de casos y grupo control para el alelo salvaje; los polimorfismos A592C y T819C presentaron mayor frecuencia del alelo mutado en los pacientes del grupo de casos y grupo control. El polimorfismo C677T no evidenció asociación significativa con la probabilidad de cáncer gástrico. Los polimorfismos A592C y T819C no registraron diferencias significativas entre los pacientes del grupo de casos y grupo control.
Conclusión: aunque no se observaron diferencias significativas en las variantes genéticas, al evaluar los factores ambientales se detectaron distintos patrones entre los pacientes del grupo de casos y grupo control, lo cual probablemente explicaría la ausencia de la enfermedad en individuos sanos.
Palabras clave: cáncer gástrico, IL-10, MTHFR, polimorfismo de nucleótido simple, PCR-RFLP.
ABSTRACT
Introduction: gastric cancer is one of more concern neoplasms around the world due to its incidence and associated mortality. Helicobacter pylori infection, host genetic susceptibility and environmental factors are considered the causes of gastric carcinoma occurrence.
Objective: to evaluate the C677T, A592C and T819C polymorphisms and risk factors in patients with gastric cancer in the municipality of San José de Cúcuta.
Methods: application of surveys for determining risk factors, detection of serologic response to H. pylori infection, genotyping of polymorphisms using PCR-RFLP and statistical analysis.
Results: the analysis of risk factors in the cases showed consumption of tobacco, alcohol, and salt in 68.8% and H. pylori infection in 75% of cases; 68.8% had a family history of cancer and 75% had preexisting gastric disease. The control population had lower consumption of alcohol and tobacco comparing to the cases group, high consumption of vegetables (64%) and similar value of H. pylori infection (80%). Analysis of the C677T polymorphism revealed predominance of the wild-type allele in both cases and controls with no evidence of association with the developing of gastric cancer; the polymorphisms A592C and T819C presented higher frequency of the mutated allele in both groups, with no significant differences between cases and controls.
Conclusions: although no significant differences were observed in the genetic variants, different patterns were detected between cases and controls regarding the evaluation of environmental factors, which would probably explain the absence of the disease in healthy individuals.
Keywords: gastric cancer, interleukin-10, MTHFR, single nucleotide polymorphism, PCR, RFLP.
INTRODUCCIÓN
El cáncer gástrico (CG) constituye la tercera causa de muerte por cáncer en ambos sexos a nivel mundial. Colombia junto a Japón, Costa Rica, Singapur, Corea y Chile son considerados los países con las tasas más altas; en Colombia en el 2014 presentó una tasa de mortalidad de 10,28 por cada 100 000 habitantes 1. Según el Instituto Nacional de Cancerología, en Colombia se exhibe entre el 2007 al 2011, 5 955 pacientes del grupo de casos de CG, con 2 938 muertes registradas, se presenta una alta mortalidad en los departamentos de Nariño, Boyacá, Cundinamarca, Tolima, Bogotá y Santander; y mortalidad alta-moderada en los departamentos de Antioquia, Valle y Norte de Santander 2. Yepes y colaboradores en el 2015, reportan un promedio de 15 pacientes por semestre entre el 2007 y 2011 en el Municipio de San José de Cúcuta, Norte de Santander, Colombia 3.
El CG es una enfermedad multifactorial, que resulta de la combinación de factores ambientales, alteraciones genéticas y de la infección por Helicobacter pylori 2. Se observa una asociación entre el consumo general de sal y un aumento de riesgo, debido al daño directo sobre la mucosa gástrica y la formación de compuestos cancerígenos 4. Por otra parte, se encuentra que un alto consumo de frutas y hortalizas representan un efecto protector frente el riesgo de padecer CG 5.
Variantes alélicas específicas de diferentes genes se asocian con un mayor riesgo para desarrollar CG 6. Dentro de los polimorfismos de nucleótido simple (SNPs) relacionados con la carcinogénesis gástrica se encuentra el SNP C677T del gen MTHFR que codifica para la enzima metilentetrahidrofolato reductasa (MTHFR), el cual se vincula con una mayor susceptibilidad a CG, debido a que la mutación disminuye la actividad de la enzima MTHFR, llevando a una hipometilación del ADN y a la expresión de oncogenes 7. También se relaciona con el riesgo de CG, los SNPs A592C y T819C de la región promotora del gen de la interleucina 10 (IL8) 8, debido a su implicación en las respuestas de estrés celular, inflamación y persistencia de la respuesta inmunológica 9.
El carácter multifactorial del CG lleva a considerar las posibles interacciones entre los factores ambientales, bacterianos y del huésped, con el fin de determinar sinergismo o antagonismo entre ellos. La presencia de estas interacciones está comprobada, las cuales están condicionadas por la presencia de SNPs en genes participantes en procesos relevantes para la carcinogénesis gástrica, ejemplo, la respuesta inflamatoria, la protección contra el daño oxidativo y reparación del ADN3. De igual manera, la dieta puede considerarse un factor de riesgo (o protector) en pacientes infectados con determinadas cepas de H. pylori, denominadas de alto riesgo por sus factores de virulencia 10.
El propósito de esta investigación fue determinar la presencia de los SNPs C677T del gen MTHFR y A592C y T819C del gen IL-10 y factores ambientales para establecer su posible influencia en la susceptibilidad de padecer de CG en una población diagnosticada del municipio de San José de Cúcuta, Colombia.
MÉTODOS
Esta investigación comprendió un diseño de estudio observacional y analítico del tipo pacientes de grupo de casos y grupo control, donde la muestra fue seleccionada en función de la presencia o ausencia de CG. Posteriormente en cada grupo se determinaron los SNPs en los genes IL-10 y MTHFR y factores de riesgo de la enfermedad a los que estuvieron expuestos los pacientes.
El estudio se realizó durante seis meses en 16 pacientes del grupo de casos (nivel de confianza del 95% y margen de error de 5%, de acuerdo con lo reportado por Yepes y colaboradores en el 20153) con diagnóstico confirmado de CG mediante endoscopia y estudio de patología y 25 pacientes del grupo control con endoscopia y estudio de patología negativo, del municipio de San José de Cúcuta. A las personas participantes se les tomó muestra de sangre y se les solicitó diligenciar el consentimiento informado y una encuesta.
La encuesta fue elaborada según el modelo expuesto por WHO (2005) 11 se determinaron las características demográficas (edad, sexo), hábitos y estilo de vida (consumo de tabaco, alcohol, frutas y verduras, sal, alimentos ahumados, productos embutidos y enlatados) y antecedentes médicos personales y familiares (enfermedades del estómago y cáncer familiar) de los participantes. La encuesta fue validada por un experto en metodología y un experto en el área científica.
Se empleó la prueba inmunoenzimática indirecta para la detección de anticuerpos IgG frente a Helicobacter pylori a partir de muestras de suero sanguíneo usando el kit HELICOBACTER PYLORI ELISA IgG de la casa comercial Vircell Microbiologists. El ADN genómico humano se aisló con el empleo del kit comercial UltraClean® Blood DNA de la casa comercial MoBio, de acuerdo con el protocolo descrito por el fabricante.
Genotipificación por PCR-RFLP
El SNP C677T del gen MTHFR y los SNPs A592C y T819C de la región promotora de la IL-10 fueron identificados mediante reacción en cadena de la polimerasa y polimorfismos de longitud de fragmentos de restricción (PCR-RFLP). La PCR se realizó en un volumen final de 50 µl que contenía: 1 X buffer de reacción para la enzima Taq, 1µM de cada iniciador, 1U de Taq ADN polimerasa y 2 µl de ADN.
Para el SNP C677T se emplearon los iniciadores C677TF CGAAGCAGGGAGCTTTGAGGCTG y C677R AGGACGGTGCGGTGAGAGTG, con un programa de amplificación con desnaturalización inicial de 94 °C por 5 min, seguida de 35 ciclos de 30 seg a 94 °C, 30 seg a 67 °C y 30 seg a 72 °C, y una extensión final a 72°C por 10 min. El producto esperado se digiere con la enzima Hinf I 12. Para los SNPs A592C y T819C se emplearon los cebadores A592C-F GTGAGCACTACCTGACTAGC, A592C-R CCTAGGTCACAGTGACGTGG, T819C-F TCATTCTATGTGCTGGAGATGG y T819C-R TGGGGGAAGTGGGTAAGAGT, con un programa de amplificación con desnaturalización inicial de 95 °C por 5 min, seguida de 35 ciclos de 40 seg a 95 °C, 1 min a 58 °C y 40 seg a 72 °C, y una extensión final a 72°C por 10 min. Los productos esperados se digieren con la enzima Rsa I para el SNP A592C y la enzima Mae III para el SNP T819C 13. Los productos amplificados y digeridos fueron visualizados en geles de agarosa al 2%, teñidos con GelRed™ de la casa comercial Biotium.
Para el análisis estadístico, establecer la asociación potencial entre los SNPs y el estatus clínico, se utilizó el programa estadístico SPSS versión 19; se calcularon las frecuencias alélicas y genotípicas para la muestra en estudio; se determinaron la razón de productos cruzados (RP) y sus intervalos de confianza de 95% de los factores de riesgo en regresión logística binaria simple.
La presente investigación fue aprobada por el Comité de Ética de Investigación del Hospital Universitario Erasmo Meoz del municipio de San José de Cúcuta, Norte de Santander, Colombia.
RESULTADOS
La edad promedio observada en los pacientes grupo de casos fue de 61,8 (12,9) años y en el grupo control de 63,5 (11,3) años, con un promedio similar en ambos grupos. El 68,8% de los pacientes del grupo de casos correspondió a hombres y el 31,2% a mujeres. El consumo de cigarrillo fue mayor en los pacientes del grupo de casos, con el 68,8%, mientras que en el grupo control fue de 20%. El consumo de alcohol fue de 68,8% en pacientes del grupo de casos y 36% en el grupo control. El alto consumo de sal está presente en el 68,8% de los pacientes del grupo de casos y en el 52% del grupo control. En la mayoría de pacientes del grupo de casos y grupo control predomina el alto consumo de verduras (50% y 64%, respectivamente).
El 68,8% de pacientes del grupo de casos y el 24% del grupo control tienen antecedentes familiares de cáncer, de los cuales el 54,4% de pacientes del grupo de casos corresponden a CG, mientras que el 16,7% en el grupo control. El 75% de pacientes del grupo de casos y el 12% del grupo control presentan enfermedades en el estómago, fue la gastritis la más frecuente en ambos grupos (75% y 66,7% en los pacientes del grupo de casos y control, respectivamente). La mayoría de los pacientes del grupo de casos y grupo control presentó resultado positivo para infección por H. pylori, 75% y 80%, comparativamente.
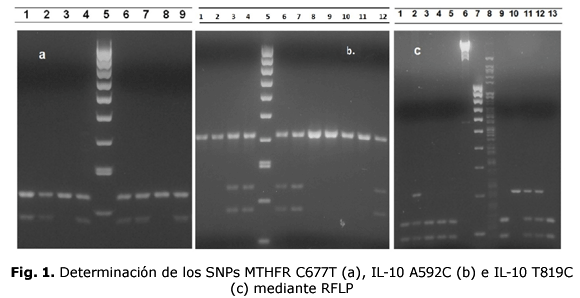
Se realizaron las PCR correspondientes para los SNPs MTHFR C677T, IL-10 A592C e IL-10 T819C, posteriormente partiendo de los productos amplificados, se realizó la digestión enzimática para cada SNP (fig. 1).
a. MTHFR C677T. Líneas 1 a 4: pacientes del grupo de casos; línea 5: marcador de peso molecular HyperLadder™ 100 bp; líneas 6 y 7: grupo control; línea 8: control positivo genotipo homocigoto salvaje (CC); línea 9: control positivo genotipo heterocigoto (CT).
Las líneas 1, 2, 4, 6 y 7 evidencian al genotipo heterocigoto (CT) y la línea 3 al genotipo homocigoto salvaje (CC). Producto sin digerir: 233 pb; producto digerido con Hinf I: 176 y 57 pb. b. IL-10 A592C: Líneas 1 a 4: pacientes grupo casos; línea 5: Marcador de peso molecular HyperLadder™ 100 bp; líneas 6 a 10: grupo control, línea 11: control positivo genotipo homocigoto mutado (CC); línea 12: control positivo genotipo heterocigoto (AC).
Las líneas 1, 2, 8, 9 y 10 corresponden al genotipo homocigoto mutado (CC), y las líneas 3, 4, 6 y 7 al genotipo heterocigoto (AC). Producto sin digerir: 412 pb; producto digerido con Rsa I: 175 y 237 pb. c. IL-10 T819C: Líneas 1 a 5: pacientes del grupo de casos; línea 6: fago lambda digerido con Hind III; línea 7: Marcador de peso molecular HyperLadder™ 100bp; línea 8: fago lambda digerido con Hind IIIy Mae III; línea 9: control positivo genotipo homocigoto mutado (CC); línea 10: control positivo genotipo homocigoto salvaje (TT); línea 11: control positivo genotipo heterocigoto (TC); líneas 12 y 13: pacientes del grupo de casos. Las líneas 1, 3, 4, 5 y 13 evidencian al genotipo homocigoto mutado (CC) y las líneas 2 y 12 al genotipo heterocigoto (TC); Líneas 6 y 8 corresponden al fago lambda utilizado como control de la digestión. Producto sin digerir: 209 pb; producto digerido con Mae III: 125 y 84 pb.
En la determinación del SNP C677T, el genotipo heterocigoto (CT) se presentó en el 69% de los pacientes del grupo de casos y en el 76% del grupo control; el genotipo homocigoto mutado (TT) se evidenció en dos de los individuos sanos.
Se estimaron las frecuencias alélicas y genotípicas para la muestra en estudio, observándose una elevada frecuencia en pacientes del grupo de casos y grupo control para el alelo salvaje (tabla I). En el SNP A592C, el 64% de los pacientes del grupo de casos presentaron el genotipo homocigoto mutado (CC), a diferencia del grupo control en donde se observó que el genotipo más común fue el heterocigoto (CT) 54% de los individuos. En ninguno de los dos grupos se presentó el genotipo salvaje (TT) y se observó elevada frecuencia del alelo mutado en pacientes del grupo de casos y grupo control
Tabla I. Frecuencias alélicas y genotípicas de los SNPs C677T, A592C y T819C
| SNP | Muestra | Frecuencias alélicas | Frecuencias genotípicas | X2 | |||
| C677T | Grupo control | C | T | CC | CT | TT | 7,01 p>0,001 |
| 0,54 | 0,46 | 0,2916 | 0,4968 | 0,2116 | |||
| Pacientes del grupo de casos | 0,66 | 0,34 | 0,4303 | 0,4513 | 0,1183 | 4,38 p >0,01 | |
| A592C | Grupo control | A | C | AA | AC | CC | 2,14 p>0,10 |
| 0,27 | 0,73 | 0,0729 | 0,3942 | 0,5329 | |||
| Pacientes del grupo de casos | 0,18 | 0,82 | 0,0324 | 0,2952 | 0,6724 | 0,82 p>0,30 | |
| T819C | Grupo control | T | C | TT | TC | CC | 0,009 p>0,90 |
| 0,34 | 0,66 | 0,1156 | 0,4488 | 0,4356 | |||
| Pacientes del grupo de casos | 0,27 | 0,73 | 0,0729 | 0,3942 | 0,5329 | 0,008 p>0,90 | |
Fuente: datos de la investigación
Para el SNP T819C, el genotipo homocigoto mutado (CC) se presentó en el 53% de pacientes del grupo de casos; mientras que en el grupo control, tanto el genotipo homocigoto mutado (CC) y heterocigoto (TC), se presentaron en el 44%. Por otra parte, el genotipo salvaje fue más frecuente en el grupo control (12%) que en los pacientes del grupo de casos (7%) y se evidenció una mayor frecuencia del alelo mutado en pacientes del grupo de casos y grupo control (tabla I).
En la muestra estudiada no se evidenció asociación significativa entre el SNP C677T y la probabilidad de padecer CG (p=0,70; RP= 0,60; intervalo de confianza, IC 95%: 0,04-8,17). Los resultados para los SNPs A592C y T819C no se incluyeron en el análisis porque su comportamiento fue similar entre grupos, sin diferencias significativas entre los pacientes del grupo de casos y el grupo control.
DISCUSIÓN
En este estudio no se observaron diferencias significativas en el análisis de las variantes genéticas entre pacientes del grupo de casos y grupo control, sin embargo, si se detectaron distintos patrones entre ambos grupos al evaluar los factores ambientales, lo cual podría explicar la ausencia de la enfermedad en los individuos sanos: la expresión de los genotipos asociados a CG está condicionada por la interacción con los factores ambientales, lo cual justificaría la gran divergencia entre los estudios realizados en distintas regiones geográficas 4, 5.
En la muestra estudiada no se evidenció asociación significativa entre el SNP MTHFR C677T y la probabilidad de padecer CG. En un estudio realizado en México con pacientes con CG distal, se presentan resultados similares, concluyen que el genotipo 677TT es frecuente en la población mexicana y no se asocia con el riesgo de CG 14. Esta falta de asociación también se observa en población europea y asiática 15, 16.
La metilación del ADN representa el principal mecanismo epigenético y cumple diversas funciones, entre ellas, la supresión de la expresión de genes, aumento de la estabilidad genómica, aporte en la función y desarrollo celular, entre otros; por lo que las alteraciones que se puedan presentar en este proceso, constituyen mecanismos para el desarrollo de cáncer 17.
Esta metilación puede verse alterada por baja disponibilidad de folato, ocasionado por deficiencia nutricional (considerado factor de riesgo potencial para carcinogénesis en el tracto gastrointestinal) o por la presencia de SNPs en el gen MTHFR. La enzima MTHFR cataliza la conversión de 5,10-metilentetrahidrofolato a 5-metilentetrahidrofolato, la cual proporciona el grupo metilo para la remetilación de la homocisteína a metionina, asegurando así la provisión de s-adenosil-metionina (SAM), donante de metilo universal para reacciones de metilación, incluida la del ADN 15.
Teniendo en cuenta el papel que desempeña el folato proveniente de la dieta en los procesos de metilación, síntesis y reparación de ADN, se puede considerar que su consumo adecuado en individuos portadores del alelo 677T contrarresta los posibles efectos de la actividad disminuida de la enzima MTHFR, pues la producción de desoxinucleótidos de novo a partir de los grupos metilo suministrados por la dieta sería suficiente para la síntesis y reparación del ADN, generando una situación más favorable 18.
De esta manera, el consumo inadecuado de folato concomitante a la actividad deteriorada de la enzima MTHFR podrían ser importantes factores de susceptibilidad al CG 19. Los alimentos como las hortalizas, guisantes, frutas y jugos de cítricos constituyen una importante fuente de folatos. En la presente investigación, se observó que el grupo control se relaciona con un alto consumo de verduras (fuente de folato) lo cual podría representar un factor protector frente al desarrollo de CG. Además, el bajo consumo de alcohol predominó en la mayoría de los individuos sanos, condición que también se podría considerar como un factor protector, teniendo en cuenta que algunos estudios sugieren que el consumo de alcohol puede disminuir la absorción intestinal del folato e incrementar su excreción a nivel renal, elevando de esta manera los requerimientos nutricionales 20, 21.
En una revisión sistemática reciente que abarca estudios donde se evalúan las interacciones gen-dieta en diferentes regiones geográficas del mundo (Este de Asia, Europa y América) se concluye que la diversidad en los hábitos dietarios y la variabilidad en la frecuencia de las variantes genéticas puede ser la causa de la alta tasa de incidencia de CG en ciertas regiones geográficas. También menciona que en la mayoría de los estudios no se logra clarificar el mecanismo específico de la interacción gen-dieta. Y además, se presentan limitaciones debido al número reducido de la muestra y la ausencia de poder estadístico que no permite explicar por qué los resultados de los análisis de las interacciones entre polimorfismos y hábitos dietarios no alcanzan la significancia estadística 22.
En el análisis de los SNPs A592C y T819C presentes en la región promotora del gen IL-10, no se observaron diferencias significativas entre los pacientes grupo de casos y grupo control. Las frecuencias genotípicas halladas en el estudio son comparables a las reportadas por Martínez en un estudio realizado en una población colombiana, cuyo resultado es la ausencia de relación entre el SNP T819C y el CG 23.
La comprensión actual de los polimorfismos genéticos y la susceptibilidad al cáncer gástrico se basa en gran medida en los estudios desarrollados en población asiática y caucásica (de Europa y América del Norte). El origen étnico se propone como un factor de la modificación del riesgo de cáncer 24. Considerando las observaciones realizadas por los anteriores estudios se puede asumir que en Colombia existe gran variabilidad en la frecuencia de las variantes genéticas, debido probablemente a la mezcla de poblaciones autóctonas y de inmigrantes 6, añadido a la diversidad de costumbres en las diferentes regiones del país, influenciadas por la conservación de tradiciones definidas por el medio geográfico, las relaciones económicas y socioculturales, el acceso a productos y la representación de lo que es alimento o comida. Esto último permite determinar que la nutrición es un factor de riesgo relevante para desarrollar cáncer gástrico, especialmente cuando se tiene una dieta deficiente en proteínas, vitaminas e insuficiente consumo de frutas y vegetales frescos 25.
Se considera que la infección por H. pylori es un factor importante que promueve el proceso precanceroso, pues la inflamación superficial causada por este microorganismo constituye la etapa inicial del modelo de múltiples etapas. Se estima que casi la mitad de la población mundial está infectada con esta bacteria, sin embargo, la mayoría de las personas son asintomáticas, y aproximadamente 1-3% desarrollan cáncer 26.
En la presente investigación se observó que la mayoría de pacientes del grupo de casos (75%) y grupo control (80%) presentaron anticuerpos contra H. pylori, sin encontrarse asociación significativa de la infección con el riesgo de CG. Algunos estudios sugieren que los efectos de la infección por H. pylori están determinados por alteraciones en el genoma del microorganismo, así como, por las condiciones ambientales que rodean el huésped. Un metanálisis realizado a nivel de Latinoamérica describe algunas condiciones del agente bacteriano, como la presencia de factores de virulencia y los orígenes ancestrales (cepas europeas vs. cepas africanas) y en relación al huésped: los hábitos alimenticios, considerados como la principal diferencia entre las poblaciones infectadas por H. pylori, con alta y baja prevalencia de CG 4.
Los resultados en este estudio deben evaluarse teniendo en cuenta sus limitaciones: el tamaño de la muestra empleado fue pequeño, lo que podría afectar el poder del análisis de la asociación de los polimorfismos genéticos con la presencia de CG.
CONCLUSIONES
En el análisis de las frecuencias genotípicas se determinó que los SNP A592C y T819C presentaban mayor presencia del genotipo homocigoto mutado que el homocigoto salvaje, tanto en los pacientes del grupo de casos, como en el grupo control, pero sin diferencias significativas.
En el análisis del SNP C677T se concluyó que aunque no hay relación entre la presencia del polimorfismo y el riesgo a desarrollar CG (RP=0,60), probablemente si existieron interacciones entre los genotipos encontrados y ciertos factores ambientales, ejemplo, la interacción gen-dieta, que alteran la expresión de tales genotipos, por lo que sería conveniente la realización de futuros estudios que abarcaran una muestra de mayor tamaño para evaluar con profundidad estos factores ambientales y lograr una caracterización más específica de estos.
REFERENCIAS BIBLIOGRÁFICAS
1. OMS. Perfiles oncológicos de los países. Ginebra: OMS; 2014[citado 10 mar 2017]. Disponible en: http://www.who.int/cancer/country-profiles/en/
2. Pardo Ramos C, Cendales Duarte R. Incidencia, mortalidad y prevalencia de cáncer en Colombia, 2007-2011. Bogotá: Instituto Nacional de Cancerología, Ministerio de Salud y Protección Social; 2015 [citado 13 abr 2016]. Disponible en: http://www.cancer.gov.co/files/libros/archivos/incidencia1.pdf
3. Yepes M, Yañez C, Contreras J, Atehortua W. Caracterización epidemiológica y clínica de los pacientes con cáncer gástrico en el departamento de Norte de Santander, periodo 2007-2011. Semana de Divulgación Científica; 2014 sep 15-19. Cúcuta: Universidad de Santander; 2014.
4. Hernández Ramírez RU, López Carrillo L. Dieta y cáncer gástrico en México y en el mundo. Sal Púb México. 2014 [citado 10 mar 2017]; 56(5): 555-560. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0036-36342014000500023
5. Bonequi P, Meneses González F, Correa P, Rabkin CS, Camargo MC. Risk factors for gastric cancer in Latin America: a meta-analysis. Cancer Causes Control. 2013 [citado 13 abr 2016]; 24(2): 217-231. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3961831/
6. Martínez T, Hernández GA, Bravo MM, Trujillo E, Pérez García J, Robayo JC, et al. Lesiones preneoplásicas gástricas en pacientes colombianos: asociación de polimorfismos genéticos interleucinas 1B-511, 1RN, 10-819, 10-1082, factor de necrosis tumoral-α-308 y anticuerpos inmunoglobulina G hacia cagA de Helicobacter pylori. Rev Colombiana Cancerol. 2014 [citado 13 abr 2016]; 18(1): 8-17. Disponible en: http://www.scielo.org.co/pdf/rcc/v18n1/v18n1a03.pdf
7. Xia LZ, Liu Y, Xu XZ, Jiang PC, Ma G, Bu XF, et al. Methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and gastric cancer susceptibility. World J Gastroenterol. 2014 [citado 13 abr 2016]; 20(32):11429-11438. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4145786/
8. Pan XF, Yang SJ, Loh M, Xie Y, Wen YY, Tian Z, et al. Interleukin-10 gene promoter polymorphisms and risk of gastric cancer in a Chinese population: single nucleotide and haplotype analyses. Asian Pacific J Cancer Prev. 2013 [citado 13 abr 2016]; 14(4): 2577-2582. Disponible en: http://ocean.kisti.re.kr/downfile/volume/apocp/POCPA9/2013/v14n4/POCPA9_2013_v14n4_2577.pdf
9. Sáenz López P, Vázquez Alonso F, Romero JM, Carretero R, Tallada Buñuel M, Ruiz Cabello, F, et al. Polimorfimos en genes de respuesta inflamatoria en cáncer renal metastásico. Actas Urol Española. 2009 [citado 10 mar 2017]; 33(5): 474-481. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S02108062009000500004&lng=es
10. Epplein M ,Zheng W, Li H, Peek RM, Correa P, Jing G, et al. Diet, Helicobacter pylori Strain-Specific Infection, and Gastric Cancer Risk Among Chinese Men. Nutr Cancer. 2014 [citado 13 abr 2016]; 66(4): 550-557. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4068395/
11. WHO. The WHO STEPwise approach to noncommunicable disease risk factor surveillance Geneva: WHO; 2005[ 2017 ene 26 ;citado 2017 mar 10]. Disponible en: http://who.int/chp/steps/STEPS_Manual.pdf
12. Saberi S, Zendehdel K, Jahangiri S, Talebkhan Y, Abdirad A, Mohajerani N, et al. Impact of methylenetetrahydrofolate reductase C677T polymorphism on the risk of gastric cancer and its interaction with Helicobacter pylori infection. Iran Biomed J. 2012 [citado 13 abr 2016]; 16(4): 179-184. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3600959/
13. Liu J, Song B, Wang JL, Li ZJ, Li WH, Wang ZH. Polymorphisms of interleukin-10 promoter are not associated with prognosis of advanced gastric cancer. World J Gastroenterol. 2011 [citado 13 abr 2016]; 17(10): 1362. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3068274/
14. Zúñiga Noriega JR, del Roble Velasco campo M, Aguirre Rodríguez A, Martínez de Villarreal L, Garza González E, Maldonado Garza HJ, et al. Polimorfismo C677T del gen MTHFR y el riesgo al desarrollo de cáncer gástrico distal en una población mexicana. Rev Gastroenterol México. 2007 [citado 10 mar 2017]; 72(4):355-358. Disponible en: http://www.medigraphic.com/pdfs/gastro/ge-2007/ge074c.pdf
15. Hassan Nazki F, Syed Sameer A, Ahmad Ganaie B. Folate: metabolism, genes, polymorphisms and the associated diseases. Gene. 2014 [citado 13 abr 2016]; 533(1): 11-20. Disponible en: http://www.sciencedirect.com/science/article/pii/S0378111913012687
16. Yoo JY, Kim SY, Hwang JA, Hong SH, Shin A, Choi IJ, et al. Association study between folate pathway gene single nucleotide polymorphisms and gastric cancer in Koreans. Genomics Inform. 2012 [citado 13 abr 2016]; 10(3): 184-93. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3492654/
17. Voelker P, Sheese BE, Rothbart MK, Posner MI. Methylation polymorphism influences practice effects in children during attention tasks. Cogn Neurosci. 2016 [citado 13 abr 2016]; 8(2):72-84. Disponible en: http://www.tandfonline.com/doi/full/10.1080/17588928.2016.1170006
18. Graziano F, Kawakami K, Ruzzo A, Watanabe G, Santini D, Pizzagalli F, et al. Methylenetetrahydrofolate reductase 677C/T gene polymorphism, gastric cancer susceptibility and genomic DNA hypomethylation in an at‐risk Italian population. Int J Cancer. 2006 [citado 13 abr 2016]; 118(3): 628-632. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/ijc.21397/epdf
19. Boccia S, Hung R, Ricciardi G, Gianfagna F, Ebert MP, Fang JY, et al. Meta-and pooled analyses of the methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and gastric cancer risk: a huge-GSEC review. Am J Epidemiol. 2008 [citado 13 abr 2016]; 167(5): 505-516. Disponible en: http://aje.oxfordjournals.org/content/167/5/505.long
20. Zhang FF, Terry MB, Hou L, Chen J, Lissowska J, Yeager M, et al. Genetic polymorphisms in folate metabolism and the risk of stomach cancer. Cancer Epidemiol Biomarkers Prev. 2007 [citado 13 abr 2016]; 16(1):115-121. Disponible en: http://cebp.aacrjournals.org/content/16/1/115.long
21. Stolzenberg Solomon RZ, Qiao YL, Abnet CC, Ratnasinghe DL, Dawsey SM, Dong ZW, et al. Esophageal and gastric cardia cancer risk and folate-and vitamin B12-related polymorphisms in Linxian, China. Cancer Epidemiol Biomarkers Prev. 2003 [citado 13 abr 2016]; 12(11).Disponible en: http://cebp.aacrjournals.org/content/12/11/1222.long
22. Kim J, Ae Cho Y, Jin Choi W, Hwa Jeong S. Gene-diet interactions in gastric cancer risk: A systematic review. World J Gastroenterol.2014 [citado 13 abr 2016]; 20(28): 9600-9610. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4110595/
23. Martínez T, Hernández G, Bravo MM, Trujillo E, Quiroga A, Robayo JC, et al. Polimorfismos genéticos de interleucinas IL-1B-511, IL-1RN, IL-10, factor de necrosis tumoral α-308 e infección por Helicobacter pylori CagA positivo en cáncer gástrico y úlcera duodenal en diferentes poblaciones en Colombia. Rev Colombiana Cancerol. 2011 [citado 13 abr 2016]; 15(2): 85-97. Disponible en: http://apps.elsevier.es/watermark/ctl_servlet?_f=10&pident_articulo=90283933&pident_usuario=0&pcontactid=&pident_revista=361&ty=37&accion=L&origen=zonadelectura&web=www.elsevier. es&lan=es&fichero=361v15n02a90283933pdf001.pdf
24. Chiurillo MA. Role of gene polymorphisms in gastric cancer and its precursor lesions: Current knowledge and perspectives in Latin American countries. World J Gastroenterol. 2014 [citado 13 abr 2016]; 20(16): 4503-4515. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4000487/
25. Suarez R, Wiesner C, González C, Cortés C, Shinchi A. Antropología del cáncer e investigación aplicada en salud pública. Rev Estud Soc. 2004 [citado 10 mar 2017]; 17: 42-55. Disponible en: http://www.redalyc.org/articulo.oa?id=81501705
26. Zabaleta J. Multifactorial etiology of gastric cancer. Methods Mol Bio. 2012 [citado 13 abr 2016]; 863: 411-435. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625139/
Recibido: 22 de junio de 2016
Aprobado: 16 de marzo de 2017
MSc. Fabián Galvis. Facultad de Ciencias de la Salud. Universidad de Santander UDES. Cúcuta. Colombia.
Correo electrónico: fgs999@hotmail.com