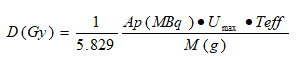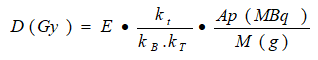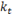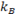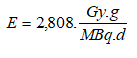Introducción
El hipertiroidismo constituye un trastorno funcional del tiroides caracterizado por la secreción, y el consiguiente paso a la sangre, de cantidades excesivas de hormonas tiroideas en relación a las necesidades del organismo. Dicha anomalía se traduce en un cuadro clínico de gran expresividad. Su incidencia anual es del 3 %, la prevalencia en hombres es del 0,1 - 0,2 % y en mujeres, de 1,9 - 2,7 %. Dentro de sus causas principales se encuentran por orden de frecuencia: la enfermedad de Graves-Basedow en un 60 - 80 % de los casos, el bocio multinodular tóxico en un 10 - 30 % y el adenoma tóxico entre un 2 - 10 %.1,2)
La Medicina Nuclear posee una larga historia de aplicaciones terapéuticas con radiofármacos, en la que usualmente los tratamientos se han prescrito en unidades de actividad a administrar. El I131 empieza a usarse como medio terapéutico desde 1941 y se ha convertido en una de las terapias estándar, y es ampliamente usado en todo el mundo.( ) Es la forma más común de tratamiento del hipertiroidismo en Estados Unidos por su bajo costo, facilidad de administración (simplicidad) y ausencia de complicaciones severas (seguridad), mientras que en Europa y Japón es la segunda línea de tratamiento.3,4,5)
A pesar de la gran eficacia y experiencia acumulada, no ha existido un acuerdo o evidencia científica clara sobre las dosis y/o actividad a aplicar para estos tratamientos. Algunas instituciones han utilizado actividades fijas,6 otras han determinado las actividades basándose en aproximaciones por el peso de la glándula, otras prescribiendo la dosis a partir de la máxima incorporación7 y/o los tiempos efectivos,4,8 etc. Varios estudios han reportado dosis óptimas basadas en lograr el eutiroidismo post-terapia.4 Algunos autores utilizan dosis fijas con la intención de suprimir completamente la función tiroidea, es decir producir hipotiroidismo,9 otros por el contrario consideran indeseable reemplazar una enfermedad por otra irreversible.1,10
Investigadores modernos y organizaciones internacionales, abogan por el uso de cálculos dosimétricos para ajustar la actividad a administrar al caso concreto que se presente, para evitar el daño no deseado inducido por el radioyodo, las repeticiones innecesarias de tratamientos y los inconvenientes de las medidas de radioprotección requeridas.10,11,12
El tratamiento con I131 en el hipertiroidismo es aproximadamente el 35 % de los tratamientos de Medicina Nuclear (MN) en Europa13 y cerca del 50 % en los países latinoamericanos. Sin embargo, la práctica en ambos continentes está caracterizada, en su mayoría, por un enfoque dosimétrico no estandarizado que adolece de tomar en consideración la individualidad morfo-funcional del paciente (término conocido desde el punto de vista dosimétrico como enfoque paciente-específico o tratamiento paciente-específico).10
En el 2013, la Sociedad Europea de Medicina Nuclear (SEMN), publicó las guías para desarrollar procedimientos de planificación de dosis paciente-específicos para estos tratamientos, con la intención de brindar un impulso a la optimización de estas terapias a nivel mundial,14 teniendo en cuenta algunas de la evidencias concretas ya reportadas en la literatura.15,16 En este mismo año, la Comunidad Europea de la Energía Atómica (EURATOM), en su directiva 5917 instauró el carácter obligatorio de la planificación individualizada de dosis y su verificación en las aplicaciones terapéuticas de las radiaciones ionizantes. Esta directiva establece como principio básico del proceso de planificación, la entrega de la dosis necesaria para el control de la enfermedad en el órgano o tejido blanco, con el mínimo de irradiación a los órganos o tejidos circundantes.
Las interpretaciones sobre cómo aplicar esta regulación y/o recomendación ha sido amplia, especialmente en esta terapia vastamente utilizada. Sin embargo, en la literatura de los últimos años, se observa un incremento del interés por desarrollar una dosimetría paciente específica en el hipertiroidismo, que esté acorde a los nuevos estándares de calidad y cumpla con las recomendaciones establecidas. 2,3,4,7,9,10,18
En este trabajo, nos propusimos evaluar la aplicabilidad de varios métodos de cálculo de dosis paciente-específica para la optimización del tratamiento con yodo en hipertiroidismo, con el empleo de herramientas y equipos disponibles en el Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. Con su aplicación, valorar, el posible impacto dosimétrico con respecto al método de actividad fija ya establecido, incluyendo la variabilidad inter-observador.
Métodos
El Departamento de Medicina Nuclear del Hospital Clínico Quirúrgico “Hermanos Ameijeiras,” realizó entre enero del 2013 y diciembre del 2018, un promedio anual de 103 ± 5,5 terapias con I131 en hipertiroidismo. El 98 % de ellas en mujeres y el 47 % en menores de 40 años. El estudio detallado de 10 casos, permitió la caracterización dosimétrica de una muestra de este tamaño con nivel de confianza 95 % (p = 0,05), con un error absoluto estimado de tener datos erróneos menores del 10 %.
Para analizar la variabilidad intrahospitalaria, la actividad de I131 prescrita por los diferentes especialistas para el procedimiento establecido, se comparó la prescripción por tres médicos especialistas, realizada de forma independiente, cumpliendo el procedimiento normalizado de operación basado en actividades fijas a criterio del especialista. Se seleccionaron los 10 primeros casos que acudieron a consulta del 2018 que cumplieron con los siguientes criterios de inclusión: paciente mayor de 18 años, con diagnóstico y evidencia clínica de hipertiroidismo autoinmune, nódulo tiroideo o bocio multinodular tóxico, sin fenómenos compresivos o evidencia de carcinoma, y que de forma voluntaria consintieron en participar en la investigación. Las mujeres en edad fértil contaron con una prueba de embarazo negativa 72 h antes de recibir tratamiento. Se calcularon las diferencias entre las actividades prescritas y se analizó su posible impacto en la dosis del propio paciente.
En la literatura de referencia, el cálculo de dosis paciente-específica en el tiroides se acota al cálculo de la dosis promedio bajo la combinación de técnicas 1D, 2D y 3D calculada por Tomografía de Emisión del Fotón Único (SPECT).11,14,19 Las variantes que permiten el equipamiento y los isótopos disponibles en el país, se acotan en las siguientes ecuaciones:
Si se emplea el modelo farmacocinético de una exponencial,20 se reduce a:
Teff - |
es el periodo de vida media efectivo (h) |
Umax - |
Fracción de captación máxima |
M(g): |
es la masa calculada por Ultrasonido (US) o gammagrafía (2D, 3D) |
Si se utiliza el modelo farmacocinético doble exponencial14, se reduce a:
M(g) |
es la masa calculada por US (1D) o gammagrafía (2D, 3D) |
Tasa de eliminación de la actividad del torrente sanguíneo por el tejido blanco |
|
Tasa de eliminación de la actividad del torrente sanguíneo |
|
Tasa de eliminación de la actividad del tejido blanco |
|
E: |
es la energía media depositada en el tiroides por desintegración del I131, y es igual a: |
Conociendo las actividades prescritas, se calcularon las dosis a partir de diferentes aproximaciones:
La fórmula 1, con el empleo de la captación máxima que reportó el captor y el Teff teórico de 5,5 d.
La ecuación 1, con el empleo de la captación máxima que reporta el captor y el Teff propio del paciente (ajuste función monoexponencial).
Esta aproximación empleó las mediciones del captor para ajustar matemáticamente la biocinética (formulación óptima, ajuste a una función doble exponencial),21 según la ecuación 2.
Para planificar el tratamiento con I131, se pueden emplear diferentes métodos de cálculo de masa como el ultrasonido (US), la gammagrafía (GG-2D) y SPECT (3D). Se calculó la dosis con la aplicación computarizada en Matlab (Caldos T), para el cálculo de la dosis de I131 a administrar durante los tratamientos de hipertiroidismo, que utiliza este tipo de imágenes o la información del ultrasonido22. Se analizó el impacto en la estimación de dosis planificada del método de cálculo de la masa, de los parámetros farmacocinéticos del paciente y de los métodos de cálculo para la actividad a administrar por paciente, prescrita por uno sólo de los especialistas. Se calcularon las diferencias absolutas y relativas tomando como referencia la masa de US, que hasta hoy es el método más usado para estimar volumen tiroideo1,8,23. Para evitar la variabilidad inter-observador de los resultados de la masa del tiroides, se estimó este parámetro por un sólo especialista, que empleó el mismo equipo y las medidas se tomaron previo al comienzo del estudio de captación.
Para ilustrar las diferencias dosimétricas producidas por la variabilidad inter-especialistas, se empleó la dosis calculada para uno sólo de los métodos. En este caso, empleamos la ecuación 3 y la masa tiroidea brindada por ultrasonido (US). Para el análisis estadístico de todas las variables de estudio, se empleó el programa IBM-SPSS Statistics 2011, versión 20. La significación estadística de las variables numéricas cuantitativas como el índice de captación, la actividad, las masas, las dosis promedio y los tiempos efectivos que poseen valores de referencia, se evaluaron con la prueba de Wilcoxon de rangos con signo para muestras relacionadas, considerando un nivel de significación de ( = 0,05.
La comparación entre los tres observadores independientes, se realizó a través de la prueba de Friedman para varias muestras relacionadas con el mismo nivel de significación. La correlación entre los observadores se investigó con el análisis de correlación de Pearson. Todo resultado de p≤0,05, se consideró significativo de acuerdo al nivel de significación fijado. Las ecuaciones matemáticas descriptivas de la farmacocinética del tiroides se evaluaron a partir de los índices de correlación (R2, del inglés adjusted R-square) mayores de 0,95.12,24
Resultados
Los datos clínicos que caracterizan la muestra empleada en el estudio se resumen en la tabla 1. Se incluyen, además, los valores medios y la desviación estándar (DE), que caracterizan a las variables numéricas descritas.
Tabla 1 Datos clínicos que caracterizan la muestra de 10 pacientes en estudio
| Paciente | Edad | Teff calculado por el captor (días) | Máximo de captación % | Masa del tiroides estimada por US (g). | Diagnóstico | Actividad prescrita por M1 (MBq) |
|---|---|---|---|---|---|---|
| PA1 | 39 | 3,94 | 61,7 | 10,9 | GB | 296 |
| PA2 | 64 | 5,02 | 61,9 | 77,0 | GB | 444 |
| PA3 | 52 | 5,6 | 63 | 26,6 | GB | 296 |
| PA4 | 26 | 7,01 | 52 | 14,7 | Adenoma tóxico | 555 |
| PA5 | 48 | 5,67 | 63 | 33,6 | BMN difuso | 296 |
| PA6 | 39 | 7,4 | 50,2 | 26,9 | Adenoma tóxico | 555 |
| PA7 | 44 | 6,35 | 79,4 | 28,9 | GB | 296 |
| PA8 | 46 | 6,2 | 78,4 | 70,2 | GB | 444 |
| PA9 | 41 | 3,37 | 72 | 12,3 | GB | 259 |
| PA10 | 25 | 7,4 | 50,8 | 21,11 | GB | 296 |
| Promedio | 42,40 | 5,80 | 63,24 | 32,21 | 373,7 | |
| DE | 11,56 | 1,38 | 10,66 | 23,10 | 115,0 |
GB: Enfermedad de Graves Basedow, BMN:-Bocio multinodular
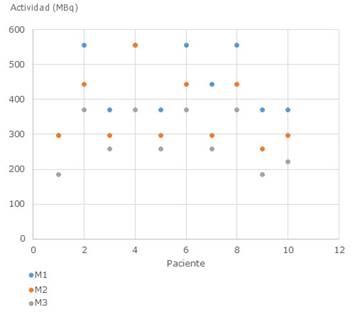
Las dosis prescritas como promedio a los pacientes, por los tres especialistas, fueron de 444,0 ± 101,7 MBq, 362,6 ± 99,9 MBq y 284,9 ± 78,1 MBq, las cuales arrojaron diferencias significativas. La figura 1, muestra las dosis prescritas por ellos. (p<0,01).
Las masas calculadas, así como las diferencias absolutas (DA) y relativas (DR) en la estimación del parámetro por ultrasonido (US), gammagrafía (GG-2D) y SPECT (3D) se muestran en la tabla 2. Se tomó como referencia el US, que es la técnica más usada en la actualidad para desarrollar esta estimación.1,18,23 Las diferencias entre la masa calculada por US y por SPECT, alcanzó una diferencia absoluta máxima de 5,7 g, mientras que las diferencias relativas alcanzaron 27,02 %.
Tabla 2 Resultado del cálculo de masa por US, Gammagrafía 2D y SPECT 3D, para los 10 pacientes de la muestra. Diferencias absolutas y relativas con respecto al US
| Paciente | Masa US (g) | Masa GG 2D (g) | DA (g) | DR (%) | Masa SPECT 3D (g) | DA (g) | DR (%) |
|---|---|---|---|---|---|---|---|
| PA1 | 10,95 | 8,09 | 2,86 | 26,1 | 12,67 | -1,72 | -15,8 |
| PA2 | 76,97 | 65,35 | 11,62 | 15,1 | 71,64 | 5,33 | 6,93 |
| PA3 | 26,55 | 22,38 | 4,17 | 15,7 | 23,71 | 2,84 | 10,7 |
| PA4 | 14,66 | 15,24 | -0,58 | -4,0 | 14,04 | 0,62 | 4,2 |
| PA5 | 33,59 | 31,65 | 1,94 | 5,8 | 31,19 | 2,40 | 7,2 |
| PA6 | 26,86 | 23,91 | 2,95 | 11 | 27,81 | -0,95 | -3,6 |
| PA7 | 28,89 | 26,45 | 2,44 | 8,5 | 24,55 | 4,34 | 15,0 |
| PA8 | 70,24 | 89,93 | -19,69 | -28,0 | 64,83 | 5,41 | 7,7 |
| PA9 | 12,30 | 14,57 | -2,27 | -18,4 | 14,39 | -2,09 | -17,0 |
| PA10 | 21,11 | 21,99 | -0,88 | -4,2 | 26,81 | -5,70 | -27,0 |
| p | 0,285 | 0,386 | |||||
Los resultados de la estimación de la dosis absorbida en la tiroides, con los tres métodos 1D, que reflejan las características de la biodistribución y farmacocinética paciente específica, se muestran en la figura 2.
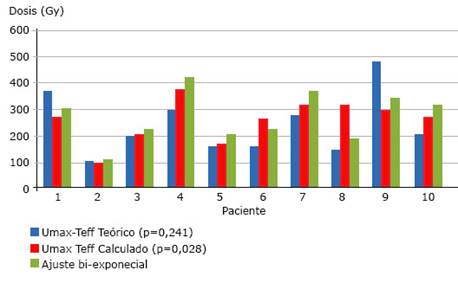
Fig. 2 Dosis absorbida estimada en el tiroides empleando tres métodos de estimación de la farmacocinética.
Las diferencias entre las dosis calculadas por el método que emplea el Teff teórico y el de referencia no fueron significativas (p=0,241), mientras que las introducidas por el ajuste a una sola exponencial versus referencia si lo fueron (p=0,028). Los valores estimados por el primer método, subestiman la dosis en el 80 % de los casos, mientras que el segundo lo hace en el 90 % de las pacientes. Las dosis estimadas por US y por SPECT 3D, mostraron discrepancias entre -17,7 % y +21,3 %, correspondientes a diferencias de masa de + 4,3g, (SPECT subestima 15,04 %) y -5,7g (SPECT sobrestima el 27,02 %) entre las dos técnicas.
Las dosis estimadas para las actividades prescritas por los tres especialistas para cada paciente se registran en la tabla 3. Las diferencias de dosis observadas fueron significativas (p<0,05). Sin embargo, la concordancia inter-observador osciló entre 88 - 95 %, mostrando una correlación significativa (p = 0,01).
Tabla 3 Dosis estimadas bajo la prescripción de cada especialista para el mismo paciente
| Paciente | Dosis prescrita al tiroides (Gy) por los especialistas | Diferencia de dosis máxima (Gy) | Dosis Recomendada (Gy)14 | Diferencia con DM2 (%) | ||
|---|---|---|---|---|---|---|
| M1 | M2 | M3 | ||||
| p1 | 303 | 303 | 190 | 114 | 150 | 102 |
| p2 | 131 | 104 | 87 | 44 | 150 | -30 |
| p3 | 277 | 222 | 194 | 83 | 150 | 48 |
| p4 | 419 | 419 | 279 | 140 | 400 | 5 |
| p5 | 251 | 200 | 175 | 75 | 150 | 34 |
| p6 | 173 | 216 | 144 | 72 | 400 | -46 |
| p7 | 553 | 368 | 322 | 230 | 150 | 146 |
| p8 | 224 | 179 | 149 | 75 | 150 | 19 |
| p9 | 487 | 341 | 243 | 243 | 150 | 127 |
| p10 | 393 | 314 | 236 | 157 | 150 | 109 |
| Promedio | 320,9 | 266,7 | 202,0 | |||
| DE | 137,7 | 97,5 | 69,6 | |||
| P<0,05 | p=0,025 | p=0,018 | p=0,005 | |||
En la tabla 3, se observa que el 80 % de los pacientes recibió dosis mayores que las recomendadas para su enfermedad por la SEMN.14 También se observa que, si se toma en cuenta un observador como referencia, la dosis inter-observador podría variar en un rango de -46 % a 146 % para el mismo paciente.
Discusión
La muestra seleccionada evidencia una variabilidad significativa en cuanto a la masa tiroidea, la edad y los parámetros de farmacocinética que la caracterizan. El valor medio del Teff encontrado fue superior en 5,4 % al valor reportado como típico 5,5 d por la SEMN, por no existir mediciones seriadas de farmacocinética.14 Otros autores, reportan diferencias mayores como Andrea Skanjetiet y otros,20 que refieren un valor promedio de 4,63 d, con valores promedio de captación 51 ± 13 % para Graves-Basedow y de 28 ± 5 % en Adenoma y otros.25 Se encontraron también diferencias significativas con Teff de 4,9 ± 0,1 d, 5,9 ± 0,1 d y 5,9 6±0,1 d para la enfermedad de Graves-Basedow, bocio multinodular y adenoma tóxico respectivamente, con valores promedios de captación máxima a las 24 h de 62 ± 1 %, 49 ±1 % y 42 ± 2 %.
Esta variabilidad confirma la necesidad del tratamiento individualizado del paciente, y la diferenciación en las medidas de seguridad radiológica que deberán tomarse en cada caso, teniendo en cuenta el escenario y el desempeño del paciente para garantizar la seguridad de las personas a él vinculadas.
Variabilidad intrahospitalaria de la prescripción de actividad terapéutica
Los estudios sobre la variabilidad inter-observador no son frecuentes y se concentran básicamente en estudios diagnósticos. Un ejemplo, es el estudio sobre la variabilidad en estudios renales con DMSA-Tc99m, que encontró una concordancia entre 70 - 88,9 % en técnicas planares y de 50 - 100 % en SPECT.26 En nuestro caso, la concordancia oscilo en un rango menor, situación que aparentemente puede ser favorable, puesto que los observadores muestran una correlación significativa (p=0,01). Sin embargo, desde el punto de vista dosimétrico para el paciente; la diferencia de actividades prescrita ocasionará diferencias en la dosis que recibe el tiroides, por cualquiera de los métodos calculados, dándole un carácter dependiente del especialista al tratamiento, contrario a los niveles de estandarización y trazabilidad que requiere la medicina moderna de alta calidad y precisión.27,28
Estimación de la masa tiroidea que capta I131 para el cálculo de dosis
Los resultados del cálculo de masa no muestran diferencias significativas entre sí, a pesar de que las tres técnicas están influenciadas por los principios básicos de su obtención.
Como está ampliamente documentado en la literatura, el cálculo de volúmenes por US tiene inexactitudes que usualmente no se tienen en cuenta, que son independientes del método, el operador y el transductor utilizados.1,18,24 Esta inexactitud se basa en primer lugar en la aproximación de que los lóbulos tiroideos asemejan elipsoides en revolución, y como estructura irregular, esto puede subestimar o sobrestimar el volumen hasta un 15 %.29) Se adiciona a esto la incapacidad de estimar diferencias de densidades. La variabilidad inter-observador puede llegar a introducir errores mayores del 30 %.30 Por eso, en este estudio se estimó la masa por ultrasonido por un sólo especialista, que empleó el mismo equipo y las medidas se tomaron antes del comienzo del estudio de captación.
La estimación de la masa por gammagrafía 2D, tiene las mismas deficiencias que el US, pero a esto se suma, que la resolución espacial del método es pobre y el tamaño del píxel es mayor, arrojando mayor incertidumbre a esta estimación, La diferencia absoluta entre ambos métodos alcanza los 19,7 g; mientras que las relativas llegan a 28 %. La ventaja de la gammagrafía 2D es que su valor se relaciona con la masa captante que recibirá la dosis de radiación objeto de tratamiento. Por eso, su utilización no se desestima en la práctica actual y su uso satisfactorio ha sido evidenciado por múltiples autores con buenos resultados en el control de la enfermedad.20
Las mayores diferencias entre la masa calculada por US y por SPECT, se observan en los volúmenes pequeños, pues los tamaños de vóxel introducen errores discretos en la estimación del volumen, que ganan mayor importancia mientras menor es la masa del órgano. Se reportan inexactitudes entre 6 - 20 %, aunque con una buena correlación entre la resonancia magnética (RMN), la tomografía computarizada (TC) y la gammagrafía en cuanto a la estimación de dicho volumen/masa.30 En el caso de este estudio, durante la verificación de la sensibilidad y la obtención del valor de corte automático para el volumen captante de yodo, el volumen por SPECT del maniquí, discrepó un máximo de 7,01 % (1,3 ml), para valores pequeños de actividad donde la estadística de la medida es baja.
En los últimos años, se han introducido nuevas tecnologías híbridas en la práctica clínica de la medicina nuclear. El uso del SPECT/CT (equipo híbrido que combina la tecnología SPECT con la tomografía computarizada) gana adeptos para determinar la masa funcional para tratamiento y para la obtención de la distribución 3D de actividad/dosis. Este equipo aporta información valiosa para la dosimetría y mejora la exactitud del tratamiento y sus resultados, fundamentalmente en los casos donde la distribución de actividad es no-homogénea y existen diferencias de captación dentro del tejido.12,27,31
Resultados del cálculo de dosis para los diferentes métodos de cálculo de masa del tiroides
A pesar de que la diferencia entre las dosis calculadas por los tres métodos de estimación de la masa no fue significativa, existen diferencias numéricas absolutas y relativas que podrían tener implicaciones en el éxito del tratamiento, si tenemos en cuenta la evidencia de radioterapia externa, donde diferencias de ± 5 % tienen implicaciones en la tasa de éxito del control tumoral.
La gammagrafía sobrestimó significativamente la dosis en 4 pacientes y en 6 las subestimó. Es opinión de los autores de este trabajo, que el cálculo dosimétrico empleando la masa por técnicas 2D no aporta beneficios significativos a la planificación del tratamiento. Este criterio está fundamentado en la incertidumbre asociada a la estimación de la masa tiroidea por esta técnica; aunque como recomiendan los consensos de las Sociedades Americanas y Europeas de MN,14 esta técnica posee alto valor diagnóstico para confirmar el tipo de enfermedad de base y definir la línea de tratamiento que se prefiere.
Las dosis calculadas por el SPECT fueron inferiores en 6/10 pacientes, lo que implica que, las actividades a administrar, si se emplea el US, están subestimadas en el 60 % de los casos si se desea prescribir en unidades de dosis, como lo hace radioterapia externa y es la tendencia más actual para la radioterapia metabólica (RTM).12,27 El US ha sido ampliamente usado como referencia para suministrar la masa tiroidea para las variantes de cálculo de dosis paciente-específica. Sin embargo, los resultados no han sido los esperados y muchos autores se lo atribuyen precisamente a la incapacidad de reflejar la correspondencia masa física-masa captante de forma exacta, o de tener en cuenta la presencia de componentes quísticos o necrosis dentro del tiroides, que puede ser heterogéneo en estas enfermedades.1,18,30
El uso del SPECT y el SPECT/CT tiene pocos antecedentes bibliográficos en el caso concreto del tiroides. Tampoco existen estudios sólidos que valoren los resultados utilizando esta técnica, de manera que no se han evidenciado las bondades de este cálculo.10 Sin embargo, la experiencia en la planificación de otras terapias tumorales con radiofármacos avala ampliamente su uso para dosimetría paciente específica, por su capacidad de mostrar las variaciones en la distribución de actividad en los volúmenes blanco de estudio y su potencial para optimizar los resultados.10,11,12
Diferencias introducidas por los parámetros de farmacocinética paciente específicos disponibles
Desde el punto de vista radiobiológico, durante los procedimientos de radioterapia, se ha comprobado que diferencias mayores del -5 % de la dosis prescrita en el volumen clínico blanco, pueden conducir a la falta de control de la enfermedad y mayores del 5 % pueden conducir a efectos secundarios no deseados.15 Las discrepancias relativas encontradas entre los diferentes métodos, es en la mayoría de los casos mucho mayor que ese valor. Este nivel de tolerancia de radioterapia no es extrapolable a tratamientos de medicina nuclear. Sin embargo, constituye un nivel de referencia sobre el impacto que pudieran tener discrepancias significativas de dosis al tiroides 28
Estas diferencias encontradas, justifican el uso del modelo matemático que mejor refleje la situación clínica y disminuya el error de la estimación de dosis. Incluso aunque requiera el aumento del número de mediciones durante la captación, a un valor que, como mínimo permita la estimación adecuada de la función doble exponencial que describe las características individuales del paciente.12,20 Estos resultados coinciden con los encontrados por otros autores y demuestran la validez de la implementación de técnicas que describan correctamente el proceso biológico que se estudia, apuntando a una mejor caracterización diagnóstica y a la planificación dosimétrica más eficaz.28
Impacto de la variabilidad interespecialista en el cálculo de dosis
Las dosis estimadas para las actividades prescritas de los tres especialistas para cada paciente, mostraron diferencias significativas. Esto se traduce en el alto impacto del tratamiento no individualizado para cada paciente, pues los resultados a lograr con esta terapéutica, serían dependientes del galeno que los atienda. Los rangos de variación de la dosis terapéutica prescrita para el mismo paciente oscilan entre 44Gy y 243Gy. Las indicaciones de dosis al tejido tiroideo recomendadas en la literatura y referidas en las guías de las Sociedades Americanas y Europeas como efectivas, oscilan entre los 150-400 Gy.9,10,14,20
Nuestro estudio confirma que las actividades fijas producen dosis en el tejido inferiores o superiores a las recomendadas como efectivas y seguras, y que el proceso es acrecentado por la variabilidad inter-especialista. Esta situación trae aparejada una falta de optimización de las dosis para esta exposición médica, que incumple con el principio de “dosis tan baja como sean razonablemente alcanzable para obtener los resultados esperados de la práctica”. Este fenómeno no sólo tiene implicaciones para el paciente, sino también para los familiares, amigos y colegas de trabajo, que se exponen a las radiaciones que este emite durante su tratamiento ambulatorio, produciéndole dosis mayores que las necesarias.
L Vija y otros,9 describieron actividades para tratamientos empíricos de 564±131MBq, que arrojaron dosis entre 974 ± 597 Gy, significativamente mayores que las recomendadas por SEMN.14 Las mismas oscilaron entre 316 ± 319 Gy (p<0,001), con una sobre-exposición promedio del 72 % de los pacientes que recibieron mayor dosis que la máxima recomendada en las guías. En este trabajo, los resultados de control de la enfermedad fueron del 91 % en enfermedad de GB y 93 % en pacientes con bocio multinodular, con 86 % y 34 % de hipotiroidismo respectivamente. Este estudio demostró que, elevar la actividad de forma indiscriminada, no logra siempre el resultado deseado e incrementa los efectos secundarios. Nuestro trabajo muestra que la relación dosis promedio versus efecto podría estar modulada por la distribución 3D de la dosis en el tiroides y por otros parámetros radiobiológicos que esta dosis promedio no describe. Por eso varios autores, abogan por la optimización y la seguridad que esquemas paciente-específicos, y el uso futuro de otras variables descriptivas más representativas que la dosis promedio12,27,28 Este estudio apoya esta recomendación, documentándola con la disponibilidad de herramientas en el escenario nacional que permiten su implementación a diferente escala.
Finalmente, se puede aseverar que, la prescripción de actividad inter-especialista mostró diferencias significativas, que arrojan, sobre el mismo paciente una discrepancia entre 44Gy y 243Gy, rango de dosis realmente significativo que puede comprometer el éxito del tratamiento y la presencia de efectos secundarios no deseados. La comparación de las diferencias dosimétricas que producen las aproximaciones farmacocinéticas y los métodos de cálculo de la masa tiroidea a tratar, muestran resultados a favor del uso de la farmacocinética paciente específica completa y, en los casos que sea posible, los métodos 3D para estimar la masa a tratar.