My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Fitosanidad
On-line version ISSN 1818-1686
Fitosanidad vol.13 no.2 Ciudad de la Habana Apr.-June 2009
Control biológico
Actividad antifúngica in vitro de la quitosana Sigma frente a hongos fitopatógenos causantes del manchado del grano en el cultivo de arroz (Oryza sativa L.)
Antifugal Activity in vitroof Chitosan Sigma on Patogen Fungi that Cause Spotted Grain in Rice (Oryza sativa L.)
Deyanira Rivero González¹, Ariel Cruz Triana¹, Benedicto Martínez Coca², Miguel Á. Ramírez Arrebato¹ y Aida T. Rodríguez Pedroso¹
¹Estación Experimental de Arroz Los Palacios, Instituto Nacional de Ciencias Agrícolas. Carretera La Francia, Km 1½, Los Palacios, Pinar del Río, Cuba, CP 22900, deyanira@inca.edu.cu
²Centro Nacional de Sanidad Agropecuaria. Autopista Nacional y Carretera de Jamaica, Apdo. 10, San José de las Lajas, La Habana, CP 32700
RESUMEN
Mediante el método de envenenamiento del medio de cultivo papa dextrosa agar se determinó la actividad antifúngica in vitro de diferentes concentraciones (300, 500, 700 y 1000 mg/L) de la quitosana comercial Sigma, sobre el crecimiento micelial y la esporulación de los hongos fitopatógenos causantes del manchado del grano en arroz Alternaria padwickii (Ganguly) Ellis, Bipolaris oryzae (Breda de Haan) Shoemaker, Curvularia lunata (Wakker) Boedijn, Fusarium verticillioides (Saccardo) Nirenberg, Phoma sp. Saccardo y Sarocladium oryzae (Sawada) Gams & Hawksworth. La quitosana mostró especificidad en su actividad inhibitoria sobre el crecimiento micelial de los hongos, que fue máxima a la concentración de 1000 mg/L, excepto para Phoma sp. Se observó además acción fungicida del polímero sobre A. padwickii y B. oryzae, y fungistática sobre el resto de los hongos, con retraso del crecimiento sobre F. verticillioides.También se obtuvo reducción en la esporulación a medida que se incrementó la concentración de producto. Esto hace de la quitosana Sigma una alternativa promisoria para el manejo de la enfermedad.
Palabras claves: quitosana, hongos patógenos, manchado del grano, arroz
ABSTRACT
The antifungal activity of commercial chitosan Sigma at concentrations of 300, 500, 700 and 1000 mg/L on mycelial growth and sporulation of the rice spotted grain pathogen fungi Alternaria padwickii (Ganguly) Ellis, Bipolaris oryzae (Breda de Haan) Shoemaker, Curvularia lunata (Wakker) Boedijn, Fusarium verticillioides (Saccardo) Nirenberg, Phoma sp. Saccardo and Sarocladium oryzae (Sawada) Gams & Hawksworth was determined in vitro through the poisoning Potato-Dextrose-Agar media. Chitosan showed specificity in its inhibitory activity on fungi mycelial growth, and it was highest at concentration of 1000 mg/L, except for Phoma sp. Fungicidal action of the polymer on A. padwickii and B. oryzae was observed also and fungistatic action on the rest of fungi, with delayed growth on F. verticillioides. Fungal sporulation reduction while the concentration product increased was obtained. That is why chitosan Sigma is considered a promising alternative for the disease management.
Key words: chitosan, pathogen fungi, spotted grain, rice.
INTRODUCCIÓN
El arroz constituye la base de la dieta de la población cubana, con un consumo per cápita anual muy superior al de los restantes países de la región; sin embargo, la producción nacional satisface solamente una tercera parte de la demanda. Dada la situación de emergencia alimentaria mundial se hace necesario enfrentar las causas fundamentales que afectan el rendimiento de cereal.
Una de estas causas es la incidencia de numerosas enfermedades, que son favorecidas por las condiciones climáticas y las tecnologías de siembra del cultivo [IIA, 2006]. Dentro de estas, el manchado del grano incide de forma negativa sobre componentes del rendimiento al producir alto porcentaje de vaneo, afectar la germinación entre el 26 y el 41%, así como el vigor y tamaño de las plántulas; disminuye el número de granos por panícula y el peso de los granos hasta el 40%, y el llenado en el 30% [Cordero y Rivero, 2001; Pinciroli et al., 2003]. Por otra parte, demerita la calidad de la semilla, pues reduce el número de granos enteros, incrementa tanto los granos quebradizos en el proceso de molino como los yesosos y de coloración anormal [Cisterna et al., 1994]. Los agentes fungosos causales del manchado se transmiten a través de la semilla, lo que trae aparejada la incidencia de estos patógenos en otras etapas fenológicas del cultivo y conducen, en última instancia, a las mermas en los rendimientos del cereal [Gutiérrez et al., 2001].
Las medidas técnicas del cultivo incluyen aplicaciones foliares preventivas de fungicidas sintéticos, en distintas fases del ciclo del cultivo, y tratamiento químico a la semilla. No obstante, la enfermedad persiste en las áreas de siembra. Es por eso que se trabaja en la búsqueda de nuevas alternativas que permitan un mejor manejo. En este sentido, diferentes estudios indican que la quitosana tiene la potencialidad de inhibir el crecimiento micelial de numerosos hongos fitopatógenos y de estimular los mecanismos de defensa de las plantas [Synowiecky y Al-Khateeb, 2003; Hernández, 2004; Chien y Chou, 2006; Eweis et al., 2006]. El objetivo del trabajo consistió en determinar el efecto in vitro de la quitosana Sigma sobre el crecimiento y desarrollo de hongos fitopatógenos causantes de manchado del grano en arroz.
MATERIALES Y MÉTODOS
En los diferentes ensayos para determinar el crecimiento micelial de los hongos causantes del manchado del grano se utilizó la quitosana comercial (Sigma), con grado de desacetilación de 90,5 y masa molecular de 8,0 x 105 [Ramírez et al., 2006]. Se emplearon los aislamientos de los hongos patógenos de granos de arroz Alternaria padwickii, Bipolaris oryzae, Curvularia lunata, Fusarium verticillioides, Phoma sp. y Sarocladium oryzae, pertenecientes al Laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria. El trabajo experimental se realizó en el propio centro en el período 2004-2006.
El efecto de la quitosana se determinó mediante el método de envenenamiento del medio de cultivo PDA, a las concentraciones efectivas del compuesto de 0 (tratamiento control), 300, 500, 700 y 1000 mg/L. Se sembraron discos de micelio de 0,5 cm de diámetro de cada aislamiento en el centro de placas Petri con medio envenenado, ajustado a pH 5,2; a razón de un disco por placa con cuatro repeticiones. Los discos miceliales se obtuvieron de la periferia de las colonias a partir de cultivos fungosos puros de cinco días de edad, en medio PDA, incubado en oscuridad a una temperatura de 26 ± 2ºC. Se midió el diámetro de las colonias (en centímetros) desde los tres y hasta los siete días, se le restó el diámetro del disco sembrado y se calculó el porcentaje de inhibición del crecimiento micelial mediante la fórmula:
% Inhibición = [(1 _ (diámetro de la colonia tratada / diámetro de la colonia control)] x 100
Se determinó además la velocidad de crecimiento de los patógenos (en centímetros por hora) a los tres, cuatro, cinco, seis y siete días, mediante la razón del crecimiento fúngico relativo (incremento del diámetro de la colonia en un intervalo de tiempo) sobre el intervalo de tiempo transcurrido.
La actividad fungicida se verificó en las variantes, donde se obtuvo el 100% de inhibición del crecimiento fúngico. Para ello se sembraron los discos (de manera invertida) de estas variantes en medio PDA sin quitosana, y se incubaron en las condiciones descritas anteriormente.
Se midió el diámetro de cada colonia (en centímetros) desde los tres hasta los siete días y se utilizó como control un cultivo del hongo crecido a partir de un disco de micelio no tratado con quitosana, sembrado e incubado en las mismas condiciones que los tratados.
Transcurridos siete días del ensayo de inhibición del crecimiento micelial, se añadieron 10 mL de agua destilada estéril a cada placa de cultivo, se removieron con una espátula de vidrio flameada y se realizaron diluciones 1:10 en todos los tratamientos, a fin de determinar el efecto de la quitosana sobre la esporulación de los hongos patógenos.
La concentración de conidios se determinó mediante el empleo de la cámara de Thoma. También se determinó la producción de conidios por unidad de área de crecimiento fúngico (conidios por centímetro cuadrado) según la fórmula:
![]()
donde:
c: conidios/unidad de área
r: radio de crecimiento del hongo
Para la realización de estos ensayos se utilizó un diseño completamente aleatorizado. Con los datos correspondientes a los porcentajes de inhibición y velocidad de crecimiento se realizó un análisis de varianza simple para cada patógeno en cada momento de evaluación. El análisis de la actividad fungicida se realizó mediante la prueba de comparación de medias con muestras independientes a través del estadígrafo t de student. Los datos correspondientes a la concentración de conidios y la producción de conidios/unidad de área se transformaron mediante la expresión ![]() y se procesaron a través de un Anova simple. Las medias se docimaron mediante la prueba de rangos múltiples de Duncan (p < 0,05).
y se procesaron a través de un Anova simple. Las medias se docimaron mediante la prueba de rangos múltiples de Duncan (p < 0,05).
RESULTADOS Y DISCUSIÓN
En todos los tratamientos con quitosana y en todos los momentos evaluados se observó una reducción del crecimiento micelial del patógeno respecto al control (Tabla 1). De forma general el porcentaje de inhibición de ese crecimiento se acentuó a medida que se incrementó la concentración de quitosana; sin embargo, no presentaron diferencias significativas los tratamientos 500, 700 y 1000 mg/L de quitosana Sigma para C. lunata.
Se alcanzó una alta inhibición a la concentración de 700 mg/L y el valor máximo (100%) para la concentración de 1000 mg/L, para todos los patógenos evaluados, excepto Phoma sp.; a 700 mg/L se observó además la inhibición total para S. oryzae; sin embargo, Cruz et al. (2005) obtuvieron el 30% de inhibición del hongo S. oryzae a la concentración de 1000 mg/L de la quitosana Q-63, con el 63% de desacetilación mediante un método en el cual se expone el patógeno al producto durante un tiempo menor. Una de estas dos causas pudo haber influido en los resultados.
El hongo fitopatógeno Phoma sp. fue el que menos se afectó. La mayor inhibición se obtuvo con 700 y 1000 mg/L de quitosana Sigma (51 y 81%, respectivamente a los tres días), sin diferencia entre ellos a partir de los seis días y con valores inferiores al 40%. Tanto en este como en otros tratamientos hubo una reducción del porcentaje de inhibición final; pero generalmente siguieron la misma tendencia de incremento respecto a la concentración, y mostraron la potencialidad del compuesto de inhibir el crecimiento micelial de este patógeno.
El efecto de las quitosanas sobre otros hongos fitopatógenos también ha sido alentador. Tales son los casos de los patógenos del arroz Rhizoctonia solani y Pyricularia grisea, que al ser tratados con quitosana Q-63 y su hidrolizado a la concentración de 1000 mg/L mostraron el 100% de inhibición del crecimiento [Parra y Ramírez, 2002; Rodríguez et al., 2003]. En ensayos in vitro con Phytophthora parasitica se alcanzaron niveles cercanos al 90% de inhibición mediante el empleo de quitosana y sus hidrolizados enzimáticos [Falcón et al., 2004]. El Hassni et al. (2004) obtuvieron el 75% de inhibición del crecimiento de F. oxysporum Schlechtendahl f. sp. albedinis (Killian & Maire) Gordon a la concentración de 1000 mg/L de quitosana en medio sólido, y total inhibición en medio líquido; esto pudiera explicar que algunas diferencias en los resultados dependen del tiempo de contacto del producto con los patógenos, aspecto que ha de tenerse en cuenta para su aplicación práctica.
No obstante los excelentes resultados a la concentración de 1000 mg/L de quitosana Sigma, hay especies como Rhizopus stolonifer, Phytophthora infestans (Montagne) de Bary y Fusarium oxysporum que requirieron elevadas concentraciones (4000 mg/L) para lograr una alta inhibición [Pombo, 1996]. En un estudio de actividad antimicrobiana de derivados de quitosana fueron necesarias concentraciones de hasta 10 000 mg/L contra F. oxysporum, y sin embargo no lograron inhibir los hongos Rhizopus nigricans Ehrenberg yGloeosporium fructigenum Berk. [Peng et al., 2005].
De forma general se demuestra, al igual que con los resultados de los autores anteriores, que existe diferencia en la inhibición del crecimiento en dependencia del género al que pertenecen los hongos, es decir, que hay especificidad en la actividad inhibitoria.
Al analizar las velocidades de crecimiento de los principales patógenos de la semilla de arroz (Tabla 2) se aprecia que fueron generalmente similares o inferiores a las del tratamiento control, con excepción de algunos tratamientos para Phoma sp. a los seis y siete días.

Se alcanzaron reducciones mayores de la mitad de la velocidad de crecimiento respecto al control no tratado, y un valor nulo de velocidad para todos los patógenos a la mayor concentración, excepto para Phoma sp. En este patógeno se logró una reducción de la velocidad de recimiento en algunas variantes durante las primeras evaluaciones.
Para los hongos A. padwickii, B. oryzae, C. lunata, F. verticillioides y S. oryzae, la acción de la quitosana sobre la velocidad de crecimiento fue al parecer la causa de la reducción final del crecimiento micelial de los fitopatógenos, lo que evidencia el efecto fungistático de este producto.
La quitosana Sigma mostró una acción fungistática sobre el hongo Phoma sp. al inhibir su crecimiento micelial respecto al tratamiento sin quitosana (Tabla 1); no obstante, no se llegó a una total inhibición del crecimiento, y por lo tanto no tuvo efecto fungicida sobre él.
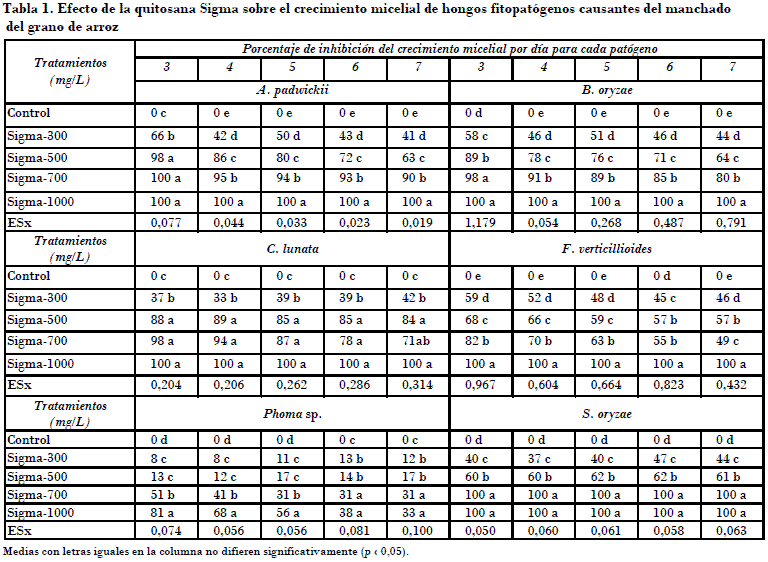
Independientemente de estos resultados, a la concentración de 1000 mg/L este compuesto mostró actividad fungicida sobre los hongos A. padwickii y B. oryzae, pues no presentaron viabilidad al colocarse en condiciones favorables de cultivo. Con esto se infiere que por la acción del compuesto tuvieran lugar cambios irreversibles en las estructuras vegetativas o reproductivas de estos hongos; sin embargo, en los tratamientos con quitosana Sigma a la concentración de 1000 mg/L frente a C. lunata y F. verticillioides (Figs. 1 A y B), y al hongo S. oryzae (Fig. 1 C) a las concentraciones 700 y 1000 mg/L, al parecer solo se manifiesta una excelente actividad fungistática, ya que los hongos C. lunata y S. oryzae recuperaron rápidamente su normal desarrollo en el medio de cultivo no envenenado, sin afectación aparente en sus hifas o propágulos.
En el caso de F. verticillioides, aunque no se observó efecto fungicida, se apreció un retraso del crecimiento con respecto al control, con diferencia significativa en todas las evaluaciones, lo que pudiera deberse a un efecto fungitóxico residual de la quitosana Sigma a 1000 mg/L o a alguna afectación genética.
La actividad fungicida de la quitosana y de sus diferentes derivados sobre algunos hongos fitopatógenos fue notificada por Rodríguez et al. (2003), quienes la observaron a las concentraciones de 1000 mg/L, y 500 y 1000 mg/L, de una quitosana con el 63% de desacetilación y su hidrolizado, respectivamente, frente a P. grisea. Otros compuestos hidroxipropilados derivados de quitosana han mostrado también actividad biocida contra Coniella diplodiella (Speg.) Petrak& Sydow y F. oxysporum a concentraciones entre 1100 y 10 000 mg/L [Peng et al., 2005].
Los efectos de estos compuestos sobre algunos hongos fitopatógenos no se limitan a cambios fisiológicos o metabólicos, sino que provocan alteraciones morfológicas considerables en el micelio, como es el caso de F. oxysporum f. sp. albedinis, a la concentración de 1000 mg/L de quitosana, que presentó vesículas en el interior de las paredes celulares, vacuolización y posterior pérdida del contenido citoplasmático, además de provocar constricción del plasmalema y deposición de quitina entre este y la pared celular [El Hassni et al., 2004].
En la Tabla 3 se refleja el efecto de la quitosana sobre la esporulación total y la producción de conidios por unidad de área de los hongos patógenos del grano de arroz C. lunata, F. verticillioides y S. oryzae.
Al analizar la esporulación total se observa que todos los tratamientos difieren significativamente del control. La producción de conidios decrece a medida que se incrementa la concentración del compuesto. A la concentración de 1000 mg/L no hubo crecimiento de ninguno de los hongos, y por tanto no se obtuvo esporulación. Esto se observa también para la concentración de 700 mg/L frente a S. oryzae.
Resultados de otros autores [Cruz et al., 2005] muestran reducciones de hasta la mitad de la concentración de esporas de S. oryzae a la concentración de 1000 mg/L de la quitosana Q-63; de macroconidios de F. solani a 700 mg/L, e inhibición total a 1000 mg/L [Eweis et al., 2006]; sin embargo, estos compuestos no solo reducen la esporulación, sino que pueden disminuir la viabilidad de las esporas en más del 90% [Król, 2005].
La producción de conidios por unidad de área (Tabla 3) mostró reducción de manera significativa para las variantes 500 y 700 mg/L frente a C. lunata. En la mayoría de los casos en que hubo inhibición del crecimiento de estos tres patógenos a los siete días (Tabla 1) a las diferentes concentraciones de quitosana, no se detectaron diferencias significativas en cuanto a la esporulación por área, lo que evidencia que no se afectó ese proceso. Aún más, en los tratamientos de 300 mg/L para F. verticillioides y S. oryzae se observó una estimulación de la producción de esporas por área, aspecto importantísimo que ha de tenerse en cuenta para la aplicación práctica del producto.
CONCLUSIONES
• La quitosana Sigma tuvo especificidad en la actividad inhibitoria sobre el crecimiento y esporulación de los hongos patógenos del grano de arroz.
• Se alcanzó la máxima inhibición (100%) del crecimiento y la esporulación de los hongos a la concentración de 1000 mg/L.
• Quitosana Sigma a 1000 mg/L tuvo efecto fungicida sobre Alternaria padwickii y Bipolaris oryzae.
• Phoma sp. fue el hongo que mostró mayor resistencia al tratamiento con quitosana.
REFERENCIAS
Chien, P.; C. Chou: «Antifungal Activity of Chitosan and Its Application to Control Post-Harvest Quality and Fungal Rotting of Tankan Citrus Fruit (Citrus tankan Hayata)», Journal of the Science of Food and Agriculture 86:1964-1969, Inglaterra, 2006.
Cordero, V.; L. E. Rivero: Principales enfermedades fungosas que inciden en el cultivo del arroz en Cuba, Instructivo Técnico del Arroz, Instituto de Investigaciones del Arroz, La Habana, 2001, p. 29.
Cruz, A.; Deyanira Rivero; B. Martínez; M. A. Ramírez; L. A. Maqueira: «Efecto de la quitosana sobre el crecimiento y desarrollo in vitro del hongo Sarocladium oryzae Sawada y la protección de semillas de arroz (Oryza sativa Lin.)», Cultivos Tropicales 26(3):83-86, La Habana, 2005.
El Hassni, M.; M. A. El Hadrami; F. Daayf; E. Ait; I. El Hadrami: «Chitosan, Antifungal Product Against Fusarium oxysporum f. sp. albedinis and Elicitor of Defence Reactions in Date Palms Roots», Phytopathologia Mediterranea 43(2):195-204, Italia, 2004.
Eweis, M.; S. S. Elkholy; M. Z. Elsabee: «Antifungal Efficacy of Chitosan and Its Thiourea Derivatives Upon the Growth of Some Sugar-Beet Pathogens», International Journal of Biological Macromolecules 38(1):1-8, Holanda, 2006.
Falcón, A.; D. Díaz; M. A. Ramírez: «Hidrólisis enzimática de quitosana. Actividad biológica del polímero y sus hidrolizados», Cultivos Tropicales 25(2):81-86, La Habana, 2004.
Gutiérrez, Susana; María A. Mazzanti; S. A. Mazza: «Hongos asociados a granos manchados de arroz», Reunión de Comunicaciones Científicas y Tecnológicas, Secretaría General de Ciencia y Técnica, Universidad Nacional del Nordeste, Corrientes, Argentina, http:// www1.unne.edu.ar/cyt/2001/5-Agrarias/A-052.pdf, 2001 (consultado el 2 de septiembre del 2008).
Hernández, Ileana: «La quitosana: un producto bioactivo de diversas aplicaciones», Cultivos Tropicales 25(3):97-110, La Habana, 2004.
IIA: Instructivo técnico del cultivo de arroz, Centro Nacional de Sanidad Vegetal, Ministerio de la Agricultura, Cuba, 2006.
Król, E.: «Influence of Some Chemicals on the Viability of Phomopsis viticola Sacc. Spores», Journal of Plant Protection Research 45(3):195-203, Polonia, 2005.
Parra, Yanet; M. A. Ramírez: «Efecto de diferentes derivados de la quitina sobre el crecimiento in vitro del hongo Rhizoctonia solani Kuhn», Cultivos Tropicales 23(2):73-75, La Habana, 2002.
Peng, Y.; B. Han; L. Wanshun; X. Xiaojuan: «Preparation and Antimicrobial Activity of Hydroxypropyl Chitosan», Carbohydrate Research 340(11):1846-1851, Inglaterra, 2005.
Pinciroli, M.; M. N. Sisterna; R. Bezus; A. A. Vidal: «Manchado del grano de arroz: efecto de la fertilización nitrogenada», Revista de la Facultad de Agronomía, 105(2):11, La Plata, Argentina, 2003.
Pombo, R.: «Relación estructura-actividad de la quitosana y sus hidrolizados solubles sobre algunos hongos fitopatógenos», Tesis en opción al grado académico de Máster en Química Agrícola, Universidad Agraria de La Habana, 1996.
Ramírez, M. Á.; Aida T. Rodríguez; Liliam Becheram; C. Peniche; L. Alfonso: «Caracterización de derivados de quitina y evaluación de su actividad antimicrobiana sobre hongos patógenos vegetales», Memorias del XXVII Congreso Latinoamericano de Química, Palacio de Convenciones, La Habana, 16-20 de octubre del 2006.
Rodríguez, Aida T.; M. A. Ramírez; M. C. Nápoles; Ramona Márquez; Regla M. Cárdenas: «Antifungal Activity of Chitosan and One of Its Hidrolisates on Pyricularia grisea, Sacc. Fungus», Cultivos Tropicales 24 (2):85-88, La Habana, 2003.
Sisterna, M. N.; G. A. Lori; J. J. Marassi: «Sintomatología y hongos asociados al manchado del grano de arroz en el genotipo Irga 409», Revista de la Facultad de Agronomía, 70(1):13-21, La Plata, Argentina, 1994.
Synowiecky, J.; Nadia A. Al-Khateeb: «Production, Properties and Some New Applications of Chitin and Its Derivatives», Critical Reviews in Food Science and Nutrition 43(2):145-171, Inglaterra, 2003.














