My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Fitosanidad
Print version ISSN 1562-3009On-line version ISSN 1818-1686
Fitosanidad vol.13 no.4 Ciudad de la Habana Oct.-Dec. 2009
Peronospora hyoscyami f. Sp. tabacina. Variabilidad de las poblaciones en Cuba (I)
Peronospora hyoscyami f. Sp tabacina. Variability of Populations in Cuba (I)
Berta Lina Muiño García¹ y Yordanka González Guardiola²
¹Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, CP 11600, bertam@inisav.cu
²Instituto de Investigaciones del Tabaco. Carretera El Tumbadero Km 8½, San Antonio de los Baños, La Habana RESUMEN Se evaluó la capacidad germinativa del hongo Peronospora hyoscyami f. sp. tabacina , el período de incubación y latencia, la capacidad esporulativa e infectiva y el área esporulada en diferentes variedades de tabaco sensibles y resistentes a la enfermedad por el método de discos de hojas flotantes. Los aislamientos procedentes de Holguín, Ciego de Ávila, Pinar del Río, Cienfuegos y La Habana mostraron la capacidad germinativa más elevada. Se observó variabilidad entre los aislamientos por la presencia de períodos de incubación y latencia cortos, como el procedente de Ciego de Ávila y un aislamiento de la provincia de La Habana con períodos de cinco días, área esporulada y capacidad infectiva del 100% y una elevada capacidad esporulativa incluso en variedades resistentes a la enfermedad. Les siguieron los aislamientos de Pinar del Río y algunos de La Habana con períodos de incubación y latencia de seis y siete días, al igual que el área esporulada y capacidad esporulativa en las variedades susceptibles y resistentes a la enfermedad. El aislamiento de Matanzas y uno de La Habana mostraron baja agresividad con los períodos de incubación y latencia más largos (ocho y diez días), menor capacidad infectiva, esporulativa y área esporulada en variedades resistentes a la enfermedad. El aislamiento de Holguín mostró agresividad baja en las variedades resistentes a la enfermedad, con períodos de latencia e incubación largos (ocho y diez días) y baja capacidad esporulativa, infectiva y área esporulada en variedades resistentes, no así en las susceptibles, donde fue más agresivo.
Palabras claves: variabilidad, Peronospora hyocyami f. sp. tabacina, tabaco ABSTRACT The germination capability of Peronospora hyoscyami f. sp. tabacina was assessed along the incubation period and latency. Sporulation and infective capability and the sporulated area on different blue mold sensitive and resistant tobacco varieties were also assessed by floating leaf discs method. Isolates originated from the provinces of Holguín, Ciego de Ávila, Pinar del Rio, Cienfuegos and La Habana showed the highest germination capability. A significant variability was observed among the different isolates, which was particularly evident due to the occurrence of short incubation and latency periods; specially in the isolates obtained from Ciego de Ávila and one specific isolate obtained from La Habana with a five days period, 100% sporulated area and infective capability, and a high sporulation capability even on blue mold resistant varieties. Isolates from Pinar del Río and some others obtained from La Habana were the following ones with incubation and latency periods of six and seven days, and sporulated area and sporulation capability on blue mold susceptible and resistant varieties. The isolate obtained from Matanzas and one from La Habana were less aggressive, with incubation and latency periods of eight and ten days. A lower infective and sporulation capability and sporulated area was also registered for these isolates on blue mold resistant varieties. The Holguin isolate showed a low aggressiveness on the blue mold resistant varieties, with latency and incubation periods of eight and ten days, a low infective and sporulative capability and also a low sporulation and infective capability and sporulation area on resistant varieties although it was much more aggressive on the susceptible ones. Key words: variability, Peronospora hyocyami f. sp. tabacina, tobacco
INTRODUCCIÓN
En los últimos años se han intensificado considerablemente las áreas de plantaciones de tabaco, en las que la introducción de nuevas variedades con diferentes grados de resistencia al moho azul constituye una de las principales medidas para el control de la enfermedad. Este carácter prevalece en especies del género Nicotiana nativas de Australia. En estas especies silvestres hay un alto nivel de resistencia, que se reduce después de transferida a Nicotiana tabacum, mientras que Nicotiana debneyi constituye la principal fuente de resistencia en muchos países de Europa, en Australia y Estados Unidos, y esta propiedad frente a P. hyoscyami f. sp. tabacina reside en ocho cromosomas [Rufty y Main, 1989; FAO, 2002].
Otras especies con resistencia al hongo son N. goodspeedii, N. megalosiphon, N. rosulata [Knotop et al., 1979], N. marirtima [Dorossiev et al., 1978], N. velutina, N. excelsior [Gillham et al., 1977], N exigua [Manolov, 1980], N. otophora [Gajos, 1979], a partir de las que se han obtenido variedades y líneas con diferentes grados de resistencia.
En Cuba se han desarrollado diversas variedades de tabaco con estas características, entre las que se destacan Habana 92, Habana 2000, Habana Vuelta Arriba [Espino et al.,1999], así como SS 96, Criollo 98, Corojo 99, Habana PR, Corojo Especial, Cabaiguán 7, San Juan 1, BH-13 [García et al., 1997]; BR-26, Virginia Resistente, Virginia San Luis 40, Virginia Iso, destinadas a la producción del tabaco con diversos fines en la cadena productiva.
El presente trabajo persiguió como objetivo determinar la variabilidad de las poblaciones de P. hyoscyami f. sp. tabacina a partir de la cuantificación de la capacidad germinativa de los esporangios, períodos de incubación y latencia, la capacidad esporulativa e infectiva y el área esporulada en 13 aislamientos del patógeno, obtenidos de áreas de tabaco de diferentes regiones del país, respecto a diferentes variedades del cultivo resistentes y susceptibles a la enfermedad.
MATERIALES Y MÉTODOS
Durante las campañas de tabaco 2001-2002 y 2002-2003 se realizaron muestreos en las provincias de Pinar del Río, La Habana, Matanzas, Cienfuegos, Ciego de Ávila y Holguín. Una vez que apareció el primer foco de moho azul se colectaron al azar hojas con lesiones y esporulaciones activas del hongo por cada foco de la enfermedad. Se colocaron envés con envés en una bolsa de nailon transparente, con papel de filtro previamente humedecido para mantener altos niveles de humedad relativa, se selló e identificó su procedencia y se trasladaron al laboratorio.
El inóculo se preparó a partir de esporulaciones activas del hongo en hojas, con un pincel se colectaron los esporangios y se preparó la suspensión en agua destilada estéril. La concentración se ajustó entre 1-5 x 104 esp · mL_1 mediante conteo en la cámara de Neubauer.
Para la conservación de los aislamientos se utilizaron plántulas de la variedad Corojo Tradicional obtenidas a partir del cultivo de los semilleros en el laboratorio. Una vez que las pequeñas plántulas alcanzaron 2 cm de altura, alrededor de los 15-20 días de sembradas se trasplantaron a pequeños potes plásticos de 7 x 7 x 10 cm, previamente preparados con suelo estéril. Se sembraron dos plantas por pote, se mantuvieron bajo régimen de luz y oscuridad de 12:12 h sin exceso de humedad hasta que alcanzaron la fase de cuatro a cinco hojas, en la cual se realizó la inoculación de las plantas, para lo que se depositaron de tres a cuatro gotas de 10 ìL de la suspensión en cada una de las hojas, además de los aislamientos conservarse en pequeñas hojas tomadas directamente de los semilleros, las cuales se hicieron flotar en 12 mL de agua destilada estéril en placas de Petri de 10 cm de diámetro. En cada hoja se depositaron 10 ìL de la suspensión de esporangios. Después de la inoculación las placas se incubaron bajo oscuridad completa durante cuatro horas en un cubículo climatizado, a temperatura de entre 16 y 18°C durante la noche, entre 20 y 22°C durante el día, y una proporción de luz-oscuridad de 12:12 h con intensidad 4500 lux y humedad relativa por encima del 95%.
La variedad de tabaco Corojo Tradicional se tomó como referencia por ser susceptible a la enfermedad, respecto a plántulas de tabaco de variedades comerciales susceptibles y resistentes. Los semilleros de cada una de las variedades en estudio se prepararon de acuerdo a como se describió anteriormente.
Para evaluar la capacidad germinativa se depositaron 10 ìL de la suspensión de esporangios a la concentración de 5 x 104 esp · mL_1 en un portaobjetos excavado, y se cuantificó el número de esporangios germinados a las cuatro horas. El conteo se realizó al azar en 100 esporangios y se determinó el porcentaje de los germinados con respecto al total evaluados.
Los indicadores fenotípicos se midieron mediante la inoculación de las variedades de 35 a 40 días de sembradas, con los aislamientos en estudio. Se empleó el método de discos de hojas descrito por Muiño (1990), el cual fue modificado. Se depositaron 7 mL de agua destilada estéril en placas de Petri de 7 cm de diámetro, y se hicieron flotar cinco discos de hojas de 12 mm de diámetro en el agua, para un total de 10 discos en dos placas por variante. Cada disco se consideró como una réplica en todos los experimentos, y para la inoculación se depositó una gota de 10 ìL de la suspensión en cada uno.
En las primeras cuatro horas después de la inoculación todos los ensayos se incubaron bajo oscuridad completa, en un cubículo climatizado a temperatura entre 16 y 18°C durante la noche, y entre 20 y 22°C durante el día; posteriormente se mantuvieron bajo régimen de luz-oscuridad de 12:12 h con intensidad de 4500 lux y humedad relativa por encima del 95%.
El período de incubación se determinó por la cuantificación del número de días desde la inoculación hasta la aparición de las primeras lesiones cloróticas antes de la esporulación, mientras que el período de latencia se evaluó por el conteo del número de días desde la inoculación hasta la detección de las primeras esporulaciones a través del microscopio estereoscopio.
El área del disco esporulada se determinó mediante el porciento que ocupaba la esporulación en el disco a los siete y diez días de inoculados, en cada variedad, para cada uno de los aislamientos. La capacidad esporulativa de los aislamientos en cada variedad se evaluó a los 12 días de inoculados los discos. Los discos esporulados se sumergieron en 0,5 mL de agua destilada estéril, y con ayuda del pincel se recogió toda la esporulación y se realizó el conteo en la cámara de Neubauer para cuatro réplicas.
La evaluación de la capacidad infectiva se realizó mediante la cuantificación del número de discos con presencia de esporulaciones, respecto al total de discos inoculados, y se calculó el porciento para cada aislamiento en cada una de las variedades.
Los datos obtenidos se procesaron estadísticamente mediante análisis de varianza simple con test de significación de Newman Keuls al 5% de probabilidad, con previa transformación de los datos a arcsen x [Dagnelie, 1984]. Para el análisis de agrupamiento se codificaron los datos obtenidos para cada uno de los componentes fenotípicos, se construyó la matriz básica de datos y se procesaron a través del programa estadístico Minitab para Windows versión 11.2 de 1996.
RESULTADOS Y DISCUSIÓN
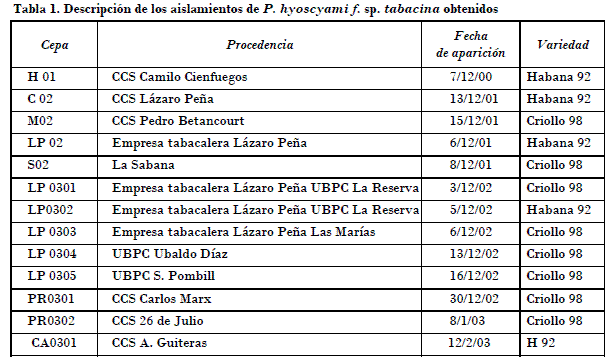
Se obtuvieron trece aislamientos (Tabla 1), siete de La Habana, dos de Pinar del Río, uno de Matanzas, uno de Cienfuegos, uno de Ciego de Ávila y uno de Holguín.
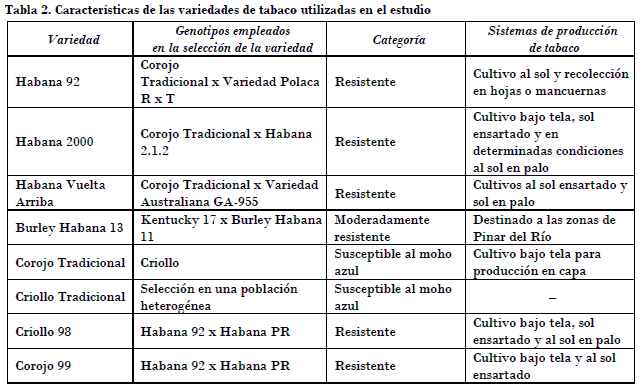
Los parámetros fenotípicos se estudiaron en ocho variedades de tabaco con diferentes grados de resistencia a la enfermedad, las cuales se describen en la Tabla 2.
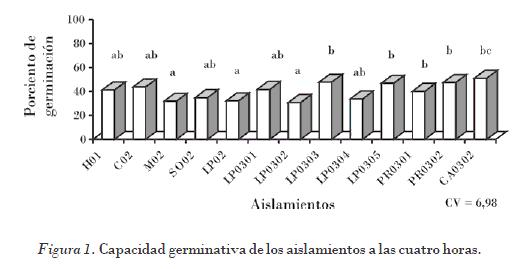
A las cuatro horas los aislamientos que tuvieron la menor capacidad germinativa fueron M02, LP0302 y LP02, un segundo grupo de aislamientos con valores intermedios (H01, C02, S02, LP02, LP0301, LP0303, LP0304, LP0305, PR0301, PR0302 CA0301, LP0305, PR0301, PR0302), y el valor más alto correspondió al aislamiento CA0302 (Fig. 1).
Los resultados muestran valores que oscilan entre el 30 y el 46% de capacidad germinativa, al tercer día después de haberse observado las primeras esporulaciones visibles en las hojas de tabaco. Zheng et al. (1998) plantean que la capacidad germinativa de los esporangios del hongo se encuentra estrechamente relacionada con el tiempo de la esporulación, y que en esporangios con dos días de evidenciada la presencia de esporulaciones visibles presentan valores de germinación del 80%; al tercer día comienza a disminuir y los valores alcanzan entre el 40 y el 30%, los cuales muestran valores similares a los obtenidos en estos resultados.
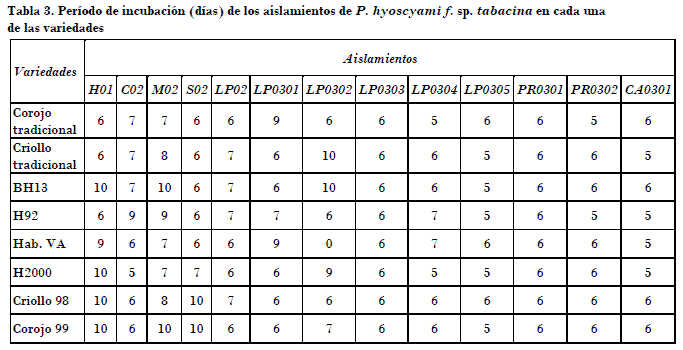
Respecto al período de incubación, la presencia de los primeros síntomas de la enfermedad, caracterizado por el cambio de coloración en los discos de las hojas, varió entre una y otra variedad, y entre los aislamientos. Generalmente estos síntomas se presentaron antes de la presencia de la esporulación del hongo, es decir, el cambio de coloración de un verde intenso a un verde más claro. En la mayoría de los discos se observó el día antes de la esporulación, aunque hubo donde se observaban pequeñas esporulaciones; sin embargo, el cambio de coloración apenas se podía distinguir.
Los aislamientos LP0305 y CA0301 presentaron los períodos de incubación más cortos en discos de variedades de tabaco susceptible y resistente a la enfermedad, seguidos por los procedentes de Pinar del Río y el aislamiento LP0303. Un grupo de aislamientos se caracterizó por presentar períodos de incubación intermedios de siete y ocho días, entre los que se encuentran LP02, SO2, LP0301, mientras que los aislamientos M02 y LP0302 mostraron los períodos de incubación más largos (Tabla 3). El aislamiento H01 mostró períodos de incubación cortos en las variedades susceptibles, no así en las resistentes a la enfermedad, donde se presentaron períodos de incubación más largos de nueve y diez días.
Resalta el aislamiento de Cienfuegos (CO2) con un comportamiento diferenciado frente a los discos de la variedad de tabaco Habana 2000, que mostró un período de incubación de cinco días; sobresale este comportamiento del resto de los aislamientos obtenidos en la primera campaña en esta variedad de tabaco, además de que evidencias prácticas en las áreas de producción confirman la presencia de afectaciones de tipo sistémicas del hongo en condiciones de campo en plantaciones de la variedad de tabaco negro Habana 2000.
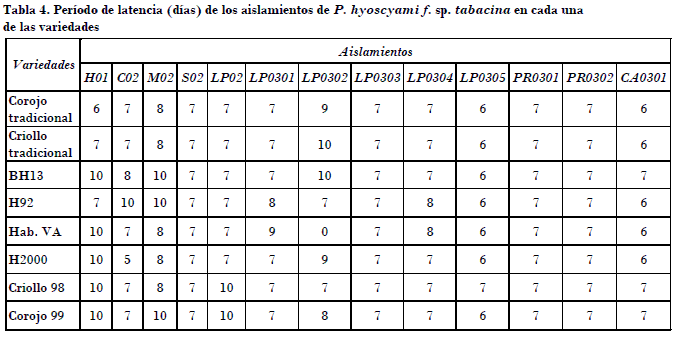
Para el período de latencia existe un comportamiento similar a lo observado respecto al período de incubación. Los aislamientos LP0305 y CA0301 presentaron los períodos de latencias más cortos respecto al resto de los aislamientos en todas las variedades que se evaluaron. Los valores intermedios de períodos de latencias correspondieron a los aislamientos CO2, LP02, LP0301, LP0303, LP0304 y los procedentes de Pinar del Río (Tabla 1), con valores de siete días. El procedente de Matanzas presentó un período de latencia de ocho días, y el más largo fue para el aislamiento LP0302 (Tabla 4).
Es importante destacar que existe una marcada variabilidad entre los aislamientos respecto a estos dos parámetros, y es de notar los períodos de incubación y de latencia más cortos en aislamientos procedentes de las zonas tabacaleras de las provincias de La Habana y Ciego de Ávila. También es necesario señalar que los aislamientos procedentes de la provincia de Pinar del Río mostraron cortos períodos de incubación y latencia. No obstante, se presentó un diverso comportamiento en aislamientos de la provincia de La Habana con períodos de incubación y latencias cortos y largos (LP0302), por lo que es importante el hecho de que en una misma zona geográfica exista variabilidad en este parámetro.
En cuanto al área del disco esporulada, todos los aislamientos procedentes de la segunda campaña de estudio(LP0301, LP0302, LP0303, LP0304, LP0305, PR0301, PR0302 y CA0301) tuvieron los valores más altos de área esporulada en todos los discos evaluados, en cada una de las variedades resistentes a la enfermedad. En las variedades susceptibles, excepto los aislamientos SO2 y LP02 que tuvieron valores inferiores al 50% del área esporulada en la variedad Criollo Tradicional, el resto de los aislamientos superó el 50% de esporulación al igual que los aislamientos H01 y el CO2 procedentes de la primera campaña (Tablas 5 y 6).

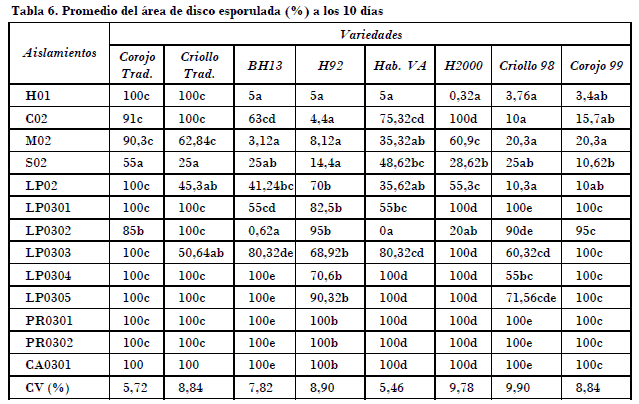
Es de importancia también la correspondencia que existe entre los parámetros de variabilidad fenotípicos anteriores con los aislamientos procedentes de Pinar del Río, Ciego de Ávila y La Habana, los cuales mostraron un valor alto del área de disco esporulada a los siete y diez días, aislamientos que fueron obtenidos precisamente en zonas de grandes áreas destinadas a la producción, y donde se presentan severas afectaciones del hongo en variedades supuestamente resistentes a la enfermedad.
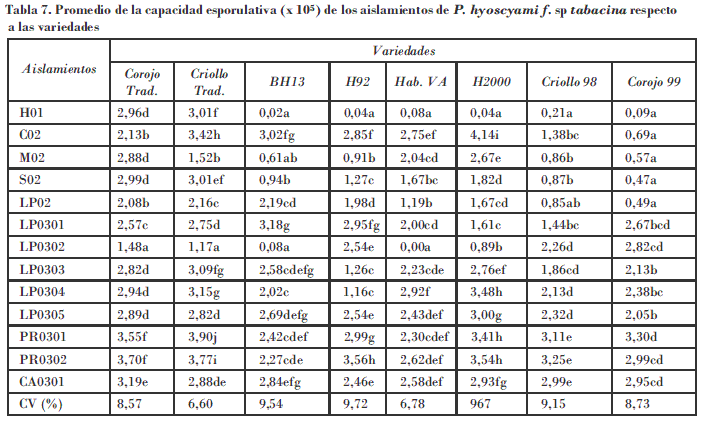
Hubo una alta capacidad esporulativa en la variedad susceptible Corojo Tradicional. Se destacan los aislamientos procedentes de Pinar del Río, Ciego de Ávila y LP0305. Es interesante en este parámetro el comportamiento del aislamiento de Cienfuegos con valores que llegaron a alcanzar 4,14 x 105 esp/cm2 en la variedad Habana 2000; sin embargo, esta combinación aislamiento-variedad presentó períodos de incubación y latencia cortos, y mayor área de disco esporulada a los siete y diez días.
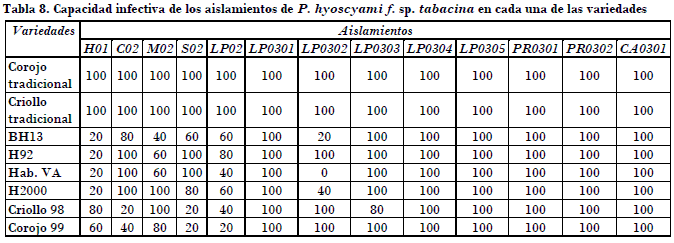
Por otra parte, todos los aislamientos presentaron una capacidad infectiva alta en los discos de las variedades susceptibles Corojo Tradicional y Criollo Tradicional (Tabla 8). Los aislamientos LP0301, LP0303, LP0304, LP0305, PR0301, PR0302 y CA0301 alcanzaron el 100% en los discos de las variedades resistentes, a diferencia del aislamiento LP0302, que presentó baja capacidad infectiva en los discos de las variedades BH13 y Hab 2000, y no infectó los discos de la variedad Hab. VA. El aislamiento procedente de Holguín mostró una baja infectividad frente a los discos de las variedades resistentes a la enfermedad.
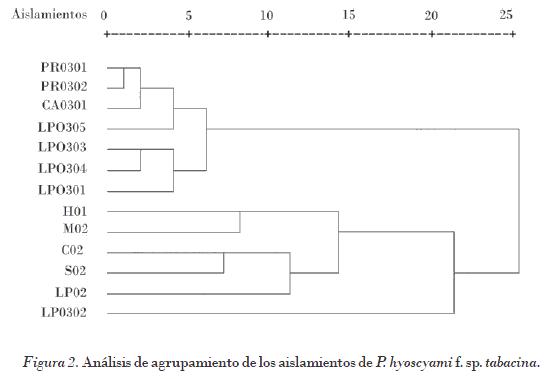
El carácter área de disco esporulada permitió separar los aislamientos en dos grandes grupos (Fig. 2). En un primer grupo se encuentran los aislamientos LP0301, LP0303, LP0304, LP0305, PR0301, PR0302 y CA0301, y en un segundo los aislamientos H01, C02, M02, LP02, S02, y el aislamiento más alejado LP0302.
Dentro del primer gran grupo se encuentra en un subgrupo los aislamientos PR0301, PR0302, CA0301y LP0305, que fueron los más agresivos, los que mostraron los períodos de incubación y latencia más cortos, y presentaron mayores áreas de disco esporulada y las capacidades esporulativas e infectivas más altas. En la zona de Pinar del Río, en la década de los noventa hasta la fecha, se han presentado epidemias severas de la enfermedad, lo que puede estar dado por la presencia de aislamientos agresivos, dado que es una zona donde se cultiva tabaco de forma intensiva. Sobresale también el aislamiento de Ciego de Ávila, aislado de variedades resistentes en condiciones desfavorables para el desarrollo de la enfermedad, y que muestra gran agresividad en todos los parámetros evaluados. Bajo condiciones favorables a la enfermedad, la presencia de aislamientos con estas características puede ocasionar grandes epidemias en la región donde se presenta. Finalmente, el aislamiento LP0305 de La Habana tuvo características similares al procedente de Ciego de Ávila.
En el segundo subgrupo se encuentran los aislamientos que mostraron períodos de incubación, latencia y capacidades esporulativas e infectivas intermedias, y menos agresivos a los aislamientos que se encuentran en el primer grupo.
El aislamiento más alejado en el análisis de agrupamiento es el LP0302, que presentó los períodos de incubación y latencia más largos, las capacidades esporulativas e infectivas más bajas de todos, y por tanto el menos agresivo (Fig. 2).
Por primera vez en Cuba se evidencia la variabilidad de aislamientos de P. hyoscyami f. sp. tabacina referente a parámetros fenotípicos. A nivel mundial pocos estudios se relacionan con la variabilidad fenotípica del patógeno, principalmente por el hecho de ser un parásito obligado, difícil de conservar en condiciones de laboratorio; sin embargo, las investigaciones recientes apuntanhacia el estudio de la variabilidad genética en las poblaciones del hongo, en aislamientos sensibles y resistentes a fungicidas, los cuales muestran variabilidad en su comportamiento. La aplicación de los marcadores moleculares como RADP demostró la existencia de variabilidad genotípica en aislamientos procedentes de diferentes regiones [Wiglesworth et al., 1994; Wiglesworth, 1994]. En Estados Unidos se han utilizado marcadores moleculares no solo para la identificación precoz del hongo, sino para el estudio de la variabilidad de las poblaciones [Sukno et al., 2002a; 2002b; Ristaino et al., 2007]. Estudios realizados por el grupo de moho azul de Coresta confirman la presencia de dos genotipos genéticamente diferentes y que difieren además respecto a la sensibilidad a los fungicidas [Zipper et al., 2007; Spring et al., 2007]. En Cuba se han encaminado también estudios de la genética poblacional, a partir de su interrelación con las respuestas desde el punto de vista epidemiológico y fenotípicas de las poblaciones de P. hyoscyami f. sp. tabacina como contribución a la mejora de las estrategias de manejo de la enfermedad.
CONCLUSIONES
• Se obtuvo un total de 13 aislamientos de P. hyoscyami f. sp. tabacina, dos procedentes de la provincia de Pinar del Río, siete de La Habana, uno de Matanzas, Cienfuegos, Ciego de Ávila y Holguín.
• Los aislamientos de Pinar del Río, Ciego de Ávila y dos de La Habana manifestaron los valores más altos de capacidades germinativas.
• El aislamiento procedente de Ciego de Ávila y el LP0305 de La Habana tuvieron los períodos de incubación y latencia más cortos con cinco días, en variedades susceptibles y resistentes a la enfermedad, mientras que los períodos más largos los mostraron el aislamiento de Matanzas y otro procedente de La Habana.
• Los aislamientos de Pinar del Río, Ciego de Ávila, Cienfuegos y tres procedentes de La Habana mostraron las capacidades esporulativas e infectivas más elevadas en las variedades resistentes a la enfermedad.
• Se demostró que existe variabilidad fenotípica en los aislamientos estudiados, donde los más agresivos proceden de las provincias de Pinar del Río, Ciego de Ávila y La Habana.
REFERENCIAS
Dagnelie, P.: «Theorical Methodes Ststistiques», Les PressesAgronomiquies de Grenmblour 2:242-250, Francia, 1984.
Dorossiev, L.; M. Palakarcheva; L. Stanoeva; L. Petkova: «Overcoming the Sterility in F1 of Interspecific Hybrids of the Genus Nicotiana Using the Methods of Tissue Culture», Bulletin d´ Ínformation Coresta, Special Number 1978, pp. 80 y 81.
Espino, E.; X. Rey; A. L. Pino; G. Quintana; N. Peñalver; C. Baños: «Habana Vuelta Arriba, variedad de tabaco negro para cultivo en la región central y oriental de Cuba», Cubatabaco 1(1):40-44, La Habana, 1999.
FAO: «Selected Texts for Peronospora hyoscyami f. sp. Tabacina», compilación de textos, versión digital, 2002.
Gajos, Z.: «Attempt to Use Hybrids of Nicotiana tabacum L.X Nicotiana otophora Gris. For Breeding Tobacco Resistant to Peronospora tabacina Adam PT2 and Other Diseases», Central Laboratorium. Przemyskie Tyton Biuletin 1(2):11-23, Polonia, 1979. García, H.; V. García; A. L. Pino; E. Espino: «Burley Habana 13 (BH 13), primera variedad comercial de tabaco obtenida en Cuba por cultivo de anteras con resistencia al moho azul (Peronospora tabacina), pata prieta (Phytophthora nicotianae) y al virus del mosaico del tabaco (VMT)», Cubatabaco 1(1):49-54, La Habana, 1997.
Gillham, F. E. M.; D. C. Wark; E. K. S. Harrigan: «Disease Resistant Flue- Cured Tobacco Breeding Lines for North Quessland I. Resistance to Blue Mold, Peronospora tabacina», Australian Journal of Experimental Agriculture and Animal Husbandry, 17(87):652-658,1977.
Knotop, A. I.; R. P. Silanteva; V. A. Vinagrov: «The Resistance of Varieties of Tobacco and Wild Nicotiana Species to Blue Mold», Aktualproblrazvitiya-tabkovod-Moldavii, 1979, pp. 27-34.
Manolov, A.: «The Transference of Peronospora tabacina Resistance from Nicotiana exigua to Oriental Tobacco», BuIgarski-Tyutyun, 25:11-18, Bulgaria, 1980.
Muiño, B. L.: «Plaguicidas. Determinación de resistencia al metalaxil. Peronospora tabacina», NRAG. Minag, La Habana, 1990.
Ristaino, J. B.; A. Johnson; M. Blanco-Meneses; B. Liu: «Identification of the Tobacco Blue Mold Pathogen, Peronospora tabacina, by Polymerase Chain Reaction», Plant Disease 91:685-691, EE. UU., 2007.
Rufty, R. C.; C. E. Main: «Components of Partial Resistance to Blue Mold in Six Tobacco Genotypes Under Controlled Environmental Conditions», Phytopatology 79(5):606-609, EE. UU., 1989.
Spring, O.; S. Keil; R. Zipper: «Field Monitoring Reveals Two Genotypes of Peronospora tabacina in German Tobacco Cultures»,Advances in Downy Mildew Research, Kostelec na Hane, República Checa, 2007, pp. 107-111.
Sukno, S. A.; A. M. Taylor; M. L. Farman: «Development of Contamination- Free Restriction Fragment Length Polymorphism Probes for the Obligate Biotroph Peronospora tabacina, an Oomycete Causing Blue Mold of Tobacco», Phytopathology 92:1227-1235, EE. UU., 2002a.
____: «Genetic Uniformity Among Isolates of Peronospora tabacina, the Tobacco Blue Mold Pathogen», Phytopathology 92:1236-1244, EE. UU., 2002b.
Wiglesworth, M. D.; W. C. Nesmith; M. R. Siegel; M. R. Bonde; C. E. Main: «Distinguishing Isolates of Peronospora tabacina from Geographic Regions Utilizing Tobacco Leaf Disk and Fluorescence Microscopy», Plant Disease 78(5):456-460, EE. UU., 1994.
Wiglesworth, M. D.: «Differentiation and Detection of Peronospora tabacina Adam Using the Polymerase Chain Reaction», PhD Thesis, Department of Plant Pathology, University of Kentucky, Lexington, 1994.
Zheng, Z. Q.; P. S. W; G. Q. Zhong: «Pathological Characteristics of Tobacco Blue Mold for Plant Quarantine», Acta Phytopat. Sinica 28(2):131-138, 1998.
Zipper, R.; R. Hammer; O. Spring: «Spring PCR-Based Monitoring of Recent Isolates of Tobacco Blue Mold from Europe Reveals the Presence of Two Genetically Distinct Phenotypes Differing in Fungicide Sensitivity», University of Hohenheim, Institute of Botany, Garbenstr. 30, 70593 Stuttgart, Alemania, 2007.