Introducción
El pie diabético constituye un grave problema de salud, el cual se presenta con una elevada incidencia en la población diabética. Se caracteriza por importantes repercusiones socioeconómicas y sanitarias, incluyendo la larga estadía hospitalaria, además de la notable disminución en la calidad de vida del afectado.1
Según la Sociedad Española de Angiología y Cirugía Vascular,2 el pie diabético se define como una alteración clínica de base etiopatogénica neuropática, inducida por la hiperglucemia mantenida, en la que, con o sin existencia de isquemia y previo desencadenante traumático, se produce una lesión o úlcera en el pie.
El pie diabético se define, según la Organización Mundial de la Salud (OMS), como la ulceración, infección y/o gangrena de los tejidos del pie, asociada a neuropatía diabética y diferentes grados de compromiso vascular periférico, al ser el resultado de la interacción de diferentes factores metabólicos.3 Constituye una de las principales causas de morbilidad y discapacidad con importante repercusión biológica, sicológica y social, pues disminuye su calidad de vida.4
En la población diabética, dos de cada tres enfermos sufre algún tipo de neuropatía periférica en el momento de su diagnóstico, proceso que está íntimamente ligado con la fisiopatología del pie diabético.5)
Desafortunadamente, después de la cicatrización de una úlcera, la recurrencia es común.1 Al revisar algunos estudios compatibles sobre las tasas de incidencia de la recurrencia de úlcera, se estima que aproximadamente el 40 % de los pacientes tiene una recurrencia al año después de la curación de la úlcera; casi el 60 %, a los tres años; y el 65 %, en 5 años.1,6,7,8
Se plantea que los pacientes diabéticos -entre el 10 % y el 15 %- desarrollan una úlcera del pie diabético (UPD) en algún momento de sus vidas.9
De la población de amputados, cerca del 50 % puede sufrir una segunda amputación de la extremidad contra-lateral en un período de 2-5 años. Esta situación puede agravarse, ya que, tras una amputación mayor, menos del 50 % de los amputados sobrevivirá en los siguientes cinco años.10
En Cuba la prevalencia de la diabetes mellitus (DM) al cierre de 2018 fue de 64,3 por cada 1000 habitantes -incluidas todas las edades-; de igual modo, se reportaron 2378 defunciones por esta enfermedad, para una tasa de mortalidad de 21,1 por 100 000 habitantes, con lo cual la DM constituye la octava causa de muerte en el país.11)
Entre el 12 % y el 20 % de los pacientes con DM de tipo 2 presentan enfermedad arterial periférica (EAP), lo que supone la presencia de un pie diabético (PD) y se convierte en una de las complicaciones más frecuentes y temidas de la DM.12
La DM de tipo 2 afecta muchos órganos principales, como el corazón, los vasos sanguíneos, los nervios, los ojos y los riñones.13,14) Los factores que incrementan el riesgo de diabetes son factores de riesgo de otras enfermedades crónicas graves como la enfermedad renal crónica (ERC), la enfermedad cardíaca, la enfermedad arterial periférica (EAP), entre otras.15,16
Las infecciones ocasionadas por el padecimiento de la enfermedad y la aparición de los factores de riesgo pueden originar alteraciones en el sistema inmune; este es el caso de la uremia, que origina alteraciones en la respuesta humoral, la función linfocítica, los macrófagos y los leucocitos polimorfonucleares.17
La literatura científica comunica que los defectos en la inmunidad celular y humoral conducen a un incremento en la susceptibilidad del paciente diabético a la infección.18
La inmunidad celular está mediada por la función de los linfocitos T, cuya relevancia clínica se manifiesta a través de su participación en las pruebas de hipersensibilidad retardada, y la sobreactividad de los linfocitos Th1, relacionada con la autoinmunidad y los estados inflamatorios, mediante la activación de los macrófagos, los linfocitos citotóxicos y la cooperación en la producción de anticuerpos; además, de la producción de citoquinas como interferón gamma (IFNγ), IL-2 y factor de necrosis tumoral (TNF), y de la defensa contra bacterias, hongos y virus.19
La activación de los linfocitos T para organizar su respuesta inmune requiere de dos señales: la primera, que el receptor de linfocito T reconozca su antígeno afín presentado por las células presentadoras de antígeno (CPA); y la segunda, y muy importante, la co-estimulación, que se caracteriza por la interacción entre la proteína B7, en la CPA, y el CD28, del linfocito T. Sin esta señal co-estimuladora, el linfocito T puede adoptar un estado de anergia, lo que se traduce como linfocito afuncional. Un estado de anergia, por supuesto, origina una inmunodepresión, lo que condiciona una susceptibilidad a la infección. Por el contrario, los linfocitos T efectores responden al antígeno y producen citoquinas como la IL-2, las cuales ejercen varias acciones inmunológicas para la eliminación de la infección, como el reclutamiento y la activación de los leucocitos.20 En este caso, los linfocitos T presentan una buena respuesta inmunológica y, por consiguiente, su función se considera como reactiva.
Hace unos años en Cuba, en el Instituto Nacional de Angiología y Cirugía Vascular fueron realizados estudios en pacientes diabéticos, que demostraron alteraciones de su sistema inmunológico en general, tanto de la inmunidad celular -dada por las pruebas dérmicas de hipersensibilidad retardada, que ponen de manifiesto la función de los linfocitos T, según sean sus resultados en anérgicos (inmunodeprimidos) o reactivos (normoinmunes)- como de la inmunidad humoral -debida a la determinación de inmunoglobulinas-; también, dentro de inmunidad no específica: la adherencia leucocitaria, el índice fagocítico y la actividad microbicida.
Estas alteraciones en el sistema inmunológico de los pacientes diabéticos se consideraron una consecuencia de desarreglos metabólicos asociados con la enfermedad y con el hecho de que los diabéticos son más susceptibles a padecer procesos infecciosos que los no diabéticos, lo cual se debe a los defectos de su sistema inmune. Los resultados obtenidos en los pacientes diabéticos inmunodeprimidos se encuentran agravados por la presencia de manifestaciones clínicas de pie diabético.21,22,23,24,25
Por otro lado, en la literatura se encuentra que los factores de crecimiento regulan todos los aspectos de la cicatrización de heridas y, en especial, que el factor de crecimiento epidérmico (EGF) favorece la síntesis de colágeno. El EGF estimula la proliferación de fibroblastos, queratinocitos y células endoteliales de vasos, lo cual contribuye con sus propiedades cicatrizantes.26
En los ensayos clínicos fase I y II en pacientes con UPD se evidenció que la administración intralesional de Heberprot-P® (EGF) estimula la cicatrización de las heridas. Como resultado se obtiene la formación de un tejido de granulación útil en el lecho de las úlceras, que permite el cierre por segunda intención o mediante injerto de piel. Este efecto se asocia a una reducción del riesgo de amputación. No obstante, se ha observado en estos estudios una diferencia en el porcentaje de respuesta y no respuesta entre las úlceras isquémicas y las neuropáticas, lo cual sugiere que pudiera existir una acción diferenciada del producto a nivel inmunológico para estos dos tipos de úlceras.27
Un gran número de pacientes con UPD no responde a los tratamientos tradicionales; sin embargo, con el Heberprot-P® se ha logrado reducir el riesgo relativo de amputación a un 71 %.28,29
Fabelo y otros,30 en una investigación realizada a pacientes con UPD, refirió que los índices de amputación en Cuba han disminuido en más del 70 %, con la introducción del Heberprot-P®, y que ha sido esencial el programa de generalización nacional para detectar el pie de riesgo.
Por otro lado, se plantea que un buen control glucémico en el paciente con UPD es importante, porque disminuye la progresión de las lesiones y complicaciones agudas de la diabetes, así como favorece el proceso de cicatrización.31
El estudio del sistema inmune, en particular, la función de los linfocitos T, mediante la respuesta anérgica o reactiva a la prueba dérmica de hipersensibilidad retardada (PHR) en pacientes con UPD, resultaría de gran interés para valorar el efecto de los linfocitos T y su participación en el proceso de cicatrización, según su respuesta a las PHR durante el tratamiento con Heberprot-P®. Con un adecuado tratamiento, control de la respuesta inmune y control metabólico, los resultados en la utilización del Heberprot-P® pudieran ser mucho más efectivos.
Todo lo anterior ha motivado, por un lado, la búsqueda de medicamentos para la cicatrización y prevención de las UPD; y, por otro, el cierre definitivo de la lesión, mediante la formación de un tejido de granulación útil.
Tiene importancia destacar que el problema que se investigó es desconocido, por lo que no existe un consenso sobre esta temática.
Motivados por todo lo anterior y por la carencia de artículos científicos que permitan esclarecer la problemática planteada, se propuso la realización de esta investigación con el objetivo de evaluar el efecto de la inmunidad celular en el tratamiento de las úlceras del pie diabético con Heberprot-P®.
Métodos
Se realizó un estudio observacional, prospectivo, de serie de casos en 30 pacientes diabéticos de tipo 2 mayores de 50 años y hasta los 80, de uno y otro sexo, con criterios diagnósticos de UPD de tipo neuropática, que se encontraban ingresados en el Servicio de Angiopatía Diabética del Instituto Nacional de Angiología y Cirugía Vascular (INACV). Todos dieron su consentimiento para participar en el estudio, mediante la firma voluntaria de un Modelo de Consentimiento Informado.
Se excluyeron del estudio los pacientes con DM de tipo 1; los diabéticos de tipo 2 con presencia de procesos onco-proliferativos o enfermedades crónicas descompensadas, que presentaran ceto-acidosis o coma diabético; y los portadores de enfermedades psiquiátricas, que les impedían dar su consentimiento informado.
Procedimiento
Los pacientes fueron evaluados por el angiólogo, mediante un examen físico general y, una vez cumplidos los criterios de inclusión, se les indicaron las pruebas de laboratorio, que incluyeron glucemia en ayunas, creatinina, urea, ácido úrico y prueba de hipersensibilidad retardada. Posteriormente, se inició el tratamiento con el Heberprot-P® durante 8 semanas o hasta que ocurriera el cierre de la lesión, según el programa establecido para la administración del medicamento en la institución. De forma breve, se administró a razón de 75 µg, diluido en 5 mL de agua para inyección, 3 veces por semana, por vías peri- e intralesional. Se cumplieron todas las recomendaciones para su uso, manipulación, eliminación y condiciones de almacenamiento, recomendadas por el fabricante (Centro de Ingeniería Genética y Biotecnología, La Habana, Cuba).
Las administraciones se mantuvieron hasta que se logró la granulación completa de la lesión, su cierre mediante injerto o se alcanzó un máximo de 8 semanas de tratamiento. A las 4 semanas de tratamiento y al finalizar este (8 semanas), se repitieron los cortes evaluativos de las pruebas de laboratorio hechas antes del inicio. El grupo control fue el propio paciente, a través del estudio previo al tratamiento con Heberprot-P®.
Las infiltraciones se hicieron, después de realizada la cura de las lesiones, en los bordes de las úlceras, con agujas de 26Gx½” y en el fondo; en el caso de lesiones profundas se usaron agujas de 24Gx1½”. Se infiltraron primero las zonas más limpias de las lesiones y se cambió de aguja en los diferentes sitios de punción, a fin de evitar la transmisión de la sepsis de un sitio a otro. Posteriormente, la lesión se cubrió con un apósito de gasa humedecido con solución salina para que mantuviera un ambiente húmedo y limpio.
Se elaboró una planilla recolectora para registrar los datos (nombre completo, edad y sexo) y antecedentes personales e información específica de la enfermedad, localización de la úlcera, medición y porcentaje del tejido de granulación, a partir de comenzar el tratamiento. Esto se completó con los estudios de laboratorios mencionados, para el posterior análisis de las características de las diferentes variables de estudio, llevadas a tablas estadísticas.
En los antecedentes patológicos personales se incluyó el conocimiento que poseían los encuestados de padecer o no las siguientes enfermedades: diabetes mellitus de tipo 2 (años de padecimiento de la enfermedad y tipo de tratamiento: ninguno, dieta, insulina, hipoglucemiantes orales o una combinación de ellos); cardiopatía isquémica, evaluada mediante un electrocardiograma; y enfermedad arterial periférica (EAP), para la que se consideró diagnóstico negativo cuando no existieron elementos clínicos positivos, y el diagnóstico fue positivo cuando al menos hubo ausencia de alguno de los pulsos. En el examen clínico se examinaron los pulsos periféricos poplíteos, tibiales posteriores y pedios. Se evaluó la presencia de insuficiencia renal crónica, para lo cual se realizaron las determinaciones de laboratorio de creatinina, urea y ácido úrico.
Todos los pacientes recibieron, además del Heberprot-P®, el tratamiento estándar internacionalmente aceptado para el manejo de la patología: control metabólico, desbridamiento, terapia antimicrobiana adecuada para el tratamiento de la infección y curas húmedas con apósitos estériles.
Procedimiento para la toma de muestra
Las muestras de sangre se extrajeron de una de las venas de uno de los brazos de cada paciente, con empleo de jeringuillas plásticas desechables en el horario entre 7 y 9 de la mañana. Se colectaron 5 mL de sangre en tubos de cristal. Una vez centrifugado, se extrajo 1 mL del suero con pipeta Eppendorf a viales plásticos de 1,5 mL y se conservaron a -20°C hasta el momento de su determinación.
Se utilizó un autoanalizador bioquímico Selectra ProM (Elitech Group), para evaluar las pruebas analíticas de laboratorio (urea, ácido úrico y creatinina).
Determinación de creatinina, urea y ácido úrico
Los resultados de las determinaciones analíticas de laboratorio se consideraron patológicos o indicadores de insuficiencia renal crónica para la creatinina, cuando los valores fueron mayores de 113 µmol; para la urea, cuando resultaron superiores a 6,1 mmol; y, en el caso del ácido úrico, se tomaron valores mayores que 428 mmol/L para los hombres y 357 mmol/L para las mujeres.
Determinación de glucosa en suero
La determinación de la glucosa en suero se realizó a través del método enzimático de la glucosa oxidasa, mediante el juego de reactivos diagnóstico RapiGluco Test.32) Los resultados se expresaron en mmol/L.
Los valores normales se encontraban entre 4,2-6,2 mmol/L.
En todas las determinaciones analíticas los valores de referencia fueron tomados del laboratorio de bioquímica del INACV.
Prueba de hipersensibilidad retardada (PHR)
Esta técnica se aplicó según el método utilizado por Mahía y otros.21) Brevemente, se hizo una inoculación intradérmica en el antebrazo de cada paciente de 0,1 mL de los siguientes antígenos: tuberculina PPD-RT23, candidina y tricofitina -ambas diluidas al 1:100- y estreptoquinasa (500 U/mL). La reacción apareció después de varias horas y alcanzó un máximo entre las 24 y 48 horas. Los resultados se expresaron en anérgico y reactivo.
La reacción positiva se caracterizó por una induración mayor de 5 mm de diámetro, que indicó un estado de sensibilización, y se clasificó al paciente como reactivo. Una reacción negativa o menor de 5 mm demostró que el individuo no estaba sensibilizado al antígeno y, por consiguiente, se clasificó como anérgico.
Medición de la lesión y porcentaje de formación del tejido de granulación
Para la medición del tamaño de la úlcera se utilizó una regla graduada. Se midió en centímetros (cm) el tamaño de la lesión antes de comenzar el tratamiento. Luego a las 4 y 8 semanas, se midió la mayor longitud en vertical (largo) y la mayor longitud perpendicular (ancho), y se multiplicaron ambas longitudes.
La respuesta en la formación del tejido de granulación se analizó como se expone a continuación:
No respuesta (NR): entre 0 % y 25 % de granulación del área lesionada.
Respuesta mínima o poca granulación (RM): entre 30 % y 45 % de granulación del área lesionada.
Respuesta parcial (RP): entre 50 % y 65 % de granulación del área lesionada.
Respuesta total (RT): mayor que 70 % de granulación del área lesionada.
Las respuestas parcial y total se consideraron como buena granulación.
Procesamiento estadístico
Los datos obtenidos se procesaron mediante una base de datos creada en Excel. Los resultados se expresaron en frecuencias absolutas y relativas. Se empleó el test de ji al cuadrado ((2) no paramétrico para identificar la asociación entre las variables respuesta a las PHR y el porcentaje del tejido de granulación con una significación del 5 % (p < 0,05).
Procedimientos éticos
El estudio cumplió los principios éticos de la Declaración de Helsinki33 de la Asociación Médica Mundial para las investigaciones médicas en seres humanos, donde los individuos incluidos en el estudio recibieron una explicación detallada de los beneficios de su participación. Después se les pidió su consentimiento y su firma, bajo el principio de la voluntariedad y cumpliendo con todos los fundamentos básicos de la ética médica profesional. Independientemente de que decidieran abandonar la investigación, se les comunicó que se les seguiría atendiendo con todos los recursos de los que se dispuso para dicha investigación. En todos los casos se respetó la identidad de los pacientes y en los resultados que se publiquen no se dará información que comprometa su identidad.
Resultados
El promedio de edad de los sujetos estudiados fue de 63 años. El análisis de las características generales de la muestra de estudio precisó un predominio del sexo femenino, de los grupos de edades entre 50 y 59 años, y del color de piel blanca. Los factores de riesgo analizados no mostraron resultados notorios. La localización de la lesión se comportó prácticamente igual para ambos miembros (derecho e izquierdo). El electrocardiograma no reportó cambios ni en el ritmo eléctrico ni en los isquémicos (tabla 1).
Tabla 1 Características generales de la muestra de estudio
| Variables | Descripción | n = 30 | % |
|---|---|---|---|
| Sexo |
Femenino Masculino |
18 12 |
60 40 |
| Edad (años) |
50-59 60-69 70-79 > 80 |
12 8 9 1 |
40 26,6 30 3,3 |
| Color de piel | Blanca Negra | 16 14 | 53 46,6 |
| Factores de riesgo | CI ERC EAP | 1 1 4 | 3,3 3,3 13,3 |
| Localización de la úlcera | MID MII | 16 14 | 53 46,6 |
| Electrocardiograma | No cambios en el ritmo eléctrico ni isquémicos | 30 | 100 |
Leyenda: CI (cardiopatía isquémica); ERC (enfermedad renal crónica); EAP (enfermedad arterial periférica); MID (miembro inferior derecho); MII (miembro inferior izquierdo).
Nota: Los porcentajes se calcularon sobre el total de la muestra (n = 30).
Se observó que los niveles de glucemia en los pacientes anérgicos se encontraban por encima de los valores observados para los pacientes reactivos, tanto antes de comenzar el tratamiento como en la octava semana. Resultados similares se hallaron para la creatinina. La urea fue similar tanto en anérgicos como en reactivos; y el ácido úrico, mayor en hombres reactivos y en las mujeres anérgicas (tabla 2).
Tabla 2 Concentraciones de las variables cuantitativas para anérgicos y reactivos antes y después del tratamiento
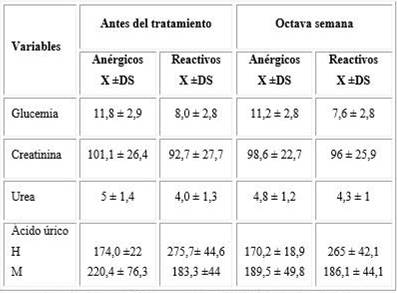
Leyenda: H (hombre); M (mujer); X (media); DS (desviación estándar).
Fuente: Base de datos.
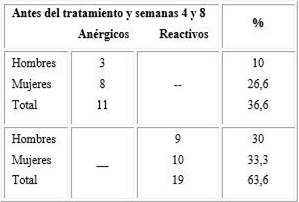
Los resultados de las PHR mostraron que los pacientes que resultaron anérgicos antes del tratamiento se mantuvieron anérgicos en las semanas 4 y 8, independientemente del sexo. De la misma forma ocurrió para aquellos que fueron reactivos, lo que coincidió con un mayor predominio durante el estudio (63,6 % vs. 36,6 %) para los anérgicos (tabla 3).
Al analizar la respuesta obtenida de acuerdo con la formación del tejido de granulación de la UPD tratada con Heberprot-P®, se encontró que los 19 pacientes que resultaron reactivos presentaron en la cuarta semana un porcentaje de granulación de la úlcera mayor al 50 % y en la octava semana mayor al 70 %, lo que denotó una buena respuesta al tratamiento. Sin embargo, en el caso de los 11 pacientes que fueron anérgicos, ninguno tuvo tejido de granulación (no respuesta) después del tratamiento; solo un 13,3 % mostró una respuesta mínima, con un 20 % de granulación (tabla 4).
Tabla 4 Formación del tejido de granulación de la UPD tratada con Heberprot-P® en las semanas 4 y 8, según las pruebas de hipersensibilidad retardada
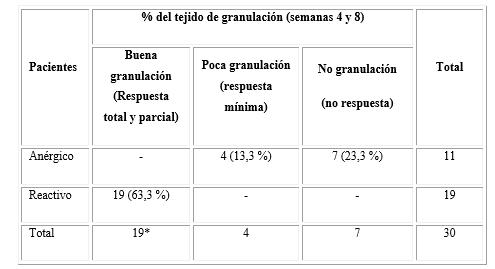
Leyenda: Respuesta total y parcial (semana 4: 50 %-60 % y semana 8: 70 %-80 %); Respuesta mínima (semanas 4 y 8: 20 %-25 %); No Respuesta. *Prueba estadística no paramétrica de (2 = 30,06 > p = 0,0000.
A simple vista se aprecia que pudiera existir una asociación entre las dos variables: respuesta a las PHR y porcentaje de granulación, lo que se analizó desde el punto de vista estadístico a través de la prueba no paramétrica (2.
Se encontró una asociación entre la respuesta a las PHR y el porcentaje de granulación ((2 = 30,06; pv = 0,0000). Esto permitió comprobar que las dos variables estudiadas estaban asociadas, lo que indicó que los pacientes que resultaron reactivos a la PHR respondían mejor al tratamiento con Heberprot-P® al presentar un buen porcentaje en la formación del tejido de granulación.
Discusión
Desde el siglo pasado se conoce que los pacientes con DM son más susceptibles a las enfermedades infecciosas que los sujetos que no la padecen. En las últimas décadas numerosos estudios se han realizado para entender los cambios en la respuesta inmune de pacientes con DM.34,35,36
En aquellos con DM de tipo 2 se han encontrado alteraciones de la inmunidad celular, como un incremento en las células Th17 y Th1; así como una disminución en la población Treg, lo cual sugiere que promueve la inflamación y la resistencia a la insulina.34
En la literatura revisada para este estudio no se hallaron publicaciones que abordaran el tema de las respuestas a las PHR en los pacientes con UPD y el uso de factores de crecimiento para su tratamiento. Sin embargo, se recogen los resultados beneficiosos obtenidos con la utilización del Heberprot-P® en el tratamiento del pie diabético.37,38
Cabe destacar la existencia de artículos que abordan cambios que se producen en el sistema inmunológico a causa del envejecimiento, y de los factores de riesgo como el estrés y la genética, entre otros.35,39,40 Estos cambios predisponen a padecer procesos infecciosos y enfermedades autoinmunes con respuestas inmunes escasas. Al respecto, algunos investigadores,15 estudiaron las PHR de pacientes diabéticos con manifestaciones clínicas del pie, clasificados en: pie diabético isquémico (PDI), pie diabético neuro-infeccioso (PDNI) y pie diabético isquémico-infectado (PDII), según proposición de Mc Cook y otros,41 para caracterizar a los pacientes anérgicos y reactivos según el tipo de úlcera. Los resultados mostraron que el 64,5 % correspondía a pacientes anérgicos. De ellos, el 39,5 % tenía un PDNI; el 23,2 %, un PDI; y el 37,2 %, un PDII.
Este grupo realizó otro trabajo, en el que estudiaron las PHR como evaluadores de la inmunología en diabéticos que serían sometidos a cirugía.14 Además se incluyeron las funciones de los leucocitos polimorfo-nucleares; entre ellas: adherencia leucocitaria, índice fagocítico y actividad microbicida. Las determinaciones se hicieron en los estadios pre- y posoperatorio. Los resultados mostraron valores significativamente disminuidos de las funciones leucocitarias en aquellos pacientes sépticos, tanto en el pre- como en el posoperatorio. En el caso particular de las PHR, se encontró que el 40,7 % de pacientes que fueron anérgicos en el pre operatorio, desarrollaron sepsis en el posoperatorio el 36,3 %; por el contrario, el 59,3 % de los pacientes que fueron reactivos en el preoperatorio, no presentaron sepsis en el posoperatorio el 81,5 % de los reactivos. Con estos resultados puede concluirse lo siguiente:
Los pacientes diabéticos con macroangiopatía presentan estados de inmunodepresión, tanto de la inmunidad celular y humoral como de la innata inespecífica.
Los anérgicos al PHR incrementan la morbi-mortalidad del paciente diabético con enfermedad vascular periférica, sobre todo en aquellos con complicaciones clínicas de pie diabético.
Los pacientes anérgicos a las PHR son más susceptibles a desarrollar procesos sépticos; al someterse a un acto quirúrgico, tienden a mantenerse anérgicos.
Otro indicador estudiado fue la glucemia en ayunas, que mostró alteraciones apreciables, tanto en reactivos como en anérgicos, más marcado en estos últimos, característica notoria del desbalance glucémico encontrado en pacientes diabéticos con un sistema inmunológico disminuido o deprimido.
A pesar de que los niveles de urea y ácido úrico se encontraban algo elevados, no mostraron alteraciones marcadamente apreciables que denotaran presencia de enfermedad renal crónica.
Por su parte, el electrocardiograma no mostró cambios eléctricos en el ritmo, ni de isquemia e infarto.
En cuanto a la presencia de la EAP preexistente, solo la manifestaron cuatro pacientes.
Debe resaltarse la importancia de la inmunidad celular en los reactivos tras la administración del Heberprot-P®, que fue de un 63,3 % en comparación con los anérgicos (36,6 %). Puede notarse que los pacientes reactivos presentaron una mejor inmunidad celular, lo que permitió la formación de un tejido de granulación útil para la cicatrización de sus heridas. Esto pudo constatarse desde el punto de vista estadístico, al demostrarse una asociación entre la condición de ser reactivo y un mejor porcentaje de granulación de la lesión. Resultados diferentes se hallaron en el grupo de pacientes que anérgicos, los que presentaron una no respuesta o respuesta mínima en el porcentaje de formación del tejido de granulación. Estos resultados se asociaron al estado de inmunodepresión que presentaban estos pacientes. Lo encontrado aquí concuerdan con la literatura sobre esta temática.
Entre las limitaciones del estudio, en primer lugar, el tamaño muestral fue pequeño e insuficiente para encontrar diferencias estadísticamente significativas de las variables entre los grupos y en lo que respecta a la presencia de los factores de riesgo. En segundo lugar, solo se pudo realizar la determinación de las PHR in vivo como evidencia de la función de los linfocitos T, lo que impidió establecer una correcta relación causa-efecto con respecto a esa variable.
Sería de interés realizar estudios similares multicéntricos que utilicen variables inmunológicas que abarquen la inmunidad humoral y la celular, para establecer mecanismos bioquímicos que conduzcan a profundizar en el conocimiento del papel del sistema inmunológico en el proceso de cicatrización de las heridas de los pacientes con UPD, tratados con Heberprot-P®. El estudio inmunogenético pudiera ser en la actualidad una buena opción a incluir, debido a la base genética de la enfermedad.
Se concluye que la condición en los pacientes diabéticos tratados con Heberprot-P® de resultar reactivos a las PHR con UPD de tipo neuropática, está asociada directamente con una mejor respuesta en la cicatrización de sus lesiones, mediante la formación del tejido de granulación, que favorece el cierre total o parcial de la lesión, lo que no ocurrió con los pacientes anérgicos a dicha prueba.