Introducción
Una de las aplicaciones más antiguas de la luz, o de la materia en cualquier forma de energía radiante, ha sido el estudio de las propiedades de los objetos o de las sustancias, a este tipo de estudio se le denomina espectroscopia, la cual es por sí misma una ciencia completa. La espectroscopia óptica estudia la interacción de fotones ópticos con la materia y su principio básico se centra en el paso de los fotones a través de la materia, es decir, cómo los fotones pueden ser absorbidos, transmitidos, reflejados o dispersados. Gracias a estas propiedades (absorción, transmisión, reflexión, dispersión), se han encontrado diversas aplicaciones y se ha profundizado en las investigaciones y las limitaciones que se presentan. Por otro lado, la espectroscopia fotoacústica (EFA) representa un enfoque más reciente del estudio de la materia y su interacción con la luz. 1 La EFA se considera solo un re-descubrimiento de un antiguo resultado que en ese entonces se denominó como el efecto óptico-acústico, el cual fue propuesto originalmente por Alexander Graham Bell en 1880. 2 En la espectroscopia óptica convencional la cantidad de energía absorbida por la muestra irradiada se mide directamente por la luz transmitida o reflejada, mientras que en el efecto fotoacústico es esencialmente la generación y detección de efectos acústicos o termo-elásticos, que resultan de la absorción de cualquier tipo de radiación electromagnética modulada o pulsada. 1 Para reproducir este efecto en el laboratorio, se debe considerar la longitud de onda de la fuente de iluminación y las características de la muestra para que se pueda generar el efecto termo elástico y a su vez se produzca el efecto acústico deseado, posteriormente, esta señal acústica generada es captada por un transductor ultrasónico para luego ser estudiada y en su caso, reconstruida con el fin de generar imágenes fotoacústicas tridimensionales.
La generación de imágenes médicas es uno de los principales usos que se le ha dado al efecto fotoacústico, pues son de suma importancia para el diagnóstico y la investigación médica, ya que la generación de imagen fotoacústica permite obtener información del cuerpo humano con ciertas características de profundidad y resolución sin el uso de radiación ionizante. El estudio de las imágenes obtenidas por esta técnica, permite la aplicación de visión por computadora y Deep Learning. La intención de esta revisión es profundizar en este novedoso campo e incentivar el uso de las herramientas actuales para que en muchos lugares las personas tengan una mejor calidad de vida gracias a la detección temprana de su enfermedad mediante la Imagenología médica.
Es por eso que el objetivo de este documento es dar, a partir de una revisión de la literatura actualizada, un panorama general de las técnicas de Deep Learning que se han utilizado recientemente para resolver ciertas problemáticas que se presentan al reconstruir y analizar este tipo de imágenes, así como ampliar su uso en aplicaciones médicas.
Desarrollo
Imagen fotoacústica
Las modalidades de obtención de imágenes ópticas tridimensionales de alta resolución comercialmente disponibles, incluidas la microscopía confocal, la microscopía de dos fotones y la tomografía de coherencia óptica, han tenido un impacto fundamental en la biomedicina. Desafortunadamente, tales herramientas no pueden penetrar el tejido biológico más profundamente que el transporte óptico, que significa un recorrido libre de 1 mm en la piel. La tomografía fotoacústica por otro lado, combina un fuerte contraste óptico y una alta resolución ultrasónica en una única modalidad que ha permitido superar esta limitación y ha logrado imágenes ópticas de alta resolución y de gran profundidad. 3
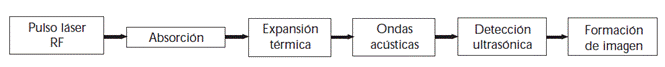
La imagen fotoacústica (PAI), es una modalidad de imagen comparativamente joven y emergente que promete una medición en tiempo real, no invasiva y libre de radiación, de las propiedades ópticas del tejido. A diferencia de otras modalidades de imágenes ópticas, PAI induce la aparición de señales acústicas para permitir la obtención de imágenes estructurales de cromóforos (estructuras moleculares que absorben la luz) hasta varios centímetros de profundidad en el tejido que varía desde 1 cm hasta 6 cm, dependiendo en gran medida del tejido estudiado. Esta penetración de alta profundidad es posible porque la dispersión acústica de las ondas sonoras que surgen es de órdenes de magnitud menor que la dispersión óptica de la luz incidente en el tejido biológico. 4 En esencia, una imagen fotoacústica se puede considerar como una imagen de ultrasonido en la que el contraste no depende de las propiedades mecánicas y elásticas del tejido, sino de sus propiedades ópticas, específicamente de la absorción óptica. 5 En el proceso de formación de una PAI, el tejido se irradia con pulsos láser cortos, con una longitud de algunos nanosegundos. La absorción de luz láser transfiere energía óptica al tejido, lo que provoca un aumento de presión transitoria. 6 Este aumento de presión inicial actúa como una fuente acústica que genera una onda que se propaga a través del tejido. La onda acústica se puede detectar con un transductor de ultrasonidos. La imagen puede ser creada escaneando, tanto el ultrasonido como el haz óptico, y deduciendo la resolución de profundidad desde el tiempo de vuelo de la onda de presión. En la figura 1 se observa un esquema que explica el proceso básico de formación de una PAI.
Existen dos modalidades de rápido crecimiento de PAI: la microscopía fotoacústica (PAM) y la tomografía computarizada fotoacústica (PACT). Estas técnicas obtienen imágenes de diferentes maneras: la primera es una imagen formada de escaneo punto por punto, y la segunda es una imagen reconstruida mediante la adquisición de señales fotoacústicas (PA) en diferentes posiciones. 7 La microscopía fotoacústica de resolución óptica (OR - PAM) es una modalidad excelente para la obtención de imágenes biomédicas in vivo, ya que proporciona de forma no invasiva información morfológica y funcional de alta resolución sin la necesidad de agentes de contraste exógenos. 8
La tomografía fotoacústica implica la generación de pulsos acústicos de banda ancha a través de la rápida deposición de energía a partir de pulsos de luz láser visibles o de nanosegundos NIR. En el modo de tomografía, el tejido objetivo se inunda de luz utilizando iluminación de campo amplio y los pulsos acústicos resultantes se registran en diferentes puntos espaciales de la superficie del tejido. Luego, hay dos pasos para la reconstrucción de la imagen. En el primer paso, la distribución de la presión acústica inicial se estima a partir de la serie temporal de presiones medidas, para varias longitudes de onda ópticas. En el segundo paso, las propiedades del tejido, como los coeficientes de absorción óptica, las concentraciones de cromóforos o la saturación de oxígeno, se extraen de imágenes. Es por eso que hay que centrarse en la tarea de obtener estimaciones precisas, a partir de un conjunto de imágenes perfectamente reconstruidas. (Fig. 1). 9
Algunas aplicaciones médicas de la Fotoacústica
Hematología
Distintas enfermedades hematológicas se manifiestan en la médula ósea (BM), caracterizadas en términos generales como falla de la médula ósea (BMF). La BMF puede ser causada por leucemia linfoblástica aguda (LLA), que resulta en una expansión de regiones hipóxicas en la BM. Debido a esta presentación hipóxica, existe la posibilidad de una mejor caracterización de la BMF mediante la evaluación in vivo de la oxigenación en la cavidad de la BM. Las imágenes fotoacústicas PAI pueden proporcionar una evaluación local de la saturación de oxígeno intravascular (SO2), ya que se ha demostrado que se correlaciona con la hipoxia evaluada con pimonidazol. Este estudio presenta una técnica de imagenología optimizada para evaluar el SO2 dentro de la cavidad de la BM femoral a través de la progresión de la enfermedad en un modelo murino de LLA. Los resultados muestran una diferencia estadísticamente significativa con los cambios temporales en el SO2 (desde la línea de base) entre las muestras de control y enfermas, lo que demuestra el potencial de las imágenes de PA para la monitorización no invasiva y sin etiquetas de las enfermedades de BMF. 10
Las inversiones espectroscópicas lineales, en las que se supone que las amplitudes fotoacústicas son directamente proporcionales a los coeficientes de absorción, se utilizan ampliamente en la formación de imágenes fotoacústicas para estimar la saturación de oxígeno en sangre debido a su simplicidad. Desafortunadamente, no tienen en cuenta la dependencia de la longitud de onda que varía espacialmente de la fluencia de la luz dentro del tejido, lo que introduce una "coloración espectral", una fuente de error potencialmente significativa. Sin embargo, corregir con precisión la coloración espectral es un desafío, por lo que falta investigar si existen condiciones, por ejemplo, conjuntos de longitudes de onda, donde es posible ignorar la coloración espectral y aún obtener mediciones de oxigenación precisas usando inversiones lineales. Se pueden obtener estimaciones precisas de la oxigenación cuando las longitudes de onda se eligen, para minimizar la coloración espectral, evitar el mal acondicionamiento y mantener una relación señal / ruido (SNR). Mediante el uso de simulaciones numéricas, se puede aislar el efecto de la coloración espectral de las fuentes de error experimentales. Se puede demostrar que el uso de longitudes de onda entre 500 nm y 1000 nm produce estimaciones inexactas de oxigenación y que una selección cuidadosa de longitudes de onda en el rango de 620 a 920 nm puede producir valores de oxigenación más precisos. Esto sugiere que, para un escenario de imágenes en particular, obtener estimaciones de oxigenación precisas y confiables utilizando inversiones espectroscópicas lineales requiere un modelado cuidadoso o estudios experimentales de ese escenario, teniendo en cuenta la instrumentación, la anatomía del tejido, el rango probable de SO2 y el proceso de formación de imágenes. 11
Detección de melanoma mediante microscopía fotoacústica
Para esta aplicación fue desarrollado un citómetro de flujo con ultrasonido inducido por láser para detectar las células del melanoma circulando como un indicador temprano de la enfermedad metastásica. Las células tumorales circulantes (CTC) son las células que se han separado de un tumor macroscópico y la difusión a través de los sistemas sanguíneo y linfático a los tumores de semilla secundaria, las CTCs son indicadores de la enfermedad metastásica y su detección en muestras de sangre se pueden utilizar para diagnosticar el cáncer y controlar la respuesta del paciente a la terapia.
Mapeo fotoacústico de los ganglios linfáticos centinela
El sistema linfático está compuesto por ganglios, vasos y líquido linfático. Un ganglio linfático centinela (a menudo llamado ganglio centinela) es el primer ganglio linfático al cual podrían llegar las células cancerosas. Los vasos linfáticos son tubos pequeños (parecidos a los vasos sanguíneos), que transportan el líquido linfático desde los ganglios linfáticos y hacia ellos. Para realizar este procedimiento, el paciente estará en una silla reclinable aproximadamente 20 minutos y se le inyectará una pequeña cantidad de líquido radiactivo debajo de la piel bajo la areola de la mama afectada. Posteriormente un tecnólogo medirá la radioactividad en la mama, la axila y el muslo en el lado afectado, para ver cuánto líquido se absorbió. El tecnólogo puede usar un pequeño dispositivo portátil llamado Neoprobe o se le puede hacer un escaneo de Imagenología de cuerpo entero. Ambos métodos funcionan igualmente bien.
Imágenes fotoacústicas obtenidas mediante LOIS para la detección del cáncer de mama
Esta aplicación puede convertirse en una alternativa a las mamografías o ecografías actuales. LOIS (Laser Optoacoustic Imaging System) es un sistema novedoso que utiliza las imágenes fotoacústicas y frente a una radiografía ofrecen la ventaja de no utilizar ningún tipo de radiación ionizante, de esta forma se aprovecha la propiedad de generación de ondas ultrasónicas en los tejidos al ser iluminados con pulsos de luz cortos de alta energía. Con estas señales se pueden detectar concentraciones de cromóforos (como lípidos, hemoglobina oxigenada y desoxigenada) y mapear los tejidos para encontrar angiogénesis, que es un proceso que ocurre en la transformación maligna del crecimiento tumoral. Con este sistema también se pretende estudiar el funcionamiento y afecciones del cerebro y otros órganos de manera no invasiva.
Actualmente dentro de las técnicas de aplicación medica con las distintas variantes de fotoacústica disponibles, se puede hablar de:
Endoscopía fotoacústica
Esta nueva técnica destaca un prototipo de endoscopio de imágenes fotoacústicas (PAI) que se podría utilizar para caracterizar la inflamación y la fibrosis en la enfermedad de Crohn (EC). Este tipo de imagenología podría ayudar a planificar con mayor exactitud la terapia para cada paciente con EC. Esto proporcionaría un tratamiento más específico y ayudaría a minimizar cualquier efecto adverso que pudiera resultar del tratamiento. El trabajo futuro de esta técnica será minimizar el endoscopio con el fin de que se pueda utilizar en el canal de trabajo de un colonoscopio; esto permitirá al cirujano apoyarse de imágenes fotoacústicas antes de realizar el tratamiento.
Microscopía fotoacústica
La microscopía fotoacústica (PAM) es una técnica híbrida (óptico-acústica) que ha demostrado su utilidad a la hora de generar imágenes de los vasos sanguíneos de tejidos superficiales, son obtenidas normalmente mediante un escaneo sin algoritmos de reconstrucción. La microscopía fotoacústica se suele clasificar en dos modalidades principales dependiendo de la profundidad de penetración del láser, que a su vez define diferentes estrategias de focalización: de resolución óptica (optical-resolution, OR-PAM) y de resolución acústica (acoustical-resolution, AR-PAM). En AR-PAM la resolución viene determinada por la propagación y detección ultrasónica, mientras que en OR-PAM es el tamaño del foco óptico utilizado para generar las ondas fotoacústicas lo que determina la resolución lateral, de ahí la importancia de focalizar bien el láser.
Tomografía fotoacústica
Es una técnica no invasiva que funciona convirtiendo la energía óptica absorbida en señal acústica. La luz pulsada se envía al tejido del cuerpo y crea un pequeño incremento en la temperatura que permite que el tejido se expanda y genere una respuesta acústica que puede ser detectada por un transductor de ultrasonido. Los datos de ultrasonido se utilizan para visualizar el tejido, esta técnica se puede utilizar para detectar o controlar enfermedades como las cardiovasculares, la diabetes y el cáncer.
Tomografía fotoacústica en 4D
El desarrollo de PAT de cuatro dimensiones (4D), integra resoluciones de tiempo con resolución espacial 3D, obtenidas utilizando matrices esféricas de detectores ultrasónicos. La PAT 4D genera imágenes en movimiento de tejido, lo que permite el seguimiento en tiempo real de procesos fisiológicos y patológicos dinámicos a resoluciones de cien micrómetros-milisegundos. La PAT 4D se utiliza para obtener imágenes de la administración de fármacos y la farmacocinética basadas en agujas. Actualmente están utilizando esta técnica para controlar: los cambios hemodinámicos rápidos durante las crisis epilépticas interictales y las variaciones de temperatura durante la terapia térmica tumoral.
Flujometría fotoacústica Doppler
Se deriva de la flujometría láser Doppler que utiliza luz en lugar de ultrasonido para detectar la velocidad del flujo. La longitud de onda óptica mucho más corta significa que esta tecnología puede detectar velocidades de flujo bajas fuera del rango del ultrasonido Doppler. Pero esta técnica está limitada por un ruido de fondo alto y una señal baja debido a la dispersión múltiple. La flujometría láser Doppler solo puede medir la velocidad sanguínea promedio dentro de 1 mm cúbico sin proporcionar información sobre la dirección del flujo. La Flujometría fotoacústica Doppler se utiliza para medir la velocidad del flujo sanguíneo con las ventajas de la imagen fotoacústica. Las imágenes fotoacústicas combinan la resolución espacial de las imágenes de ultrasonido con el contraste de la absorción óptica en el tejido biológico profundo. El ultrasonido tiene una buena resolución espacial en tejidos biológicos profundos, ya que la dispersión ultrasónica es mucho más débil que la dispersión óptica, pero es insensible a las propiedades bioquímicas. Al combinar la imagen óptica con el ultrasonido, es posible lograr un alto contraste y una resolución espacial mayor. La flujometría fotoacústica Doppler podría utilizar el poder de la fotoacústica para medir velocidades de flujo que normalmente son inaccesibles a las técnicas de ultrasonido o basadas en luz pura. La alta resolución espacial podría permitir identificar solo unas pocas partículas absorbentes localizadas en un solo capilar. El alto contraste de los fuertes absorbentes ópticos hace posible resolver claramente la señal de los absorbentes sobre el fondo.
Deep Learning
Se podría definir el aprendizaje profundo como una clase de técnicas de aprendizaje automático, donde la información se procesa en capas jerárquicas para comprender las representaciones y características de los datos en niveles crecientes de complejidad. En la práctica, los algoritmos de aprendizaje profundo son redes neuronales, que comparten algunas propiedades básicas comunes. Todos están formados por neuronas interconectadas que están organizadas en capas. La diferencia entre ellas, radica en la arquitectura de la red, es decir, la forma en que se organizan las neuronas en la red y a veces, en la forma en que están entrenadas.11 Se puede clasificar al Deep Learning como un método de representación-aprendizaje que, mediante la composición de módulos no lineales, es capaz de aprender distintas representaciones de los datos.12 El punto clave de esta técnica es que no requiere de un experto humano que especifique dichos módulos, sino que estos, a través de los datos, son capaces de aprender la representación de los mismos que optimice la tarea posterior, ya sea clasificación o regresión. El Deep Learning, esencialmente, es una extensión de las Redes Neuronales Artificiales, las que son una extensión del Perceptrón presentado por Frank Rosenblat en 1958. 13
Se puede dividir el aprendizaje automático en tres categorías de acuerdo con el proceso de entrenamiento. La primera categoría es el aprendizaje por refuerzo, la interacción entre el agente construido y el entorno logra el mayor beneficio o resuelve problemas específicos a través de estrategias de aprendizaje. Una de sus aplicaciones más famosas es AlphaGo, que es un sistema de Go-playing desarrollado por DeepMind, que incluso derrota a los mejores jugadores de Go del mundo.14) La segunda categoría es el aprendizaje no supervisado que consiste en clasificar o agrupar basándose en muestras de entrenamiento con categorías desconocidas (sin etiquetar) y descubrir patrones entre ellas. Un ejemplo común de aprendizaje no supervisado es el análisis de conglomerados. La última categoría es el aprendizaje supervisado, los conjuntos de datos emparejados hacen que los algoritmos de aprendizaje automático convencionales se centren en ella. Entrena con los datos etiquetados para encontrar las reglas de los patrones y luego produce la etiqueta correcta en los datos invisibles, por ejemplo, muchas imágenes médicas, incluidos los problemas de reconstrucción de imágenes PA, se basan en el aprendizaje supervisado. 15),(16
El aprendizaje profundo permite que los modelos computacionales que se componen de múltiples capas de procesamiento aprendan representaciones de datos con distintos niveles de abstracción. Estos métodos han mejorado drásticamente el estado de la técnica en reconocimiento de voz, reconocimiento de objetos visuales, detección de objetos y muchos otros dominios, como el descubrimiento de fármacos y la genómica. Las redes convolucionales profundas han producido avances en el procesamiento de imágenes, video, voz y audio, mientras que las redes recurrentes han arrojado luz sobre datos secuenciales como texto y voz. 17
Deep Learning para imágenes fotoacústicas
Dado que la espectroscopia fotoacústica es una técnica para adquisición de imágenes 3D, las aplicaciones con Deep Learning lo son aún más. En este sentido, algunos algoritmos que se utilizan actualmente para generar datos experimentales son utilizados para entrenar gran parte de los métodos dada la poca cantidad de datos clínicos con los que se cuenta.
La imagen fotoacústica (PAI) permite obtener imágenes resueltas espacialmente de las propiedades ópticas del tejido hasta varios centímetros de profundidad, sin embargo, la extracción de parámetros de tejido relevantes a partir de los datos sin procesar requiere la resolución de problemas de reconstrucción de imágenes inversas, que han demostrado ser extremadamente difíciles de resolver. La aplicación de métodos de aprendizaje profundo se ha disparado recientemente en popularidad, lo que ha llevado a éxitos impresionantes en el contexto de las imágenes médicas y también ha encontrado un primer uso en el campo de PAI. Los métodos de aprendizaje profundo poseen ventajas únicas que pueden facilitar la traducción clínica de PAI, como tiempos de cálculo extremadamente rápidos y el hecho de que pueden adaptarse a cualquier problema dado. 4
La tabla 1 muestra los resultados del estudio hecho en que se reporta el número absoluto y relativo de artículos que utilizan datos experimentales para la prueba o para el entrenamiento de redes.4
De una lista de 83 artículos revisados que aplican técnicas de Deep Learning enfocado a PAI, se obtuvo la siguiente tabla 2, donde se presentan las principales arquitecturas utilizadas en la actualidad: 4
Tabla 1 - Número de artículos que utilizan técnicas de Deep Learning para 4 de las principales problemáticas que se presentan en PAI. 4
| Problema inverso acústico | 10(43%) | 1(4%) |
| Post- procesamiento de la imagen | 23(79%) | 14(48%) |
| Problema inverso óptico | 1(33%) | 1(33%) |
| Anotación de imagen semántica | 14(54%) | 11(442%) |
Tabla 2 - Arquitecturas de Deep Learning usadas actualmente para procesamiento de PAI. CNN=Red Neuronal Convolucional, FCNN=Red Neuronal Totalmente conectada, ResNet=Red Neuronal Residual, DenseNet = Red Neuronal Densa, RNN = Red Neuronal Recurrente, INN = Red Neuronal Invertible. 4
| U-Net | 43(52%) |
| CNN | 18(22%) |
| FCNN | 9(11%) |
| ResNet | 5(6%) |
| DenseNet | 3(4%) |
| RNN | 1(1%) |
| INN | 1(1%) |
| Otras | 3(4%) |
Dado que existe una falta de datos clínicos, alrededor del 65% de los trabajos que utilizan Técnicas de Deep Learning aplicado a PAI se basan en datos simulados para el entrenamiento supervisado, pero solo el 35% de los trabajos han validado sus métodos con datos in vivo. 4 Por ello es necesario el apoyo de softwares que permitan generar datos sintéticos a partir de simulaciones. Actualmente se tienen disponibles 5 programas de código abierto para la generación de dichos datos:
K-wave: es una toolbox de MATLAB que nos permite simular y reconstruir campos de ondas fotoacústicas, se ha diseñado para facilitar modelos de PAI incluyendo el modelado de dispositivos de detección de ondas. Es uno de los más utilizados y se basa en una solución pseudoespectral en el dominio del tiempo de las ecuaciones fotoacústicas. 18
NIRFAST: Fue desarrollado para modelar la propagación de la luz en tejido con longitudes de onda cercanas al infrarrojo, este programa es capaz de obtener imágenes ópticas o funcionales de una o varias longitudes de onda a partir de datos simulados y medidos. 19
MCXYZ: es una herramienta de simulación que se basa en el modelo de Monte Carlo de transporte de luz para simular la propagación de los fotones en tejidos heterogéneos. Este método utiliza las propiedades de absorción y dispersión para encontrar las trayectorias de los fotones a través del medio; para la simulación se basa en voxeles, asignando a cada voxel un tipo particular de tejido. 20
Monte Carlo extreme (MCX): basado en el modelo de Monte Carlo de transporte de luz, simula el transporte de fotones apoyado de procesamiento gráfico GPU, esto es una ventaja ya que acelera el procesamiento mediante una o varias GPU´s. 21
Toast++: es una serie de bibliotecas que ayuda a simular la propagación de la luz en medios de alta dispersión con una distribución interna heterogénea, contiene solucionadores numéricos basados en el método de elementos finitos, discretización de Galerkin discontinuo y elementos de contorno. 22
Estos programas permiten obtener datos con los cuales trabajar y probar los modelos, sin embargo, los modelos puramente entrenados con datos experimentales presentan un bajo rendimiento cuando se aplican a datos clínicos. Estas diferencias entre PAI experimentales y las generadas por los modelos computacionales se conocen como brecha de dominio y puede provocar que en aplicaciones in vivo fallen; esto sucede por las distribuciones diferentes de los datos. Para que estas brechas sean menos significativas se puede abordar el problema desde distintos puntos:
Creación de métodos para obtener simulaciones más realistas, mejorando la geometría anatómica del tejido. 4
Aplicar métodos de adaptación de dominio como los usados en el campo de la visión por computadora, esto podría ayudar a traducir las imágenes del dominio de la imagen sintética a la de una PA real. 22
Métodos para refinar el proceso de entrenamiento, como son aumentar los datos específicos para PAI, desenredo del contenido, o los cambios de arquitectura específica del dominio. (23-27
Uno de los principales cuellos de botella de la aplicación de algoritmos de aprendizaje profundo a PAI es la falta de datos de entrenamiento fiables. Esto puede deberse, en particular, a la falta de información sobre las propiedades del tejido óptico subyacente, o a la distribución de la presión inicial al adquirir las mediciones experimentales. 4 Esta falta de datos experimentales para entrenamiento se acentúa más en el apartado de problema inverso óptico y acústico. En el campo de las imágenes médicas, sólo unos pocos estudios prospectivos garantizan una visión fiable de la fidelidad de los métodos de aprendizaje profundo. 29) Uno de los principales problemas es que los algoritmos no son directamente utilizables por especialistas médicos debido a limitaciones técnicas o burocráticas. 19 Dado el hecho de que la mayoría de los enfoques utilizan datos simulados para entrenar sus algoritmos, hay una alta probabilidad de que muchos de los algoritmos presentados, aunque den resultados excelentes en los datos publicados puedan fallar en un escenario clínico. Esto puede atribuirse al hecho de que los datos de entrenamiento pueden sufrir de diversas deficiencias en comparación con la distribución de datos en la realidad: una diferencia significativa en los datos (brecha de dominio), un número insuficiente de muestras, o un sesgo de selección. 30-32
Conclusiones
La Tomografía Fotoacústica y el Deep Learning en aplicaciones médicas, constituye un campo de reciente creación e investigación e incluso quizá desconocido para algunos de los lectores, sin embargo, es fascinante la cantidad de posibilidades que abre, las cuales hace muchos años atrás eran inimaginables.
Deep Learning se enfoca en la construcción de programas o sistemas de cómputo que pueden gestionar datos y transformarlos en información útil que genere conocimiento. Se han desarrollado diversas plataformas enfocadas en esta gestión y hoy en día ya se pueden crear diversas aplicaciones a medida de las necesidades actuales. En el pasado su desarrollo había sido escaso debido principalmente a las limitaciones tecnológicas, sin embargo, con los recientes avances y con el incremento en las capacidades de procesamiento se ha logrado acelerar el uso de estos sistemas realizando distintas aplicaciones que son utilizadas por millones de usuarios teniendo su origen en el aprendizaje profundo.
Para realizar el diagnóstico de enfermedades por medio de imágenes fotoacústicas se debe contar con métodos y tecnologías de aprendizaje profundo, también es necesario contar con datos clínicos de PAI que permitan entrenar los modelos de aprendizaje profundo ya que en la actualidad se tiene poco acceso a datos de este tipo y al llevar estos modelos entrenados puramente con datos experimentales divergen mucho cuando se introducen datos clínicos, además los métodos creados deben ser de fácil uso e intuitivos para los profesionales de la salud, todo esto para que no suponga una carga de tiempo para ellos el manejar el equipo. Es necesario seguir introduciéndonos en el Deep Learning, revisar trabajos actuales en los que se aplican las imágenes fotoacústicas, desde la parte de reconstrucción hasta llegar al diagnóstico, y con ello proporcionar algunos materiales y recursos que pueden ser útiles a todos los interesados en estudiar estas áreas.