Introducción
La restricción del crecimiento intrauterino (RCIU) constituye una complicación del embarazo. Los recién nacidos con RCIU, se encuentran expuestos a un mayor riesgo de morbimortalidad perinatal y postnatal.1 Se asocia además con el desarrollo de enfermedades crónicas del adulto que cursan con alteraciones de causas metabólicas.2
En el RCIU hay presencia de hipoxia con un marcado incremento de marcadores de estrés oxidativo en la placenta y en el feto. Como consecuencia ocurren alteraciones en la estructura y función de diversas moléculas vitales como las proteínas, los lípidos y el ADN. Esto ocurre en situaciones como la anemia materna, la hipertensión, la preeclampsia, la diabetes gestacional, la adaptación de la gestante a la vida en las alturas con consecuencias para la madre y el recién nacido.3 La causa más frecuente de RCIU es la insuficiencia placentaria donde el feto se ve expuesto a una hipoxia crónica.4
Estudios actuales señalan que las influencias adversas intrauterinas y posnatales inmediatas podría llevar a una vasoconstricción en los órganos periféricos, incluyendo el territorio renal. Esto puede generar alteraciones estructurales y funcionales en el riñón debido a la hipoxia fetal.5 Estas alteraciones han sido propuestas como posibles causas para explicar la aparición de enfermedades crónicas que se asocian a este órgano, como es el caso de la hipertensión arterial,6 e insuficiencia renal.7 Por esta razón es importante el estudio del riñón en pacientes con antecedente de RCIU.
Las investigaciones realizadas en el RCIU refieren cambios renales como la reducción del número de nefronas; cambios neuroendocrinos provocando desregulación del eje hipotálamo-hipófisis-adrenal; y cambios vasculares con disfunción endotelial y reducción de la densidad de las arteriolas y capilares.6,7 Además se ha observado en ratas una disminución en el número de glomérulos con un aumento de la apoptosis, la posible causa de la disminución del número de glomérulos pudiera ser un aumento en la expresión de la apoptosis.7
Para prevenir y disminuir los efectos del estrés oxidativo y la hipoxia en RCIU se han empleado varios tratamientos con resultados contradictorios.1 Los autores sugieren que es necesario evaluar posibles opciones terapéuticas eficientes, para superar o prevenir la hipoxia provocada por la insuficiencia placentaria, ya que una gran cantidad de niños nacen con retraso del crecimiento intrauterino y su diagnóstico se realiza en estadios tardíos de la gestación.3
Recientemente se ha evidenciado que la EPO (Eritropoyetina) y su receptor específico (EPOR) tienen efectos en varios tejidos no hematopoyéticos como en algunos tumores, en células del sistema nervioso central,8 en células endoteliales,9 en las células epiteliales y tubulares del riñón,10 en el trofoblasto y en las células deciduales.11 Esta hormona promueve la angiogénesis, la inhibición de la apoptosis y tiene efectos antinflamatorios, con lo cual protege a estos tipos celulares de los efectos de la hipoxia.8
En años más recientes se ha estudiado el efecto renoprotector de esta molecula.12 En el riñón adulto se han encontrado receptores de EPO a nivel vascular y de otros sitios, especialmente de las células tubulares.12 En estudios experimentales tanto in vitro como in vivo que modelan enfermedades como la nefropatía diabética y el síndrome nefrótico se ha observado que cuando se suministra EPO mejora el daño inflamatorio de los podocitos y la albuminuria.9
En Cuba (2007) se obtuvo la patente de una eritropoyetina recombinante humana con bajo contenido de ácido siálico (neuro-EPO), la misma presenta utilidades terapéuticas superiores a la ácida porque tiene mayor afinidad con su receptor; elimina el riesgo de producir eritropoyesis y favorece la angiogénesis, la proliferación celular e inhibición de la apoptosis en zonas de isquemia cerebral.13
Las investigaciones han demostrado que la EPO presenta efectos citoprotectores en varios tejidos hipóxicos.10-13 Es preciso conocer su efecto durante la gestación con hipoxia al no existir investigaciones en la actualidad con respecto al uso de la misma en este tipo de pacientes, por lo se propone un posible tratamiento con Eritropoyetina recombinante humana con bajo contenido de ácido siálico en un modelo de insuficiencia placentaria para evaluar el desarrollo fetal y los efectos reparadores y protectores en el riñón fetal con hipoxia.
El objetivo de este trabajo es evaluar marcadores morfológicos de hipoxia en el desarrollo fetal y en el riñón, utilizando un modelo de insuficiencia placentaria tratado con Eritropoyetina humana con bajo contenido de ácido siálico (neuro-Epo) en ratas.
Métodos
Investigación realizada en el Instituto de Ciencias Básicas Preclínicas Victoria de Girón.
Se utilizaron 18 ratas de la línea Wistar adultas cuyo peso osciló entre 200 y 230 gramos (g), procedentes del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). Estos se mantuvieron con acceso libre al agua y al alimento, con una temperatura de 22 a 24 grados Celsius, con ventilación continua y ciclos de luz/oscuridad de 12 horas cada uno.
Cuando la rata hembra se encontraba en la fase estro del ciclo sexual, se procedió a realizar el apareamiento. Al día siguiente se comprobó la cópula mediante el lavado vaginal tomándose la presencia de espermatozoides como día cero de la gestación.
El día 16 de la gestación las ratas fueron pesadas y distribuidas al azar en tres grupos, un grupo control (grupo I) con 6 ratas y los dos grupos experimentales (grupos II y III) con 6 ratas cada uno. A las ratas de los grupos II y III se les realizó la intervención quirúrgica en el día 16 de la gestación. Se ligaron ambas arterias uterinas provocando insuficiencia placentaria y RCIU en la descendencia.14
Las madres del Grupo I no fueron intervenidas quirúrgicamente. Las ratas del grupo III, después de realizar la ligadura de las arterias uterinas, fueron tratadas con neuro-Epo con una dosis de 0,5mg/kg/día desde el día 16 hasta el día 19 de gestación. Se realizó eutanasia en el día 20 de la gestación bajo anestesia. Se efectúo una laparotomía a la madre para obtener los cuernos uterinos. Una vez extraídos se tomaron los fetos y sus placentas.
Todas las placentas y sus fetos se pesaron en una balanza digital (gr). Se calculó el Índice peso placenta/peso fetal dividiendo el peso de la placenta entre el peso fetal. Posteriormente en el feto se midió su talla desde la coronilla hasta el extremo de la cola utilizando un papel milimetrado. También se midió el diámetro anteroposterior y el diámetro biparietal usando un pie de rey.
Se le realizó una laparotomía al feto y fueron extraídos los riñones los cuales fueron fijados en formalina tamponada al 10 %. El tejido renal fue incluido en la parafina, cortado y coloreado con hematoxilina eosina y PAS. Las muestras fueron fotografiadas con cámara fotográfica Motic acoplada a un microscopio Motic. Las imágenes digitalizadas con el programa Motic plus 2 fueron transferidas a una computadora, el análisis de las muestras fue realizado con la ayuda del programa Imagen J.
La morfometría renal se realizó a un aumento de 10x y se midieron las siguientes variables: la longitud del riñón (mm) desde el polo superior del riñón hasta el polo inferior, la longitud transversa del riñón (mm) desde la pelvis renal hasta el lado contralateral, la longitud de la médula renal(mm)desde la pelvis renal al borde interno de la corteza y la longitud de la corteza renal se calculó restándole la longitud de la médula renal a la longitud transversa del riñón.16
Se determinó el número y el área de los glomérulos en 10 campos por lámina. Se analizó la morfología del corpúsculo renal utilizando las tinciones de hematoxilina y eosina (HE), y ácido periódico Shiff (PAS) a un aumento de 40x y 100x, para ello se tuvo en cuenta la morfología de las células epiteliales o podocitos y la organización de las células del mesangio con su matriz extracelular.
Para realizar el análisis estadístico de los resultados se confeccionó una base de datos en Microsoft Excel y se procesaron con el programa GraphPadPrim5. Para las variables con distribución normal se empleó el t-test y para variables sin distribución normal el test no paramétrico de Kruskal-Wallis (para variables múltiples independientes). Las diferencias se consideraron significativas cuando los valores de p fueron iguales o menores a 0,05.
Resultados
El análisis de las variables de crecimiento fetal mostró que el grupo control (grupo I) presentó mayor número de fetos vivos, mayor peso, mayor talla y mayor diámetro biparietal (diámetro BP) con diferencias significativas con respecto a los grupos experimentales. No presentaron diferencias significativas entre los grupos experimentales con respecto a estas variables. El diámetro antero-posterior (diámetro AP) de la cabeza se comportó igual en los tres grupos. El índice peso placenta/peso fetal fue mayor en el grupo con RCIU tratado con diferencias significativas con respecto al RCIU y el control. Esto indica que las placentas son menos eficientes. (Tabla 1).
Las variables morfométricas en los cortes histológicos del riñón como: las medidas de la médula renal, la corteza renal, la longitud del riñón y longitud transversa del riñón no mostraron diferencia significativa entre los grupos.
Respecto al número de glomérulos por grupos se apreció el grupo con RCIU tratado con neuro-Epo presentó mayor número de glomérulos con diferencias significativas con respecto al grupo control y el grupo con RCIU. Entre este último grupo y el control no se evidenciaron diferencias significativas.
En las áreas de los corpúsculos renales, se observó que el grupo con RCIU presentó mayor área con diferencias significativas con respecto al control y al grupo RCIU tratado con neuro-Epo. Entre el grupo control y el grupo con RCIU tratado no se presentaron diferencias significativas. (Gráfico 1).
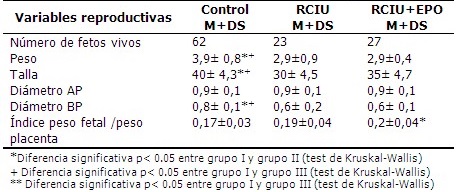
Al comparar el grupo control en la microfotografía A y el grupo con RCIU en la microfotografía B se observó en el grupo con RCIU un desprendimiento de los podocitos hacia el espacio intercapsular. En el centro del glomérulo aumenta la desorganización de las células mesangiales con su matriz extracelular. En el grupo con RCIU tratado representado en la microfotografía C se pueden observar las estructuras renales muy similares al control. (Figura 1).
En la misma figura al examinar los túbulos contorneados proximales en el grupo control y el grupo con RCIU, en el grupo con RCIU se halló un aplanamiento de las células del epitelio tubular y denudación o desprendimiento de las células con un aumento de la luz tubular. En el grupo con RCIU tratado se observa la luz de los túbulos contorneados proximales más pequeñas y menos pérdida de las células epiteliales de los túbulos. Estas características son más similares al control.
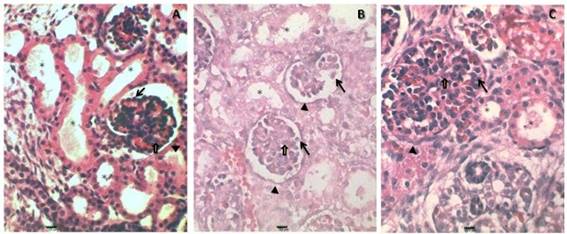
Fig. 1 - Fotomicrografía de riñones. ABC con tinción H/E y aumento a 40x en el día 20 de la gestación. A. Control: túbulos proximales (asterisco), células mesangiales (flecha amarilla), podocitos unidos a sus membanas (flecha negra). B. RCIU glomérulo (cabeza de flecha), Desprendimiento de los podocitos (flecha negra), dilatación de los túbulos (asteriscos), desorganización células mesangiales (flecha amarilla). C. Podocitos unidos a sus membranas (flecha negra), túbulos mejor organizados, en recuperación (flecha asterisco)
Para confirmar las lesiones encontradas a nivel de corteza renal fetal en el día 20 de la gestación, se realizaron microfotografías con tinción de H/E y PAS a un aumento de 100x.
En la Figura 2 se observan las microfotografías con tinción de H/E y PAS a un aumento de 100x. La microfotografía B representa el grupo con RCIU, en esta imagen se puede observar el desprendimiento de los podocitos y la vacuolización de los núcleos con nucléolos prominentes, todo esto indica señales de hipoxia. A nivel del glomérulo las células mesangiales se encuentran desorganizadas; estos cambios patológicos del glomérulo se han descrito en la glomeruloesclerosis focal global. En los túbulos contorneados proximales se observa el epitelio tubular aplanado, con pérdida de las células de este epitelio en algunas regiones del túbulo, estas características crean una luz más amplia en esta estructura.
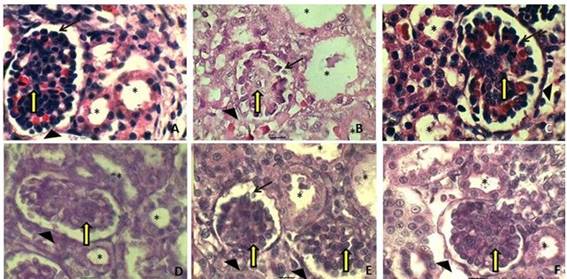
Fig. 2 -Fotomicrografía de riñones. ABC con tinción H/E y aumento a (100x en el día 20de gestación. A: muestra estructura normal del glomérulo renal (punta de flecha), células mensangiales (flecha amarilla), los túbulos proximales (asterisco); B: muestra en el RCIU el glomérulo (punta de flecha), desprendimiento de podocitos al espacio urinario (flecha negra), túbulos proximales (asterisco) aplanamiento y denudación de las células del epitelio tubular, vacuolización de los núcleos, desorganización células mesangiales (flecha amarilla); C: muestra glomérulo renal (punta de flecha), los podocitos (flecha negra), los túbulos proximales con recuperación de las células epiteliales (asterisco). D.E.F. con tinción PAS a (100x) en el día 20 de la gestación. D: muestra glomérulo y túbulos con arquitectura normal; E: muestra túbulo proximal con pérdida del núcleo de células epiteliales (asterisco), desprendimiento de podocitos al espacio urinario (flecha negra); F: muestra mejor organización de glomérulo y túbulos (signos de recuperación).
Al comparar el grupo con RCIU tratado con neuro-Epo representado en la microfotografía C y el grupo control representado en la microfotografía A, se observa a nivel del glomérulo que los podocitos presentan la morfología celular similar al grupo control, Estos están unidos a las membranas basales, bien organizados y sin signos aparentes de cambios morfológicos. También se puede observar gran similitud entre las células mesangiales de los dos grupos y las células epiteliales de los túbulos.
En el grupo con RCIU tratado representado en la microfotografía F se observan signos de regeneración epitelial a nivel de los túbulos contoneados proximales, que se evidencian por el aumento del número de células y mejor organización de la luz del túbulo. Este proceso de recuperación es normal después de la hipoxia, y en los grupos que se le suministra neuro-Epo estos signos se hacen evidentes más rápido en el periodo fetal.
Discusión
En el presente estudio, la ligadura de las arterias uterinas está asociada a una reducción de las medidas fetales como el peso, la talla y los diámetros de la cabeza, confirmando el efecto negativo del bajo flujo sanguíneo en el crecimiento fetal demostrado anteriormente.15,16
Al administrarles tratamiento con neuro-Epo a las ratas gestadas con ligadura de las arterias uterinas no mejoraron las variables de crecimiento fetal. Este tratamiento fue insuficiente para mitigar esos efectos, lo cual pudiéramos pensar que es debido a que en este modelo existe una reducción significativa del flujo sanguíneo al ocluir totalmente las arterias próximas a la terminación del cérvix de cada cuerno uterino. A nivel del tejido placentario se produce una isquemia severa y como resultado otros autores han observado gran cantidad de reabsorciones y variación en el peso fetal.16,17
La relación peso placenta / peso fetal en el periodo estudiado es mayor en RCIU tratadas con neuro-Epo. Lo que representa un aporte menor de gramos al feto por gramos de placenta y esto disminuye la eficiencia placentaria.4
Morgado y colaboradores estudiaron la morfología placentaria de RCIU por ligadura bilateral de las arterias uterinas, ellos encontraron diferencias en las áreas de las zonas de la placenta de las ratas en comparación con los controles y con el grupo tratado con neuro-EPO. En el grupo con RCIU disminuyó el tamaño de la zona del laberinto comprometiendo el intercambio entre los tejidos trofoblásticos y el vaso fetal. En el grupo tratado con neuro-Epo el laberinto fue semejante al control pero las células del espongiotrofoblasto se observaron con forma estrellada o mesenquimática con abundante matriz extracelular.17 Estas diferencias en la organización del espongiotrofoblasto pudieran explicar el mal funcionamiento de la placenta y el bajo peso fetal en este grupo tratado. Otros autores plantean, que un fracaso en la diferenciación de otros tipos celulares del espongiotrofoblasto como células del trofoblasto invasivo endovascular, pudieran comprometer el remodelado de las arterias uterinas y el flujo sanguíneo placentario favoreciendo en este modelo la aparición de retardo en el crecimiento intrauterino.18
En nuestra investigación a nivel del riñón fetal no hay cambios en el número de glomérulos en el grupo con RCIU con respecto al control, estos resultados no coinciden con lo que recoge la literatura. En estudios realizados con modelos de insuficiencia placentaria que causan hipoxia con disminución del flujo renal se observó una reducción del número de nefronas y en otros indicadores.19 Pudiéramos pensar que en nuestro estudio no varía el número de glomérulos debido a que en este modelo el grado de RCIU no es uniforme y aparecen diferentes fenotipos metabólicos a nivel renal. El feto está expuesto a diferentes grados de hipoxia en dependencia de la ubicación que tenga en el cuerno,20 y en nuestro estudio no se tuvo en cuenta la ubicación del feto en el cuerno. En un mismo cuerno los fetos están expuestos a diferentes microambientes que producen modificaciones en las histonas y en la metilación del ADN. Esta modificación trae consigo cambios en la transcripción de genes y una predisposición a la enfermedad renal.20 Sin embargo, en el grupo con RCIU tratado con neuro-EPO se observa un aumento del número de glomérulos posiblemente como respuesta adaptativa. Esta molécula pudiera mejorar la organización del glomérulo, el endotelio de los vasos y preservar la arquitectura del intersticio renal y vascular.10
A pesar que no disminuye el número de glomérulos encontramos aumento del área del corpúsculo renal en el grupo con RCIU. Esto confirma lo encontrado en otros estudios experimentales en ratas con modelos de restricción del crecimiento intraútero. Ellos observaron hipertrofia glomerular, con cambios escleróticos, con un aumento del depósito de colágeno en el intersticio tubular e inflamación que pueden desencadenar glomeruloesclosis,21 y posteriormente estas modificaciones pudieran desarrollar enfermedades renales severas.22
El estudio histopatológico del riñón presentó daño glomerular y tubular. A nivel del glomérulo se observó un desprendimiento de las células epiteliales (podocitos), una desorganización de las células mesangiales y su matriz extracelular, estas alteraciones han sido descritas en la isquemia que provoca la hipoxia acompañado de lesiones destructivas como la necrosis y la apoptosis. A nivel molecular hay una disminución de ATP y un aumento del Ca intracelular, lo cual activa las proteasas y fosfolipasas provocando lesión en el citoesqueleto y en las membranas celulares, además se acompaña de un aumento de las formas reactivas de oxígeno, activándose la cascada de caspasas que produce necrosis y apoptosis tanto en las células epiteliales como en las células mesangiales y en las células del epitelio tubular.22 A nivel de los túbulos hay denudación de las células, amplitud de la luz tubular con pérdida de las microvellosidades. En los riñones de fetos tratados con neuro-EPO, se aprecia una mejor organización en el tejido dañado por la hipoxia, aunque todavía de manera focal se aprecian lesiones glomerulares y tubulares por la hipoxia.
La protección a los tejidos de la EPO se ha evidenciado por aumento de la angiogénesis, su efecto antiinflamatorio y antiapoptótico. Los estudios han demostrado que la EPO suprime el efecto inflamatorio que provoca la reperfusión en el riñón, ya que reduce las especies reactivas del oxígeno por inhibición de los polimorfonucleares e infiltración de los neutrófilos. Además, reduce la producción de citoquinas proinflamtorias como la TNF alfa (factor de necrosis tumoral alfa) y las interleuquina 6 y estimula la expresión de citoquinas antiinflamatorias como la interleuquina 10.23
Otros estudios realizados in vitro de células endoteliales de la vena umbilical y células epiteliales del túbulo proximal renal en humanos, conjuntamente con estudios in vivo en riñones de ratas, con la administración de rhEPO, se encontró aumento de HIF-1α, VEGF(factor de crecimiento vasculo endotelial) y BMP7(proteína morfogenética ósea 7), los cuales estimulaban la proliferación celular, disminuyendo la hipoxia tubular y la cuantificación del número de células apoptóticas (técnica marcaje de la fragmentación nuclear) (TUNEL).24
En otro modelo en ratón en el cual se realizó la oclusión bilateral de la artería renal y se le administró rhEPO se observó disminución de la hipoxia y el daño renal, represión de apoptosis y regulación del gen antiapoptótico de la familia Bcl-2.10. Todos estos estudios confirman el carácter renoprotector de la EPO.
En nuestra investigación la molécula de EPO no es exactamente la misma que ha sido utilizada en otros estudios. Hasta el momento existen contradicciones en relación con la permeabilidad de esta molécula en la membrana placentaria, sin embargo, estudios realizados en modelos de isquemia y perfusión en fetos de ratas tratadas con rhEPO, se incrementó la permeabilidad de la rhEPO radioactiva a través de la membrana placentaria y la barrera sangre-cerebro en condiciones de hipoxia e isquemia fetal, encontrándose moléculas marcadas en el líquido amniótico, la placenta y los órganos fetales,25 a pesar de que no fue posible identificar a nivel de los tejidos fetales esta molécula en nuestro estudio se evidenció su carácter citoprotector ante los daños provocados por la hipoxia a nivel del riñón fetal.
La eritropoyetina gana espacio como opción terapéutica durante el embarazo. Sin embargo, se necesitan más estudios que establezcan el momento de aplicación del medicamento y el ajuste de las dosis,26 así como su repercusión en la vida posnatal.
Se puede concluir que el tratamiento con neuro-Epo no favorece el crecimiento fetal en la descendencia de ratas gestadas con RCIU, sin embargo ejerce efectos reparadores y protectores en las alteraciones histológicas provocadas por la hipoxia en el riñón fetal.