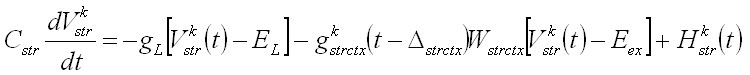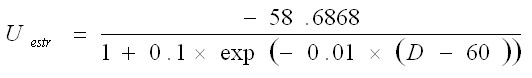My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ingeniería Electrónica, Automática y Comunicaciones
On-line version ISSN 1815-5928
EAC vol.33 no.2 La Habana May-Aug. 2012
ARTICULO ORIGINAL
Dinámica neuronal del circuito motor: un estudio de resonancia magnética funcional
Neuronal dynamic of motor circuitry: a functional magnetic resonance imaging study
Ing. Karla Batista García-Ramó, MSc. Rafael Rodríguez Rojas, Lic. Maylén Carballo Barreda
Centro Internacional de Restauración Neurológica, La Habana, Cuba. kbatista@neuro.ciren.cu, rafael@neuro.ciren.cu, maylen.carballo@neuro.ciren.cu
RESUMEN
La modelación de redes neuronales que describan la interacción funcional del circuito cerebral formado por los ganglios basales (GB), el tálamo y la corteza está limitada por las simplificaciones necesarias para reproducir sus propiedades biológicas. Este trabajo tiene como objetivo general modelar el circuito GB-tálamo-corteza para la selección de un programa motor, sobre la base del patrón de conectividad funcional obtenido por imágenes de resonancia magnética nuclear funcional (RMNf). Se incluyeron cinco poblaciones neuronales y dos circuitos paralelos en competencia. La determinación de los pesos de las conexiones entre las poblaciones neuronales a partir de imágenes de RMNf, contribuyó a una formulación más realista del modelo, permitiendo describir la participación de los GB en la selección de una acción en estado normal y en la enfermedad de Parkinson (EP). La simulación permitió demostrar que ante una pérdida de dopamina superior al 40%, el circuito GB-tálamo-cortical no es capaz de seleccionar entre dos programas motores; y además reflejó la capacidad de adaptación del sistema para compensar el trastorno funcional del circuito motor en la EP, coincidente con estudios clínicos y experimentales.
Palabras claves: modelo computacional, RMNF, circuito de ganglios basales.
ABSTRACT
Formulation of models describing the functional interaction of brain circuitry comprising basal ganglia, thalamus and cortex is limited by simplifications necessary to replicate its biological properties. The main objective of present work is to simulate the basal ganglia-thalamus-cortex circuitry interaction in motor program selection, supported by functional connectivity pattern obtained by functional magnetic resonance imaging (fMRI). The model included five neuronal populations and two parallel competitive circuitries. Determination of connections weights between neural populations by RMNf, contributed to a more realistic formulation of the model and allowed to describe the participation of basal ganglia in motor program selection and the changes in Parkinson disease. The simulation allowed demonstrating that a dopamine depletion upper to 40% leads to a loss of action selection ability.
Also the modeled network reflected the system adaptation ability to compensate dysfunction in Parkinson disease, coincident with experimental and clinical studies.
Keywords: computacional model, FMRI, basal ganglia network.
INTRODUCCION
En el estudio de las funciones motoras se ha demostrado la participación de los ganglios basales (GB), un conjunto de núcleos cerebrales subcorticales interconectados entre sí. La enfermedad de Parkinson (EP) constituye un trastorno de la función motora, caracterizada por la pérdida de células dopaminérgicas en los GB. Recientemente se han publicado varios modelos computacionales que describen la participación de los GB en la selección de una tarea motora 1 2 3. La principal limitación en la simulación en gran escala del circuito motor GB-tálamo-cortical radica en las múltiples simplificaciones a tener en cuenta para replicar las propiedades del sistema biológico, y al mismo tiempo formular un modelo computacional accesible.
El término conectividad funcional caracteriza las interacciones neurofisiológicas funcionales a través de conexiones estructurales, que pueden derivarse de correlaciones temporales de la actividad neuronal reflejada por las imágenes de resonancia magnética nuclear funcional (RMNF). En particular, el estudio de la conectividad funcional por imágenes de RMNF es una vía a nuestro alcance para estudiar la compleja dinámica del circuito GB-tálamo-corteza.
Este trabajo presenta un modelo biofísico que describe la interacción del circuito GB-tálamo-cortical en la selección de un programa motor, y utiliza parámetros neurofisiológicos obtenidos por técnicas de neuroimágenes para superar algunas de las limitaciones de los modelos precedentes.
MATERIALES Y MÉTODOS
A. Modelo de los ganglios basales en la selección de una acción.
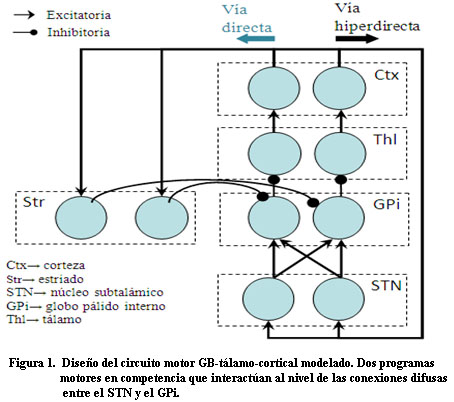
El modelo se centra en la participación de los GB en la selección de una acción y en la simulación de los cambios asociados a la EP. La red, conformada por cinco poblaciones de neuronas: corteza (Ctx), estriado (Str), núcleo subtalámico (STN), globo pálido interno (GPi) y tálamo (Thl), reproduce el procesamiento a través de dos de las vías descritas para el circuito motor: la vía hiperdirecta y la directa 3. La simulación consiste en dos circuitos paralelos (k = 1, 2), cada uno procesa en paralelo un programa motor (Figura1), que interactúan al nivel de las poblaciones del STN y el GPi.
Unidades neuronales: La actividad de cada unidad neuronal está determinada por las ecuaciones de potencial, basadas en el modelo de Hodgkin-Huxley:
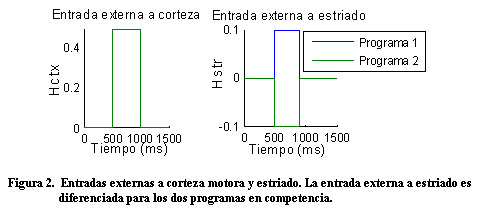
Vkw representa el potencial de membrana de la unidad neuronal w en el circuito k y gkwv y Wwv representan, respectivamente, la conductancia sináptica y el peso de las conexiones entre las poblaciones neuronales v y w. Las entradas a corteza son iguales para ambos circuitos H1ctx = H2ctx = 0.5 y las entradas selectivas y transitorias a estriado son modeladas por un pulso más corto y diferenciado para los dos circuitos H1str = 0.1 y H2str = -0.1. La tabla 1 muestra los valores de estos parámetros. La conductancia sináptica dependiente del voltaje se modeló con la siguiente ecuación donde el numerador representa la conductancia máxima y U el potencial umbral:
El sistema de ecuaciones diferenciales se resolvió por el método de Runge Kutta utilizando MatLab 7.6.
Enfermedad de Parkinson: La consecuencia de la pérdida de neuronas dopaminérgicas de la sustancia negra compacta (SNc) se modeló considerando dos efectos: la dependencia del potencial umbral de las neuronas estriatales (ecuación 7) y de la conexión sináptica Ctx-Str (ecuación 8) del nivel de dopamina.
B. Conectividad funcional.
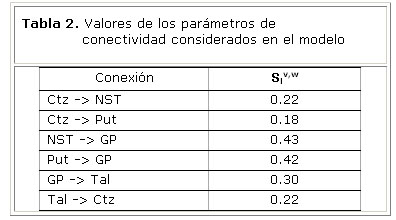
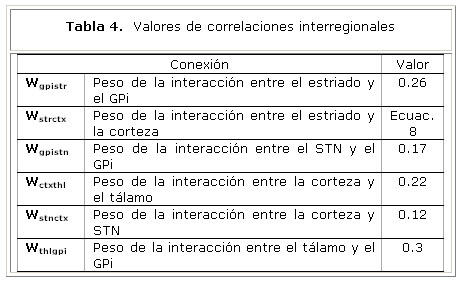
Los índices de conectividad efectiva Slv,w de interés para nuestro modelo, aparecen en la tabla 2. Las imágenes de RMNf se adquirieron en 10 sujetos sanos, durante la realización de un paradigma motor guiado por pistas externas 4. Los sitios con cambios significativos de actividad fueron calculados utilizando el modelo lineal general. Los parámetros de conectividad Slv,w, fueron calculados de acuerdo al modelo NN-ARx 5.
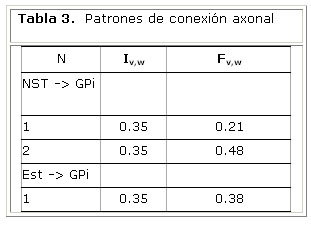
Para determinar correlaciones interregionales se segmentó el volumen en regiones definidas por un atlas estereotáctico. En este trabajo se utilizó un atlas de 71 estructuras cerebrales definidas a partir de imágenes de RMN. Las limitaciones en la segmentación topográfica fueron minimizadas mediante la introducción de pesos a los valores de conectividad 6. Se definió la probabilidad de conexión anatómica Pvw como la relación entre la fracción de conexiones que proyectan de v a w (tabla 3) y la fracción total de ramificaciones axonales de la unidad Pv hacia Pw:
El índice de conectividad efectiva estará definido por:
Resultados
A. Conectividad funcional basada en imágenes de RMNf.
La tabla 4 muestra los pesos estimados de las conexiones entre las unidades neuronales del modelo. Estos resultados sugieren un mayor nivel de conectividad en la vía directa en comparación con la vía hiperdirecta.
B. Selección de la acción en estado normal (D=100%).
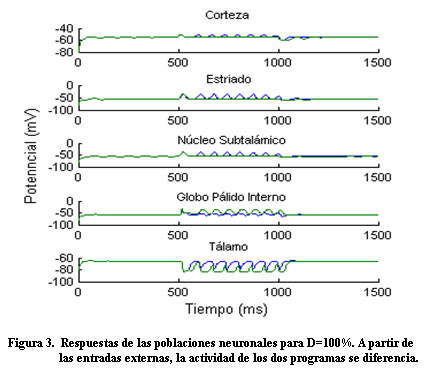
Antes de las entradas externas, las unidades neuronales se caracterizan por una actividad espontánea. A partir de las entradas (Figura 2), la actividad en la corteza aumenta de igual forma para ambos programas; luego, la actividad en la corteza para uno de los programas llega a ser más grande que para el otro, en correspondencia con la selección de una acción (Figura 3).
C. Pérdida de la capacidad de selección de la acción con la disminución del nivel de dopamina.
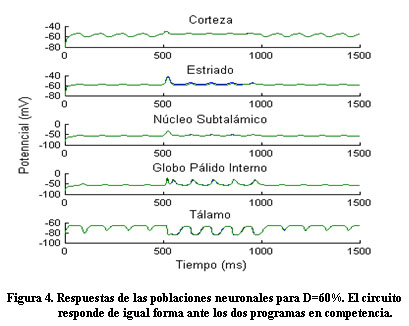
Para un valor de D=60% el circuito responde de igual forma ante los dos programas; indicando la incapacidad del sistema de ejercer la selección de una acción (Figura 4).
D. Recuperación de la capacidad de selección ante una fuerte entrada externa a la corteza motora.
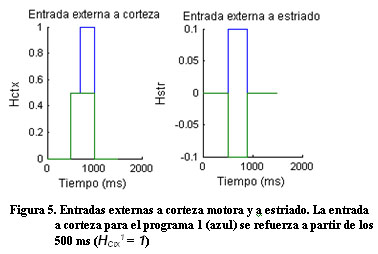
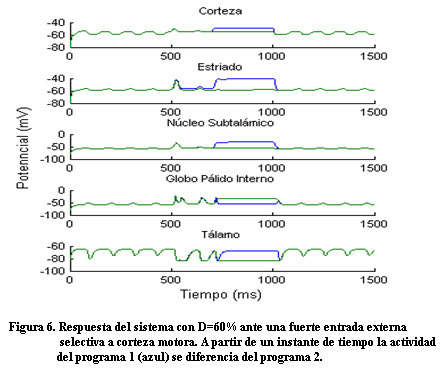
Ante una intensa entrada externa selectiva a corteza (Figura 5), el sistema nuevamente responde de manera diferente ante los dos programas (Figura 6).
Discusión
A. Conectividad funcional basada en RMNF.
Los modelos computacionales previos de los GB han requerido de parámetros de conectividad obtenidos mediante métodos invasivos, lo que imposibilita su comprobación en sujetos sanos y obliga a realizar simplificaciones en los modelos. La capacidad del modelo descrito para reproducir patrones fisiológicos conocidos, permite soportar el criterio de que la RMNf es un método no invasivo para calcular la fortaleza de las conexiones. Adicionalmente, la aplicación de índices de conectividad, calculados mediante el método NN-ARx, permite explorar el patrón de conexiones en todo el volumen cerebral, descartando la necesidad de pre-definir un modelo anatómico de interconexiones.
B. Selección de la acción en estado normal (D=100%).
Consistente con otros modelos de los GB, el NST provee una señal (vía hiperdirecta), que inicialmente inhibe la actividad de salida del tálamo. Luego, en respuesta a la señal diferenciada procedente de estriado, la actividad en la corteza para uno de los programas llega a ser más grande que para el otro, (Figura 4) en correspondencia con la selección de una acción. Resultados similares fueron obtenidos por Leblois 3 y Frank 1.
C. Pérdida de la capacidad de selección de la acción con la disminución del nivel de dopamina.
A partir de lo obtenido por Calabresi 7 la disminución de dopamina se modeló teniendo en cuenta la dependencia del potencial umbral de las neuronas estriatales y de la conexión Ctz-Est de la dopamina. En el modelo propuesto, para un D = 60 % la respuesta del circuito para los dos programas es prácticamente la misma, lo que sugiere una pérdida de la capacidad de selección de un acción en el circuito, similar a lo encontrado por otros investigadores 3.
D. Recuperación de la capacidad de selección ante una fuerte entrada externa a la corteza motora.
Diferentes estudios de tomografía por emisión de positrones (PET), tomografía computarizada por emisión de fotones (SPECT) y RMNf exponen evidencias de los mecanismos que desarrollan los pacientes con la EP para compensar el trastorno funcional del circuito motor 8. La hiperactividad encontrada en otras regiones del cerebro se asocia a un mecanismo adaptativo del sistema de valerse de otros circuitos relativamente sanos con el objetivo de facilitar la ejecución del movimiento. Teniendo en cuenta la hiperactividad encontrada en otras áreas del cerebro se modeló una fuerte entrada externa selectiva a corteza para un nivel de dopamina de D=60% y como resultado el sistema recupera la capacidad de seleccionar una acción.
Conclusiones
La determinación de los pesos de las conexiones entre las diferentes poblaciones neuronales del circuito GB-tálamo-corteza a partir de estudios de conectividad funcional por imágenes de RMNf y en correspondencia con estudios anatómicos, contribuyó a una formulación más realista del modelo y la obtención de resultados comparables a los datos experimentales y clínicos. La modelación de la dependencia del potencial umbral del estriado y de la conexión sináptica corteza-estriado del nivel de dopamina permitió demostrar que ante una pérdida de dopamina superior al 40% el circuito no es capaz de seleccionar entre dos programas motores. La capacidad del circuito modelado de responder a entradas externas selectivas a corteza motora, de mayor amplitud, reflejó la capacidad de adaptación del sistema para compensar el trastorno funcional del circuito motor en la EP, coincidente con estudios clínicos y experimentales.
REFERENCIAS
1. Frank, M.J.: «Hold your horses: A dynamic computational role for the subthalamic nucleus in decision making» en Neural Networks, Vol. 19. No. 8, 2006.
2. Hadipour, A.: «Transmission of the subthalamic nucleus oscillatory activity to the cortex: a computational approach» en Journal of Computational Neuroscience, Vol. 15. No. 2, 2003.
3. Leblois, A.: «Competition between feedback loops underlies normal and pathological dynamics in the basal ganglia» en The Journal of Neuroscience, Vol. 26. No. 13, 2006.
4. Bosch-Bayard, J., Riera, J., Biscay, R., Wong, K., Galka, A., Yamashita, O.: «Spatio-temporal correlations from fMRI time series based on the NN-ARx model» en Journal of Integrative Neuroscience, Vol. 9. No. 4, 2010.
5. Riera, J., Watanabe, J., Kazuki, I., Naoki, M., Aubert, E., Ozaki, T.: «A state-space model of the hemodynamic approach: non-linear filtering of BOLD signals» en Neuroimage, Vol. 21. No. 2, 2004.
6. Parent, A., Sato, F., Wu, Y., Gauthier, J., Lévesque, M., Parent, M.: «Organization of the basal ganglia: the importance of axonal collateralization» en Trends Neurosciences Vol. 23. No. 10, 2000.
7. Calabresi, P., Centonze, D., Bernardi, G.: «Electrophysiology of dopamine in normal and denervated striatal neurons» en Trends Neuroscience, Vol. 23, Supl. 1, 2000.
8. Ceballos-Baumann, Andres , O.:«Functional imaging in Parkinson´s disease: activation studies with PET, fMRI and SPECT» en J Neurol, Vol. 250. Supl. 1, 2003.
Recibido: Marzo 2012
Aprobado:Mayo 2012