My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ingeniería Mecánica
On-line version ISSN 1815-5944
Ingeniería Mecánica vol.16 no.2 La Habana May-Aug. 2013
ARTÍCULO ORIGINAL
Carbón activado de semillas de tomate para adsorción de vapores de amoniaco, benceno y gasolina
Activated coal of tomato seeds for adsorption of vapors of ammonia, benzene and gasoline
Francisco Márquez-MontesinoI, Rolando Zanzi-VigourouxII, Daniella BirbasII, Leonardo Aguiar-TrujilloI, Boris Abel Ramos-RobainaI
I Universidad de Pinar del Río, Facultad de Ciencias Técnicas, Pinar del Río. Cuba
II Royal Institute of Technology (KTH), Department of Chemical Engineering, Stockholm. Sweden
RESUMEN
El objetivo fue comprobar las posibilidades de adsorción de amoniaco, benceno y gasolina en carbones activados, de semillas de tomate. Se realizó un análisis inmediato a la biomasa. Se concluyó que la adsorción de vapores de amoniaco, está relacionada con la adsorción física y con la presencia de grupos funcionales de carácter ácido en la superficie activa de los carbones, que forman enlaces débiles con las moléculas de amoniaco. Se realizaron experimentos de adsorción de benceno y gasolina, que no tienen grupos funcionales como el amoniaco, siendo menos adsorbidos, confirmándose una adsorción preferentemente química. La temperatura de activación, la relación de impregnación (RI) y la concentración de la disolución ácida, no tuvieron una influencia significativa en la capacidad de adsorción de benceno, pero sí en la adsorción de amoniaco y vapores de gasolina, de gran aplicación para la eliminación de los vapores de escape en los motores de vehículos.
Palabras claves: carbón, activación, adsorción, vapores, amoníaco.
ABSTRACT
The objective was to prove the adsorption possibilities of ammonia, benzene and vapors of gasoline in activated coals with phosphoric acid, of tomato seed. An immediate analysis to the biomass was carried out. It was concluded that the vapors adsorption of ammonia, is related with the physical adsorption and the presence of functional groups of acid character in the active surface of the coal that form weak connections with the molecules of ammonia. Experiments of adsorption of benzene and gasoline were carried out, these substances haven't functional groups as the ammonia, so they were less adsorbed, and it was confirmed a chemical adsorption preferably. The activation temperature, the relationship of impregnation (RI) and the concentration of the acid dissolution haven't a significant influence in the capacity of adsorption of benzene, but they have in the adsorption of ammonia and vapors of gasoline, it's of great application for the elimination of vapors' escape in the motors of vehicles.
Key words: coal, activation, adsorption, vapors, ammonia.
INTRODUCCIÓN
Las posibilidades de contaminación ambiental causada por vapores de amoniaco, son muy amplias ya que esta sustancia química es utilizada en varios procesos industriales.
El amoniaco está presente, con frecuencia, en emisiones de diferentes industrias como la del procesamiento de los alimentos, industria del caucho y fertilizantes [1], así como en las plantas de tratamiento de agua [2], en áreas de centros asistenciales de salud pública y en procesos a presión, como los ciclos de refrigeración. Una forma muy eficaz para descontaminar el medio de vapores de amoniaco y otros, es la utilización de los carbones activados.
Asimismo, el carbón activado, colocado en cápsulas, es utilizado en el mundo como adsorbente de los vapores de gasolina de escape en motores de vehículos, de ahí la importancia del estudio de estos adsorbentes a partir de materia prima nacional con miras a su posterior introducción y generalización en la producción.
El carbón activado (CA) es un material poroso preparado por la carbonización y activación de precursores orgánicos, especialmente vegetales y forestales, hullas, lignitos y turbas, con el fin de obtener un alto grado de porosidad y una elevada área de superficie [3], la cual facilita la adsorción física de gases y vapores a partir de mezclas gaseosas o sustancias dispersas en líquidos [1].
La obtención del CA, puede realizarse por dos grande vías diferentes: la primera puedes ser carbonizando el material de partida y después activándolo con sustancias químicas gaseosas como O2, CO2, el vapor de agua [4-7] y combinaciones de los dos últimos, entonces se trata de activación física; la segunda es realizando en un solo proceso la carbonización y la activación al poner en contacto el material de partida con disolución de una sustancia química entre las que pueden mencionarse H3PO4, ZnCl2, H2SO4, KOH, NaOH [8-10] refiriéndose a la activación química. En esta segunda vía el carbón puede desarrollar grupos funcionales que mejoran la superficie reactiva de los carbones activados, mejorando la adsorción química de sustancias polares tales como el NH3. Esta sustancia ha sido estudiada por adsorción por estar presente en los procesos industriales siendo necesario controlarla para un mejor funcionamiento de los procesos y la descontaminación del medio [11].
Los carbones activados pueden tener grupos funcionales en su estructura, dependiendo si son grupos ácidos o básicos, de la temperatura de obtención, pero estos grupos funcionales pueden ser modificados por tratamiento químico [3]. Carbones activados modificados por impregnación de Fe, alcanzan valores de adsorción de NH3 del orden de 20 mg/g (masa de amoniaco/masa de adsorbente); esta adsorción de NH3 tiene lugar por la formación de iones amonio (NH4+), los cuales se enlazan a los grupos ácidos [1, 2]. El sepiolite, silicato fibroso constituido por canales microporosos, al tratarse con una disolución ácida, eleva su número de centros ácidos y su capacidad de adsorción de amoniaco [12].
El CA tiene una amplia gama de aplicaciones tanto en polvo como granular en medio líquido y gaseoso. En medio gaseoso encuentra sus aplicaciones en el almacenamiento y separación de gases y vapores, entre los cuales se encuentra el NH3 [12-14]. Otros vapores como benceno y gasolina, también pueden ser adsorbidos.
En este trabajo el objetivo fue comprobar las posibilidades de adsorción de amoniaco, benceno y vapores de gasolina en carbones activados con ácido fosfórico, de semilla de tomate
Se utiliza el método experimental donde se logran carbones activados con ácido fosfórico a partir de semillas de tomate obtenidas del procesamiento industrial. Se estudia la adsorción de yodo con el fin de tener información sobre el desarrollo de la estructura microporosa de los carbones; finalmente se someten las muestras de carbón a la adsorción de vapores de amoniaco, benceno y gasolina, que fueron las respuestas estudiadas y analizadas estadísticamente, alcanzándose diferentes valores de adsorción de amoniaco, lo que se relaciona con la presencia en el adsorbente, de grupos funcionales de carácter ácido unidos a átomos de oxígeno a través de enlaces por puente de hidrógeno (H-O) o formando grupos carbonilos (C = O).
La adsorción de benceno y gasolina mostraron valores inferiores a los obtenidos con el amoniaco, pero son considerables dada la importancia de poder almacenar estas sustancias con diferentes fines. La variables estudiadas tuvieron una incidencia significativa en las respuestas estudiadas, excepto en la adsorción de benceno.
MATERIALES Y MÉTODOS
Se estudia la capacidad de adsorción de vapores utilizándose como adsorbatos (sustancia a adsorber) amoniaco, benceno y gasolina, en diferentes carbones activados. En la preparación de los carbones activados, se consideraron las variables: temperatura de activación, concentración de la disolución ácida y relación de impregnación.
Preparación de la materia prima
La materia prima seleccionada es el residuo sólido del tomate, biomasa constituida por una mezcla de cáscaras y semillas resultantes del proceso de extracción de la pulpa. La selección de este material obedece a su abundancia en los procesos industriales del tomate en la provincia de Pinar del Río. La selección se hizo de manera aleatoria.
Propiedades físicas del material de partida
Se practicó un análisis inmediato al material de partida utilizando un horno mufla y crisoles refractarios. Las cenizas se determinaron por la norma ASTM D1102-84 [15] y la humedad por la norma ASTM D4933-99 [16]. La materia volátil fue determinada por la norma ASTM 3175-07 [17].
Los resultados de este análisis, se muestran a continuación:
Humedad: 7,03 %
Ceniza: 3,28 %
Volátiles: 83,47 %
Carbono Fijo: 9,13 %
Preparación de las disoluciones de ácido fosfórico
El ácido fosfórico con concentración y densidad original al 85 % y 1,685 g/cm3 respectivamente, fue utilizado para preparar las disoluciones a diferentes concentraciones. Para ello se utilizaron beaker de 500 mL y matraz aforado de 500 mL.
Carbón activado de semillas de tomate para adsorción de vapores de amoniaco, benceno y gasolina
Preparación del CA
El material de partida fue triturado y mezclado con disolución de ácido fosfórico tal como se explica a continuación [8, 18, 19, 20].
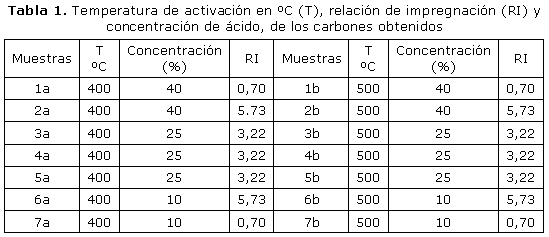
Para la selección de los experimentos a desarrollar y el análisis de todos los resultados alcanzados, se realizó un diseño de experimentos utilizándose el software Design-Expert® Versión 7, con un diseño factorial completo 2k [21] con el que se obtuvo el mínimo de experimentos a realizar para valorar la influencia de las variables independientes (temperatura de activación a valores de 400 ºC y 500 ºC, concentración de la disolución ácida a valores de 10 %, 30 % y 40 %, y relación de impregnación utilizada (RI-cm3 de disolución/cm3 de biomasa) en las respuestas analizadas, entre 0,7 y 5,73 , para el punto central 3,22; tomando como salida un estudio estadístico de análisis de varianza (Anova) para un nivel de significación del 95 % (α= 0,05), considerándose la distribución de Fischer-Snedecor (F). F (cada término) > Ftabulada como prueba de significación. A partir del nivel de significación fijado (α= 0,05), se valoró la Probabilidad (P) de que el valor de la distribución "F" sea verdadero, P < 0,05, que se utiliza para decidir si la fuente de variación que se analiza ejerce un cambio significativo en la respuesta.
Se desarrollaron 14 experimentos (7 a 400 ºC y 7 a 500 ºC) con diferentes valores de concentración de ácido y diferentes valores de RI, como se muestra en la tabla 1 atendiendo a los resultados del diseño experimental. Las muestras fueron colocadas en crisoles y dejadas en reposo a temperatura ambiente durante 60 minutos, tiempo necesario para la reacción del ácido con la celulosa. A continuación fueron colocadas en una mufla eléctrica para su activación a las temperaturas mencionadas, en atmósfera oxidante, con tiempo de activación de 20 minutos [18]. Una vez concluida la activación, las muestras fueron enfriadas para después lavarse con agua destilada a temperatura de 70 ºC, con agitación magnética por un tiempo de 20 minutos, con el fin de eliminar la acidez, llevando el pH al valor aproximado de 6, secándose las muestras a 100 ºC en estufa y pesadas hasta peso constante [20].
Finalmente, las muestras fueron puestas en contacto con vapores de amoniaco, benceno y gasolina, con el objetivo de comprobar la capacidad de adsorción de estas sustancias.
Determinación del número de Iodo
Este estudio se hizo con el fin de obtener información acerca del desarrollo de la estructura microporosa de los carbones obtenidos y poder diferenciar si la adsorción fue preferentemente física en los microporos o química a través de grupos funcionales presentes en la superficie activa de los carbones.
Para la determinación del índice de Iodo se aplicó la norma ASTM D4607-94 [22]. A altos valores de desarrollo de estructura porosa pueden corresponder números de yodo de 1000 y superiores.
Adsorción de vapores
Además de la adsorción de amoniaco, se realizaron pruebas de adsorción de benceno y gasolina, cuyas moléculas son de mayor dimensión que las de amoniaco, lo que permitió dar una información de la estructura porosa de los carbones. También los resultados alcanzados acerca de la adsorción de estas dos sustancias, abren el camino para futuras investigaciones.
Las diferentes muestras de carbón fueron colocadas en vidrio reloj. En tres beaker de 100 mL se colocaron: 2 cm3 de amoniaco, benceno y gasolina regular indistintamente. Las muestras de CA y las correspondientes cantidades de sustancias, se colocaron en una desecadora de cristal. Las concentraciones de estos adsorbatos fueron al estado de máxima pureza existente. Para conocer lo adsorbido por el CA, después de 24 horas en contacto adsorbente-adsorbato según experiencias previas con otros carbones obtenidas en el Programa de Ciencia y Técnica (PCT) 06 del Ministerio de Ciencia Tecnología y Medio Ambiente. CITMA de 1985, las muestras fueron pesadas en balanza analítica con precisión de 0,0001 g y capacidad máxima de 61 g, determinándose la masa adsorbida por diferencia antes y después de la adsorción.
Los experimentos de adsorción se efectuaron a 101,3 kPa, valor muy inferior a la presión de saturación de los adsorbatos utilizados.
RESULTADOS Y DISCUSIÓN
Obtención de los carbones activados para la adsorción de vapores
La tabla 1, muestra el esquema experimental derivado del diseño aplicado, para la preparación de los carbones activados.
Aplicaciones de los carbones obtenidos a la adsorción de vapores contaminantes del medio ambiente
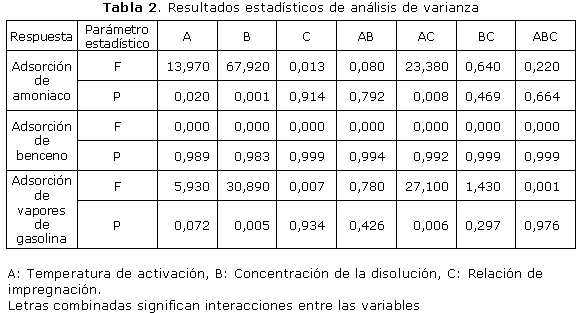
En la tabla 2, se presentan los resultados estadísticos del análisis de varianza.
Amoniaco
La tabla 3 muestra los valores obtenidos en la adsorción de amoniaco.
Por el modelo estadístico aplicado del análisis de varianza se comprobó que la temperatura de activación, la concentración de la disolución ácida y la interacción temperatura de activación-RI, son términos significativos del modelo, teniendo una influencia significativa en la adsorción.
Una elevada adsorción fue obtenida en los carbones activados a 500 ºC al compararla con los carbones obtenidos a 400 ºC, a mayor concentración de la disolución y mayor RI; para RI de 0,70 también aumenta la adsorción lo que indica la marcada influencia del aumento de temperatura de activación en la capacidad de adsorción de amoniaco. Al comparar la adsorción a concentración de la disolución de 10 % a un mismo valor de temperatura de activación se observa también una disminución en el valor de adsorción para ambas temperaturas, siendo mejores los resultados a 500 ºC que a 400 ºC excepto para RI de 0,70. El mejor valor de adsorción se logró en el carbón obtenido a 500 ºC, con 40 % de concentración de la disolución y 5,73 de RI.
El incremento de los porcentajes de adsorción de amoniaco, puede estar relacionado con el incremento de los grupos funcionales en la superficie del carbón así como con la presencia de una estructura microporosa más desarrollada, pues cómo se señala en la literatura [14], en el caso del amoniaco, la adsorción en carbones microporosos ocurre por dos mecanismos, el primero relacionado con la afinidad del amoniaco con el oxígeno presente en la superficie del carbón (grupos funcionales) y el segundo mecanismo se fundamenta en el clásico proceso del llenado de microporos, a lo cual también contribuye la activación química. No obstante ha de prevalecer la primera causa ya que los números de yodo obtenidos en las condiciones estudiadas para las muestras 2a y 3a de 400 ºC, así como 1b y 2b de 500 ºC (420, 431, 429 y 560 respectivamente) no muestran un amplio desarrollo del área de superficie microporosa que justifique una
adsorción física del vapor. La presencia de grupos funcionales, facilita la adsorción química de las moléculas de amoniaco. Estos grupos prevalecen a temperatura por debajo de 800 ºC [3].
Benzeno
La tabla 4 muestra la adsorción de benceno en el CA producido.
El análisis estadístico aplicado demostró que las variables estudiadas no son términos significativos, o sea, no influyen significativamente en la respuesta adsorción de benceno.
La adsorción en los carbones obtenidos a 500 ºC fue mayor que los adsorbidos a 400 ºC. Mayores valores de adsorción también se obtuvieron en carbones activados obtenidos con elevada concentración de ácido y elevada relación de de impregnación. Se observó un máximo valor de adsorción de 54.1%, en carbones activados a 500 ºC con concentración de la disolución ácida de 40 % y relación de impregnación (RI) de 5.73.
La mayor adsorción de benceno a temperatura de activación de 400 ºC, resultó en el CA preparado con RI de 5,73 y 40 % concentración de ácido; a menores valores de RI, la capacidad de adsorción del carbón disminuye. Esta observación se repite para los carbones obtenidos a 500 ºC. Al comparar la adsorción de benceno con la adsorción de amoniaco, la del primero es menor, lo cual se relaciona con el bajo desarrollo de la estructura porosa alcanzada en estos carbones tal como indican los resultados obtenidos con los ensayos realizados de adsorción de yodo; aunque no se descarta la posibilidad de adsorción química por una polarización inducida de las moléculas de benceno.
No obstante en el CA a 500 ºC, hay un incremento de la adsorción de benceno a concentración de la disolución de 40 % y elevados valores de impregnación, lo cual puede estar relacionado con un mayor desarrollo de la estructura mesoporosa a mayores concentraciones y RI y a la interacción con grupos funcionales en el carbón, poniéndose de manifiesto una combinación de adsorción física y adsorción química.
Gasolina
La tabla 5 muestra los resultados de la adsorción de vapores de gasolina en CA.
En el análisis de esta respuesta se comprobó que la concentración de la disolución ácida y la interacción temperatura de activación-relación de impregnación, son términos significativos del modelo, teniendo una influencia significativa en la adsorción.
En este caso los mejores resultados se observan en los carbones obtenidos a 400 ºC, con valor medio de la concentración de la disolución de 25 % y RI de 3,22; mientras que a 500 ºC, el mejor valor de adsorción fue con la máxima concentración de la disolución ácida utilizada.
La adsorción de vapores de gasolina es muy semejante tanto en el carbón obtenido a 400 ºC como en el que se obtuvo a 500 ºC, sólo notándose diferencias al analizar la interacción determinada por el análisis de varianza. No se alcanzan elevados valores de adsorción ni al más alto valor de concentración de la disolución ácida, lo que puede estar relacionado con el tamaño de estas moléculas y el bajo desarrollo de la estructura porosa del carbón.
En todos los casos la capacidad de adsorción se vio favorecida con el incremento de la temperatura de activación y de la RI [23].
CONCLUSIONES
Se observaron elevados valores de adsorción de amoniaco, lo cual puede estar dado por la presencia de grupos funcionales de carácter ácido unidos a átomos de oxígeno a través de enlaces por puente de hidrógeno (H-O) o formando grupos carbonilos (C=O) en la superficie activa de los carbones, lo que se corrobora con el poco desarrollo de la superficie porosa demostrado por el número de yodo.
El modelo estadístico utilizado demostró que la temperatura de activación, la concentración de la disolución ácida y la interacción temperatura de activación-relación de impregnación, son términos significativos del modelo, teniendo una influencia significativa en la adsorción. Fue comprobado que estos carbones también presentan capacidad para adsorber moléculas tan importantes en términos energéticos y medioambientales como son la gasolina y el benceno, relacionado esto con un mayor desarrollo de microporos anchos. Hay que considerar que la gasolina es una mezcla de sustancias química de moléculas grandes, por lo que un ulterior estudio se centraría en elevar la calidad del carbón obtenido con tales fines.
REFERENCIAS
1. Le Leuch, L. M. y Bandosz, T. J. "The role of water and surface acidity on the reactive adsorption of ammonia on modified activated carbons". Carbon. 2007. vol. 45, p. 568-578. ISSN 0008-6223. DOI 10.1016/j.carbon.2006.10.016.
2. Canals Batlle, C., Ros, A., Lillo Ródenas, M. A. et al. "Carbonaceous adsorbents for NH3 removal at room temperature". Carbon. 2008. vol. 46, p. 176-178. ISSN 0008-6223. DOI 10.1016/j.carbon.2007.10.017.
3. Soo Jin, P. y Ki Dong, K. "Adsorption Behaviors of CO2 and NH3 on Chemically Surface-Treated Activated Carbons". Journal of Colloid and Interface Science. 1999. vol. 212, p.186-189. ISSN 1095-7103.
4. Smisek, M. y Cerny, S. Active Carbon, New York: Elsevier Publishing Co. 1970. p.10-19. Library of congress card number 68-20652, standard book number 444-407773-1.
5. Rodríguez Reinoso, F. "Preparation and characterization of activated carbons". En: Carbon and Coal Gasification. Sience and Technology, Serie E: Applied Sciences. 1ra ed. UK. 1986, p. 601-609. ISSN 0218-2025.
6. Márquez Montesino, F., Cordero, T., Rodríguez-Mirasol, J. et al. "CO2 and steam gasification of a grapefruit skin char". Fuel. 2002. vol. 81, p.423-429. ISSN 0016-2361. PII S0016-2361(01)00174-0.
7. Espinal, J. F., Truong, T. N. y Mondragón, F. "Mechanisms of NH3 formation during the reaction of H2 with nitrogen containing carbonaceous materials". Carbon. 2007. vol. 45, p.2273-2279. ISSN 0008-6223. DOI 10.1016/j.carbon.2007.06.011.
8. Vilaplana Ortego, E., Lillo Ródenas, M. A., Alcañz-Monge, J. et al. "Isotropic petroleum pitch as a carbon precursor for the preparation of activated carbons by KOH activation". Carbon. 2009. vol. 47, p. 2112-2143. ISSN 0008-6223. DOI 10.1016/j.carbon.2009.04.020.
9. Ríos, R. B., Silva, Wilton M., Torres Eurico, B. et al. "Adsorption of methane in activated carbons obtained from coconut shells using H3PO4 chemical activation". Adsorption. 2009, vol. 15, p. 271-277. ISSN 0011-9164. DOI 10.1007/s10450-009-9174-9.
10. Nieto Delgado, C., Terrones, M. y Rangel Méndez, J. R. "Development of highly microporous activated carbon from the alcoholic beverage industry organic by-products". Biomass and Bioenergy. 2011. vol. 35, p. 103-112. ISSN 0961-9534. DOI 10.1016/j.biombioe.2010.08.025.
11. Saha, D. y Deng, S. "Adsorption equilibrium and kinetics of CO2, CH4, N2O, and NH3 on ordered mesoporous carbon". Journal of Colloid and Interface Science. 2010. vol. 345, p. 402-409. ISSN 0021-9797. DOI 10.1016/j.jcis.2010.01.076.
12. Molina Sabio, M., González, J. C. y Rodríguez Reinoso, F. "Adsorption of NH3 and H2S on activated carbón and activated-carbon-sepiolite pellets". Carbon. 2004. vol. 42, p. 423-460. ISSN 0008-6223. DOI 10.1016/j.carbon.2003.11.009.
13. Guo J., Sheng Xu, W., Lin Chena, Y. et al. "Adsorption of NH3 on to activated carbon prepared from palm shells impregnated with H2SO4". Journal of Colloid and Interface Science. 2005. vol. 281, p.285-290. ISSN 0021-9797, ISSN 1095-7103. DOI 10.1016/j.jcis.2004.08.101.
14. Stoeckli, F., Guillot, A. y Slasli, A. M. "Specific and non-specific interactions between ammonia and activated carbons". Carbon. 2004. vol. 42, p. 1619-1624. ISSN 0008-6223. DOI 10.1016/j.carbon.2004.02.034.
15. American Society for the Testing and Material. Test Method for Ash in Wood. International ASTM D1102-84. Segunda edición, Pensilvania, USA: Editorial:(C) ASTM International, 2007.
16. American Society for the Testing and Material. Standard Guide for Moisture Conditioning of Wood-Based Materials. International ASTM D4933-99. Segunda edición, Pensilvania, USA: Editorial:(C) ASTM International, 2004
17. American Society for the Testing and Material. Test Methods for Volatile Matter in the Analysis Sample of Coal and Coke. International ASTM 3175-07. Segunda edición, Pensilvania, USA: Editorial:(C) ASTM International, 2007
18. Márquez, F., Ocampo, G. y Brown, A. Carbón activado de aserrín que se reactiva con ácido fosfórico. Certificado de Invención otorgado por la Oficina Cubana de la Propiedad Industrial. OPCI. No 22 383, Certificado de Autor de Invención, 25 de abril de 1995.
19. Romero-Anaya, A. J., Molina, A., García, P. et al. "Phosphoric acid activation of recalcitrant biomass originated in ethanol production from banana plants". Biomass and Bioenergy. 2011. vol. 35, p. 1196-1204. ISSN 0961-9534. DOI 10.1016/j.biombioe.2010.12.007.
20. Suárez García, F., Martínez Alonso, A., Tascón, J. M. D. "Porous texture of activated carbons prepared by phosphoric acid activation of apple pulp". Carbon. 2001. vol. 39, p. 1111-1115. ISSN 0008-6223. PII: S0008-6223(01)00053-7.
21. Izquierdo, M. T., Martínez de Yuso, A., Rubio, B. et al. "Conversion of almond shell to activated carbons: Methodical study of the chemical activation based on an experimental design and relationship with their characteristics". Biomass and Bioenergy. 2011. vol. 35, p. 1235-1244. ISSN 0961-9534. DOI 10.1016/j.biombioe.2010.12.016
22. American Society for the Testing and Material. Standard Test Method for Determination of Iodine Number of Activated, International ASTM D4607-94. Segunda edición Pensilvania, USA: Editorial:(C) ASTM International, 2006
23. Anas Nahil, M. y Williams, P.T. "Pore characteristics of activated carbons from the phosphoric acid chemical activation of cotton stalks". Biomass and Bioenergy. 2012. vol. 37, p. 142-149. ISSN 0961-9534. DOI 10.1016/j.biombioe.2011.12.019.
Recibido: 24 de septiembre de 2012.
Aceptado: 4 de diciembre de 2012.
Francisco Márquez-Montesino. Universidad de Pinar del Río, Facultad de Ciencias Técnicas, Pinar del Río. Cuba.
Correo electrónico: fmarquez@af.upr.edu.cu