INTRODUCCIÓN
La caña de azúcar se cultiva en varias regiones del mundo y ocupa aproximadamente 27.1 millones de hectáreas. De ella se extraen alrededor del 80% del azúcar que se consume a nivel mundial y el 60% del bioetanol (Dahlquist, 2013; FAO, 2014). El cultivo está afectado por factores bióticos y abióticos que reducen su productividad (Chandiposha, 2013).
La roya naranja causada por Puccinia kuehnii (W. Krüger) EJ Butler cobró importancia económica a partir de la epifitia ocurrida en Australia en el año 2000 en el cultivar Q124. Su extensión al hemisferio Occidental fue informada en Florida en el 2007 y seguidamente en Cuba en el 2008, Guatemala, México, El Salvador, Panamá, Costa Rica, Nicaragua, Brazil y Colombia. La enfermedad puede causar pérdidas de hasta el 40% de los rendimientos en cultivares susceptibles (CABI, 2019).
Debido a la reciente importancia que ha cobrado la roya naranja (Zhao et al., 2015), el escaso conocimiento de las bases genéticas de la resistencia y la poca exploración genética del germoplasma con que se cuenta en la actualidad, se convierte en un reto para los mejoradores genéticos la búsqueda de cultivares resistentes a la enfermedad.
Valdés et al. (2016) realizaron la identificación morfológica y molecular de P. kuehnii en plantas de caña de azúcar (Saccharum spp.) en la provincia de Villa Clara, Cuba, la que emplearon para evaluar en casa de cultivo la respuesta de 16 cultivares frente a la roya naranja. A partir de estos resultados, el objetivo del presente trabajo fue caracterizar por histología el desarrollo de P. kuehnii en hojas y la respuesta de los cultivares a la enfermedad.
MATERIALES Y MÉTODOS
Material vegetal
Para la caracterización histológica de la respuesta de los cultivares a la infección por P. kuehnii, se seleccionaron cuatro cultivares de caña de azúcar por su respuesta a la infección, en casa de cultivo, descrita previamente por Valdés et al. (2016). Cultivar IBP 8518 (grado 1, resistente), cultivar C90-469 (grado 2, moderadamente resistente), cultivares CP72-2086, Q124 (grado 4, susceptible), según la escala de Sood et al. (2013).
Se plantaron estacas de una yema en bolsas con capacidad de 1000 g con una mezcla de compost y zeolita como sustrato en una proporción 80:20. El manejo agronómico de las plantas se realizó según las Normas y Procedimientos del Programa de Fitomejoramiento de la Caña de Azúcar en Cuba (Jorge et al., 2011), bajo condiciones de casa de cultivo del IBP.
A los 60 días posteriores a la plantación, se seleccionaron 10 plantas por cultivar y se inocularon con una suspensión de esporas de 4-5x105 uredosporas ml-1 en agua destilada estéril. La metodología empleada fue la descrita por Valdés et al. (2017).
Se cortaron fragmentos de hojas +1 y +2 con lesiones, a los 5 y 15 días posteriores a la inoculación. Se colocaron en tubos Eppendorf con 1.3 ml de la solución de tinción lactofenol-azul tripán-etanol (10 ml, 0.05 g, 10 ml), según Waspi et al. (2001). Los tubos se colocaron en agua a punto de ebullición durante 3 min y luego se mantuvieron en reposo durante una hora.
La decoloración del tejido se realizó con hidrato de cloral (20 g, 8 ml H2O, 25 ml de etanol absoluto). Los fragmentos de tejido se observaron bajo el microscopio óptico Novel, acoplado a una cámara digital (HDCE-50B), en la que se visualizaron las estructuras del hongo, la muerte celular del tejido vegetal, la coloración naranja del tejido por acumulación de compuestos fenólicos y la formación del uridenio en cultivares susceptibles.
RESULTADOS Y DISCUSIÓN
Las observaciones realizadas al microscopio óptico revelaron que las uredosporas de P. kuehnii germinaron sobre la epidermis por el envés de las hojas de los diferentes cultivares de caña de azúcar estudiados, con independencia del tipo de respuesta a la infección. Dichas uredosporas desarrollaron un tubo germinativo que creció con orientación perpendicular al eje longitudinal de la hoja (Figura 1 a). Este proceso de crecimiento continuó hasta que se produjo un reconocimiento de la topografía del estoma, un engrosamiento del tubo germinativo sobre su superficie, diferenciación del apresorio y la penetración al interior de la hoja (Figura 2, Figura 3, Figura 4).

Figura 1. Uredosporas de Puccinia kuehnii con desarrollo del tubo germinativo sobre la epidermis de la hoja de caña de azúcar (5 dpi). 100x.
Estos resultados concuerdan con la descripción de las estructuras de P. kuehnii realizada por Pérez et al. (2013), y las de otras especies del género, como Puccinia melanocephala H. & Syd en caña de azúcar (Sotomayor et al., 1983); Oloriz et al., 2008) y Puccinia graminis f. sp. tritici en el proceso de infección de Triticum aestivum L. (Leonard et al., 2005).
A través de los estudios histológicos se identificaron, además, diferencias en la respuesta de los cultivares a la infección por P. kuehnii. El cultivar IBP8518 (grado 1, resistente), mostró acumulación de compuestos fenólicos con coloración naranja oscuro-marrón (código hex: # 8A4308) en pocas células próximas al sitio de penetración del hongo sin posterior desarrollo del urinedio, similar a una respuesta hipersensible (Figura 2).

Figura 2. Tejido foliar de caña de azúcar cultivar IBP8518 con acumulación de compuestos fenólicos, en un escaso número de células, como respuesta a la infección por Puccinia kuehnii a los 15 dpi. Uredospora (u), tubo germinativo (tg), apresorio (a) estoma (e). 400x.
Por otra parte, el cultivar C90-469 (grado 2, moderadamente resistente), mostró acumulación de compuestos fenólicos en el sitio de penetración, coloración naranja (código hex: # FE9A2E), menos intenso que el cultivar IBP8518 e involucraron un mayor números de células (Figura 3).

Figura 3 Infección de Puccinia kuehnii sobre hoja de caña de azúcar cultivar C90-469 (grado 2, moderadamente resistente) y tejido próximo al sitio de infección con acumulación de compuestos fenólicos a los 15 dpi. Uredospora (u) con desarrollo del tubo germinativo (tg), estoma (e), apresorio (a). 400x.
En el caso de los cultivares susceptibles se observó el desarrollo de las estructuras del hongo que comprometió las células infestadas de la planta en el establecimiento del futuro uridenio (Figuras 4 y Figura 5). En la respuesta de estos cultivares a la infección con P. kuehnii se apreció tejido necrosado teñido de azul, que lo diferenció de los grados 1 y 2 de resistencia, en los que se mantuvo la integridad del tejido y se produjo solamente la acumulación de compuestos fenólicos en la zona próxima al sitio de la penetración.

Figura 4 Respuesta de caña de azúcar cultivar CP72-2086 (susceptible) a la infección por Puccinia kuehnii a los 15 dpi. Tejido foliar necrosado junto a las estructuras del hongo. u) uredospora, tg) tubo germinativo a) apresorio e) estoma. 400x.
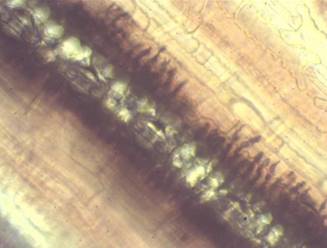
Figura 5 Uridenio de Puccinia kuehnii sobre tejido foliar de caña de azúcar cultivar Q124 infectado. 15 dpi. 400x.
Las observaciones realizadas al microscopio óptico, permitieron demostrar que para los cultivares estudiados con diferentes grados de resistencia a P. kuehnii, la germinación de la uredospora, el crecimiento del tubo germinativo sobre la epidermis de la hoja y la penetración del hongo por los estomas ocurre de modo similar. Esto evidenció que las respuestas diferenciales encontradas entre cultivares son consecuencia de las interacciones entre P. kuehnii y caña de azúcar, posteriores a la penetración del hongo en el tejido foliar.
Los estudios histopatológicos complementaron la caracterización realizada a partir del fenotipo de la respuesta de cada cultivar (Valdés et al., 2016). En este estudio se corroboró la presencia de una respuesta similar a la hipersensible en el cultivar IBP8518 con grado 1 de resistencia a la roya naranja, que hace suponer la existencia de un gen de resistencia (R) que reconoce un gen de avirulencia (avr) de P. kuehnii durante la interacción. Similares resultados fueron observados en este cultivar durante la interacción con la roya parda causada por P. melanocephala (Oloriz et al., 2012a), esto lo convierte en un material de gran valor genético para los programas de mejoramiento, al brindar una fuente de resistencia a dos hongos fitopatógenos de la caña de azúcar, derivada de un evento de inducción de mutaciones (Oloriz et al., 2012b).
Para el cultivar con grado 2 (C90-469), moderadamente resistente, resulta más difícil diferenciar si se trata de una respuesta hipersensible o no. En este caso deben realizarse estudios histoquímicos que permitan comprobar la producción de especies reactivas de oxígeno en el sitio de penetración del hongo, entre otros. No obstante, la observación de un área más extensa de coloración naranja en estos cultivares, podría entenderse como el resultado de la contribución cuantitativa de varios genes a la resistencia. En este sentido, Yang et al. (2018)encontraron tres QTLs (del inglés: Quantitative Trait Loci) que controlan la resistencia a la roya naranja en caña de azúcar (qORR109, qORR4 y qORR102), los cuales pueden explicar por separado el 58, 12 y 8% de las variaciones en el fenotipo en la población en estudio.
Estos resultados son un complemento a los estudios de caracterización de cultivares frente a la infección por P. kuehnii, al brindarse detalles de la respuesta de defensa de la planta, que contribuyen al conocimiento sobre los posibles mecanismos de resistencia a la roya naranja en el cultivo. Pueden ser aplicados a otros cultivares de interés y en futuros estudios de interacción caña de azúcar-P. kuehnii.
CONCLUSIONES
El desarrollo de P. kuehnii en hojas de caña de azúcar se caracteriza por la germinación de las uredosporas, el crecimiento del tubo germinativo sobre la epidermis de la hoja y la penetración del hongo por los estomas, independientemente de la respuesta del cultivar. Además, las respuestas diferenciales entre cultivares se manifiestan después de la penetración del hongo, mediante la acumulación de compuestos fenólicos en las células y el desarrollo o no del urinedio.














