INTRODUCCIÓN
El quilomediastino, descrito por primera vez en 1971 por Thomas y McGoon2, es una rara causa de derrame pericárdico1. La fuga incontrolada de quilo puede causar hipoproteinemia, desnutrición, inmunodeficiencia, infecciones y complicaciones cardíacas potencialmente mortales, como la pericarditis constrictiva o el taponamiento cardíaco1,2. Además de la cirugía torácica y de cardiopatías congénitas, se ha observado después de operaciones de reemplazo de válvulas cardíacas y tras la revascularización miocárdica quirúrgica3. Sumado a la apariencia macroscópica, los estudios bioquímicos e histológicos pueden diagnosticarlo fácilmente. En este artículo se presenta el caso de un paciente tratado exitosamente con tratamiento conservador.
CASO CLÍNICO
Hombre de 61 años de edad que ingresó en nuestro hospital con disnea y dolor en el pecho de 1 año de evolución. El hemograma, hemoquímica y los análisis de orina mostraron resultados normales. No se econtraron datos positivos al examen físico, excepto hipertensión arterial. El electrocardiograma mostró ritmo sinusal y alteraciones de la onda T; y el ecocardiograma, una fracción de eyección de 55%, con función valvular normal.
La coronariografía demostró una enfermedad multivaso y se decidió realizar revascularización miocárdica quirúrgica. Después de la esternotomía no se extirpó el timo, pero se dividió su istmo en la línea media mediante electrocauterización, como es habitual en todos los pacientes. Antes de iniciar la circulación extracorpórea (CEC), se administró heparina sódica a una dosis inicial de 300 UI/kg. Para la CEC se utilizó canulación de aorta ascendente y canulación venosa de dos etapas en la aurícula derecha. Para realizar el pinzamiento cruzado aórtico (cross-clamping), el sitio para la pinza se creó mediante disección entre la aorta ascendente y la arteria pulmonar. La protección miocárdica se logró con cardioplegia hemática intermitente anterógrada y retrógrada (Custodiol®, Alsbach-Hahnlein, Alemania). La presión arterial media se mantuvo entre 50 y 70 mmHg, y la temperatura sistémica, entre 30 y 34 °C. Se realizaron 4 puentes, se retiró el pinzamiento aórtico y se realizaron las anastomosis proximales con pinzamiento parcial.
Después que el paciente se desconectó de la CEC y se decanuló, se revirtió completamente la heparina con protamina (Valeant, Eschborn, Alemania) a razón de 1/1,5. No hubo complicaciones intraoperatorias, se colocaron electrodos epicárdicos de marcapasos en la superficie del ventrículo derecho para las manipulaciones de la frecuencia cardíaca y, al final de la operación, se colocaron drenajes en el mediastino y en la cavidad torácica.
El paciente tuvo un sangrado de aproximadamente 1200 ml en las primeras 24 horas en la unidad de cuidados intensivos, que se redujo tras la administración de hemoderivados (concentrado de hematíes y plasma fresco congelado). Aunque no hubo compromiso hemodinámico, al segundo día del postoperatorio la radiografía de tórax (Fig. 1) mostró la presencia de cardiomegalia y hematoma en el hemitórax izquierdo. Además, el ecocardiograma demostró un gran derrame pericárdico, de 1 cm alrededor del ventrículo izquierdo y 2 cm alrededor de la aurícula y el ventrículo derechos. Aunque no existía evidencia de taponamiento cardíaco, se decidió revisar al paciente para controlar el sangrado y evacuar el hematoma. Se retiró la sutura esternal y se abrió nuevamente el área mediastínica y la pleura izquierda, donde se encontraron y evacuaron coágulos bien organizados. Además, había coágulos de sangre acumulados en la parte posterior del corazón y alrededor de la vena cava superior y el tronco venoso innominado. Se encontró y reparó una fuga en la anastomosis proximal del injerto de safena y la operación se completó con lavado del área mediastínica y la colocación de un nuevo drenaje; por donde no se detectó sangrado significativo posterior.
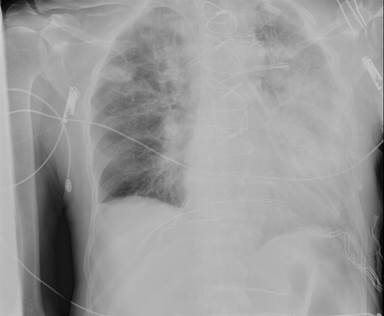
Fig. 1 Telecardiograma que muestra el ensanchamiento mediastínico con hematoma en el hemitórax izquierdo debido al sangrado después de una revascularización miocárdica quirúrgica.
El color del líquido en los drenajes se volvió seroso y se inició dieta líquida oral al tercer día. Al día siguiente se añadieron alimentos sólidos, y al final del quinto día el líquido seroso del drenaje mediastínico comenzó a aumentar. Ese mismo día el aspecto del líquido se hizo blanco-lechoso (Fig. 2), y al sexto día del postoperatorio se obtuvo un drenaje de 1600 ml de color blanco-amarillento. Se tomaron muestras del líquido del drenaje mediastínico para exámenes bioquímicos y microbiológicos. El nivel de triglicéridos fue de 1825 mg/dL, 6,5 mg/dL de proteínas totales y 211 mg/dL de colesterol. No se observó crecimiento de microorganismos o presencia de polimorfo nucleares, por lo que se demostró que el fluido era linfático.

Fig. 2: Drenaje quiloso después del inicio de la alimentación oral, posterior a la revisión quirúrgica por sangrado.
Se suspendió la vía oral y se inició la alimentación parenteral total con una dieta baja en grasas y triglicéridos de cadena media. No se pudo administrar somatostatina porque no la teníamos disponible. Después de iniciada la nutrición parenteral, el volumen de líquido por el drenaje mediastínico disminuyó progresivamente de alrededor de 1600 ml/día a 50 ml/día once días después, y cesó al duodécimo día, por lo que el drenaje pudo retirarse el décimotercer día del postoperatorio y no fue necesario tratamiento quirúrgico. La radiografía de tórax y el ecocardiograma realizados posteriormente demostraron la ausencia de líquido mediastínico y el paciente fue dado de alta 17 días después de la primera intervención. El ecocardiograma de 2 semanas después del egreso no mostró líquido en el espacio mediastínico, y tres meses después de la cirugía el paciente no tenía signos de derrame y permanecía asintomático.
COMENTARIOS
La acumulación mediastínica de quilo (quilomediastino), que puede ocurrir después de una cirugía cardíaca, se observa en 0,2 - 0,5% de los pacientes y puede ser catastrófica si no se trata4. Aunque la causa no se conozca exactamente, puede ser congénita o adquirida. Además del linfoma mediastínico, los traumatismos, la trombosis valvular y las operaciones cardíacas, la mayoría de los casos se han asociado con cirugía por cardiopatías congénita5.
La etiología del quilomediastino postoperatorio es aún incierta. La patogenia principal es la presencia de obstrucciones relacionadas con el conducto torácico y sus ramas. La causa más común es la lesión de los pequeños canales linfáticos cardíacos y pericárdicos durante el procedimiento quirúrgico6. El quilo es el contenido normal de los vasos linfáticos intestinales y el conducto torácico, este último se origina como la cisterna del quilo, debajo del diafragma en la región de las vértebras lumbares, que asciende en el hemitórax derecho entre la aorta y la vena ácigos, cruza hacia la izquierda, pasa por detrás del arco aórtico y drena en la unión de las venas yugular y subclavia izquierdas. Varios afluentes de líquido linfático del tejido tímico, pericárdico y de los ganglios linfáticos pretraqueales drenan en el conducto torácico6,7. También hay canales linfáticos bronquomediastinales derechos e izquierdos que se abren por separado en las vénulas braquiocefálicas de ambos lados.
Los canales linfáticos y el conducto torácico pueden dañarse como consecuencia de la retracción extrema de la pared torácica, y también pueden ocurrir fugas de linfa secundarias a lesiones de los conductos linfáticos inferiores, durante la canulación de la vena cava inferior. Estas lesiones pueden producirse también como complicación de los procedimientos exploratorios que se realizan para preparar el campo quirúrgico o durante el pinzamiento aórtico (cross-clamping). El timo, el pericardio y la glándula tiroides corresponden al sistema linfático braquiocefálico, que se encuentra en esta región; especialmente el timo y los canales linfáticos circundantes pueden dañarse durante la exploración quirúrgica.
En general, la tracción del conducto torácico por la manipulación del corazón y los grandes vasos, la trombosis en la unión de las venas yugular y subclavia izquierdas que obstruye el drenaje de este conducto, y el desarrollo de conexiones entre el saco pericárdico y una fuga linfática pueden contribuir al quilomediastino postoperatorio6,8. La electrocauterización puede ser un método de control poco confiable ya que las delgadas paredes linfáticas contienen poco material coagulable. Este problema puede prevenirse mediante la ligadura quirúrgica de las estructuras vasculares tímicas al momento de la disección, en lugar del uso de la electrocauterización; por lo tanto, los lóbulos del timo deben separarse mediante disección roma y ligarse con suturas resistentes9.
El drenaje de quilo puede ocurrir de forma precoz o más tardíamente después de la cirugía cardíaca. El quilomediastino precoz se caracteriza por un drenaje seroso progresivo que, después de comenzar la alimentación oral, se convierte en un líquido blanco lechoso. En el inicio tardío del quilopericardio aparecen ensanchamiento de la silueta cardíaca, ingurgitación en las venas del cuello, hepatomegalia y taponamiento cardíaco. Esta emergencia puede ocurrir desde el primer día del postoperatorio hasta el período posterior al egreso. En nuestro caso, después de comenzar la alimentación oral aumentó el drenaje seroso y luego aparecieron las características quilosas del líquido. En este paciente el mediastino se abrió dos veces, debido a la reintervención por sangrado; por lo que además del trauma quirúrgico inicial, el control de la hemorragia y la eliminación de los coágulos pudieron haber dañado las estructuras linfáticas y sus pequeños canales de alrededor del timo, la vena innominada y la vena cava.
Independientemente de las características macroscópicas de un líquido inodoro y blanco-lechoso, las pruebas bioquímicas y microbiológicas también juegan un papel importante en el diagnóstico. En la muestra de líquido pericárdico el líquido lechoso debe tener un nivel de colesterol total mayor de 110 mg/dL y de triglicéridos mayor de 500 mg/dL. Aunque los valores de colesterol total en nuestro paciente no fueron muy elevados, el nivel de triglicéridos y la apariencia del líquido se correspondieron con el quilopericardio. El cultivo negativo del fluido y el predominio de linfocitos apoyaron el diagnóstico5,9.
Además, la presencia de glóbulos de grasa en la muestra del líquido drenado, demostrados por la tinción de Sudán III, también ayuda al diagnóstico de líquido quiloso9. En casos de inicio tardío del quilomediastino, el cuadro clínico, los hallazgos del telecardiograma y los datos ecocardiográficos que muestran derrame pericárdico, no son suficientes para el diagnóstico, por lo que se deben tomar muestras del líquido por pericardiocentesis para establecer el diagnóstico diferencial. Como en nuestro paciente el quilomediastino ocurrió en el postoperatorio temprano, el aspecto macroscópico del líquido facilitó el diagnóstico, con el apoyo de los estudios bioquímico y microbiológico.
Existen algunos desacuerdos respecto al tratamiento del quilomediastino postoperatorio. Su tratamiento inicial es generalmente conservador y consiste en pericardiocentesis, manipulación dietética e infusión de somatostatina6. Aunque muchos cirujanos han sugerido la ligadura del conducto torácico como primera prioridad, el tratamiento conservador con alimentación parenteral baja en grasa y con el uso de triglicéridos de cadena media, además del drenaje, también ha demostrado ser efectivo10,11.
En pacientes que no responden al tratamiento conservador, la ligadura y resección del conducto torácico justo por encima del diafragma han demostrado ser el tratamiento más efectivo12-14. En nuestro caso se suspendió la alimentación oral a partir de la detección de drenaje quiloso, se pasó a nutrición parenteral total (baja en grasa y con triglicéridos de cadena media), y se le administró una infusión de albúmina para prevenir la pérdida de proteínas. El día 12 del postoperatorio, después de que cesara el drenaje, se reinició la alimentación oral, y el día 13 fue retirado el drenaje. El telecardiograma no mostró ensanchamiento de la silueta cardíaca, ni se encontró derrame en el ecocardiograma.
CONCLUSIONES
Presentamos un caso infrecuente de quilomediastino en un paciente operado de revascularización miocárdica quirúrgica con esternotomía media. Una vez que el paciente está preparado para la cirugía, después de la esterotomía, se deben proteger los tejidos mediastínicos tanto como sea posible para evitar dañar la estructura linfática y sus canales. Si se detecta salida de linfa/quilo se debe suspender la alimentación oral e iniciar la reposición electrolítica intravenosa y la nutrición parenteral, con una dieta baja en grasas y alta en triglicéridos de cadena media, que pueden ayudar a resolver el derrame. Si persiste el derrame quiloso, es necesario el tratamiento quirúrgico para lograr la curación.














