My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cuban Journal of Agricultural Science
Print version ISSN 0864-0408On-line version ISSN 2079-3480
Cuban J. Agric. Sci. vol.51 no.2 Mayabeque Apr.-June 2017
ARTÍCULO ORIGINAL
Respuesta de Cenchrus ciliaris L. (Buffel cv. Formidable), inoculado con Bradyrhizobium sp. y Trichoderma harzianum, bajo estrés de sequía
Response of Cenchrus ciliaris L. (Buffel cv. Formidable), innoculated with Bradyrhizobium sp. and Trichoderma harzianum, under drought stress
C. J. Bécquer1, U. Ávila1, Adelaida Puentes2, J. A. Nápoles1, T. Cancio1, F. Medinilla3, Ivón Muir1 and Yahima Madrigal1
1Instituto de Investigaciones de Pastos y Forrajes, Estación Experimental Sancti Spíritus, Apdo. 2255, ZP. 1, C. P. 62200, Sancti Spíritus, Cuba
2Universidad “José Martí Pérez”, Avenida de los Mártires 360 esq. Carretera Central, Sancti Spíritus, Cuba
3Centro Meteorológico Provincial de Sancti Spíritus. Comandante Fajardo final s/n Olivos I Sancti Spíritus, Cuba
RESUMEN
Se llevó a cabo un experimento de campo bajo estrés de sequía agrícola para evaluar la respuesta de Cenchrus ciliaris L. a la inoculación con Bradyrhizobium sp. y Trichoderma harzianum. Se aplicó un diseño experimental de bloques al azar, con siete tratamientos (Trichoderma en el corte de establecimiento + Bradyrhizobium sp. a los 15 d; Bradyrhizobium sp. en el corte de establecimiento + Trichoderma a los 15 d; Bradyrhizobium sp. + Trichoderma en el corte de establecimiento; Trichoderma en el corte de establecimiento; Bradyrhizobium sp en el corte de establecimiento; control absoluto y testigo fertilizado, con ocho repeticiones por tratamiento. Se realizó análisis de ANOVA. Las diferencias entre medias se determinaron según LSD de Fisher. Se evaluó el peso seco de la parte aérea, el índice de eficiencia de la inoculación sobre la base del peso seco de la parte aérea, la longitud del tallo, la longitud de la espiga, el peso seco de la espiga y el índice de eficiencia de la inoculación sobre la base del peso seco de la espiga. Se concluye que los tratamientos con resultados superiores en las variables estudiadas fueron: Trich.+ Ho13. 15 d., especialmente en el índice de eficiencia de la inoculación sobre la base del peso seco de la parte aérea (108.5 %) y del peso seco de la espiga (131.3 %); Ho13+Trich.15d., en el índice de eficiencia de la inoculación sobre la base del peso seco de la espiga (112.4%) y Trichoderma, con 122.2% en el índice de eficiencia de la inoculación sobre la base del peso seco de la espiga. Las variables que más se favorecieron con los tratamientos inoculados fueron el peso seco de la parte aérea y el peso seco de la espiga. El tratamiento en el que se combinaron los dos microorganismos en el mismo espacio de tiempo no ejerció efecto favorable en la planta, lo que sugiere un posible antagonismo entre ambos. Se recomienda aplicar el tratamiento Trich.+Ho13.15 d. en la práctica agrícola en condiciones ambientales similares a las de este experimento.
Palabras clave: Bradyrhizobium, Trichoderma, sequía agrícola, Cenchrus ciliaris L.
ABSTRACT
A field experiment under agricultural drought stress was carried out to evaluate the response of Cenchrus ciliaris L. to the inoculation of Bradyrhizobium sp. and Trichoderma harzianum. A random block design was applied, with seven treatments (Trichoderma in the establishment cut + Bradyrhizobium sp. at 15 d; Bradyrhizobium sp. in the establishment cut + Trichoderma at 15 d; Bradyrhizobium sp. + Trichoderma in the establishment cut; Trichoderma in the establishment cut; Bradyrhizobium sp. in the establishment cut; absolute control and fertilized control), with eight repetitions per treatment. ANOVA analysis was performed and differences between means were determined according to LSD of Fisher. Dry weight of the aerial part was evaluated, as well as the inoculation efficiency index based on the dry weight of the aerial part, stem length, ear length, dry weight of the ear and inoculation efficiency index based on dry weight of the ear. It is concluded that treatments with superior results in the variables studied were: Trich. + Ho13. 15 d., especially in the inoculation efficiency index based on dry weight of the aerial part (108.5 %) and dry weight of the ear (131.3 %); Ho13 + Trich.15d., in the inoculation efficiency index based on dry weight of the ear (112.4 %) and Trichoderma, with 122.2 % in the inoculation efficiency index based on dry weight of the ear. The treatment in which the two microorganisms were combined in the same period did not have a favorable effect on the plant, which suggests a possible antagonism between both. It is recommended to apply the treatment Trich. + Ho13.15 d. in agricultural practice under environmental conditions similar to those of this experi-ment.
Key words: Bradyrhizobium, Trichoderma, agricultural drought, Cenchrus ciliaris L.
INTRODUCCIÓN
Cenchrus ciliaris Linn (Buffel) se considera una especie forrajera importante para los trópicos (Hutton 1978). Esta gramínea pratense se cultiva de forma extensiva en ecosistemas áridos y semiáridos en varios países y se utiliza para estabilizar suelos e incrementar la productividad de praderas que han expermentado el efecto de la sequía combinado con el sobrepastoreo (Lyons et al. 2013). Christie (1978) afirma que Buffel es más resistente a la transferencia de vapor, con buena humedad como con sequía, en comparación con Thyridolepis mitchelliana y Monachather paradoxa.
Según Machado et al. (2013), para mejorar la producción de biomasa forrajera de los pastos cultivados, además de la selección de rizobios efectivos en la fijación de nitrógeno, es también necesaria la selección de rizobios, capaces de promover el crecimiento de las gramíneas forrajeras. Las interacciones entre plantas y las llamadas rizobacterias promotoras del crecimiento en plantas (PGPR) en la rizosfera pueden mejorar los rendimientos de los cultivos, ya que las rizobacterias estimulan directamente el crecimiento de plantas mediante la producción de fitohormonas y el aumento de la absorción de nutrientes, microelementos y sustancias nutritivas como K, P y N atmosférico (Hoitink et al. 2006). Otros microorganismos como Trichoderma son capaces, no solo de controlar la microbiota patógena, sino de actuar como fuente de sustancias promotoras del crecimiento vegetal (Bécquer et al. 2013).
Las rizobacterias también pueden contribuir a que las plantas toleren mejor los efectos de la sequía. Los rizobios ocupan un lugar importante en la inducción de tolerancia a estrés en las plantas (Uchiumi et al. 2004 y Stiens et al. 2006). Estudios recientes indican la actividad promotora del crecimiento vegetal de Trichoderma spp. en las plantas (Saber et al. 2009 y Shaban y El-Bramawy 2011). Existen estudios del efecto positivo de T. harzianum en triticale, al combinarse con rizobios en condiciones de sequía agrícola en Sancti Spíritus, Cuba (Bécquer et al. 2016b).
El objetivo de esta investigación fue evaluar la respuesta de Cenchrus ciliaris L. a la inoculación de Bradyrhizobium sp. y Trichoderma harzianum en condiciones de sequía agrícola y seleccionar las mejores combinaciones microbianas para su aplicación práctica.
MATERIALES Y MÉTODOS
Localización del experimento. El experimento se realizó de enero a abril de 2016 en una parcela experimental de la Estación Experimental de Pastos y Forrajes Sancti Spíritus, situada a 21º 53´ 00´´ de latitud Norte y los 79º 21´ 25´´ de longitud Oeste, a una altura de 40 msnm.
Microorganismos. Se utilizó el aislado Ho13, perteneciente al género Bradyrhizobium sp. (Bécquer et al. 2016a) microsimbionte de Centrosema virginianum, leguminosa procedente de un ecosistema ganadero árido de Holguín, Cuba.
Cepa de Trichoderma. Se empleó el producto TRICHOSAVE 34 (LABIOFAM S.A.), compuesto por un sustrato de cáscara y cabecilla de arroz, inoculado con micelios esporulados de Trichoderma harzianum A-34.
Preparación del inóculo con Bradyrhizobium. El aislado creció en medio sólido levadura-manitol (Vincent 1970) y se resuspendió en medio líquido hasta lograr concentración celular de 106–108 UFC/mL. Para la inoculación de las plantas, se procedió a diluir el inóculo en proporción 1:10 en solución salina 0.9 %.
Preparación del inóculo con Trichoderma. Por recomendación técnica del fabricante, el producto se añadió a agua corriente, a razón de 35 g/L. Se filtró con gasa antes de inocular las plantas (1-2x109 conidios/g). Las suspensiones conidiales se inocularon de acuerdo con el tratamiento utilizado, de forma simple o en combinación con los inóculos bacterianos. El título final de la suspensión (106-108 conidios/mL) se utilizó de acuerdo con Wolffhechel y Jensen (1992).
Material vegetal. El experimento se realizó en una parcela de 10 m x 10 m de Buffel cv. Formidable (Cenchrus ciliaris L.) del banco de germoplasma de la Estación Experimental de Sancti Spíritus, destinada a la producción de semillas. Se efectuó un corte de establecimiento para proceder a la inoculación y no se aplicó riego durante el período experimental. Se cosechó a los tres meses del corte, al madurarse las espigas.
Inoculación de las plantas. La inoculación con Bradyrhizobium se realizó después del corte de establecimiento, con un inóculo con concentración celular de 106–108 UFC/mL. Se utilizó una bureta graduada, cuyo contenido se vertió sobre las macollas recién cortadas. De esta forma, al regular el surtidor cada macolla recibió 100 mL del inóculo líquido (aproximadamente 5 mL/planta). La reinoculación de los tratamientos se efectuó a los 15 d.
La inoculación con Trichoderma se realizó de forma similar al anterior, para lo que se utilizó un inóculo de título 106-108 conidios/mL. La reinoculación de los tratamientos se efectuó a los 15 d.
La inoculación fraccionada se llevó a cabo de acuerdo con el tratamiento, a los 15 d de aplicado el inóculo inicial del microorganismo.
Evaluación de las variables climáticas en el área y período experimental. Los datos de temperatura, precipitaciones, humedad relativa y vientos, así como su análisis, se colectaron en la Estación Meteorológica Sancti Spíritus (CMP 2016).
Determinación del estado de sequía agrícola. El estado de la sequía agrícola se determinó mediante el índice de aridez o índice de sequía agrícola (IE) (Solano y Vázquez 1999), utilizado para comprobar si el experimento se efectuó en condiciones de estrés hídrico:
IE = ETR / ETP
donde:
ETR - Evapotranspiración real estimada, dependiente del estado de humedad del suelo.
ETP - Evapotranspiración potencial estimada, dependiente de las condiciones atmosféricas.
Cuando ETR=ETP, el abastecimiento de agua del suelo es adecuado. Cuando ETR < ETP hay insuficiencia de agua.
Composición agroquímica básica del suelo experimental. El suelo del área experimental correspondió al tipo Pardo mullido carbonatado medianamente erosionable (Hernández et al. 2015). El contenido de macronutrientes fue bajo en fósforo y potasio (2.63 mg/100 g de P2O5 y 6.0 mg/100 g de K2O), así como 1.51 % de materia orgánica y pH de 5.9.
Tratamientos, diseño experimental y análisis estadístico. Se aplicó diseño experimental de bloques al azar, con siete tratamientos y ocho repeticiones (tabla 1), para lo que se consideró cada macolla de la gramínea como repetición por tratamiento. Se realizó análisis de ANOVA, aplicado a experimentos de inoculación (Caraux 1993). Las diferencias entre medias se determinaron por la prueba LSD (Least Significant Difference) de Fisher (Fisher 1935). Se utilizó el programa estadístico StatGraphics Centurion XV (Stat Point Technologies 2010).
Variables. Se evaluaron solo una vez en cada repetición en el momento de cosecha de las espigas maduras (3 meses).
El peso seco de la parte aérea (PSPA, g/m2) se determinó al cortar las macollas en la base del tallo. Estas se secaron en una estufa (MEMMERT) a 60 ºC durante 72 h. Posteriormente, se pesaron en una balanza técnica digital (OHAUS).
La longitud del tallo (LT, cm) se midió con una cinta métrica de 1 m, desde la base del tallo hasta la inserción.
La longitud de la espiga (LE, cm) se midió con una regla graduada de 15 cm, desde la inserción hasta el ápice de la espiga.
El peso seco de la espiga (PSE, mg) se determinó después de secar las muestras en la estufa a 60 ºC durante 72 h. Las muestras se pesaron en una balanza analítica digital (OHAUS).
El índice de eficiencia de la inoculación (IEI, %) se calculó según la fórmula IEI: [(Tratamiento inoculado - Control absoluto)/ Control absoluto] x 100 (Santillana et al. 2012).
RESULTADOS Y DISCUSIÓN
Se demostró el efecto positivo de la inoculación combinada de Bradyrhizobium sp. y Trichoderma harzianum en Buffel, en condiciones de sequía agrícola, en una época del año con características complejas que perjudicaron el buen desarrollo de las plantas. El estado de la sequía agrícola durante enero y marzo en el área de estudio culminó con un IE de Insuficiente. En febrero alcanzó la categoría de insuficiente a crítica (tabla 2). En estas condiciones se infiere que el cultivo se sometió a gran estrés hídrico.
La longitud del tallo (tabla 3) muestra que los tratamientos Trich.+Ho13.15d y Ho13+Trich 15d fueron superiores (p<0.001) al control absoluto y compartieron índices comunes con el testigo fertilizado, con Trich+Ho13.15d y con Ho13. La similitud en los valores de los tratamientos con combinación de microorganismos indica influencia positiva de estos en la variable estudiada.
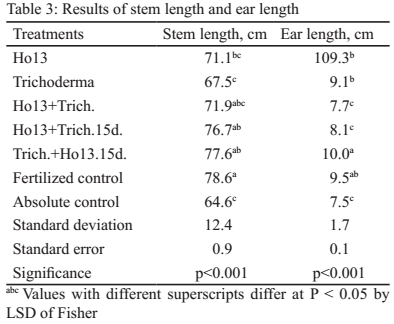
La capacidad de los rizobios de promover el crecimiento de las plantas que no pertenecen a la familia Leguminosae mediante la producción de fitohormonas y de otros mecanismos ha sido demostrada por diversos autores (Chen et al. 2005 y Schlindwein et al. 2008). La síntesis de auxinas por los rizobios, especialmente el ácido indolacético, promueve el desarrollo radical y mejora la absorción de agua y nutrientes del suelo y por tanto, el desarrollo de la planta (Caballero-Mellado et al. 2006).
No obstante, Machado et al. (2013) encontraron que cepas de rizobios, que producen bajos niveles de AIA, estimularon el crecimiento de Panicum maximum y Paspalum saurae. Probablemente, esto se deba a la producción de otras fitohormonas, como citoquininas (Persello-Cartieaux et al. 2003) y giberelinas (Erum y Bano 2008).
Tsavkelova et al. (2006) demostraron que moléculas similares a citoquinina, posiblemente quinetina, se pueden producir por Trichoderma viride, por lo que este hongo también posee propiedades promotoras del crecimiento vegetal. Chirino-Valle et al. (2016) demostraron que la aplicación de especies de Trichoderma puede incrementar la concentración de clorofila, peso seco de la parte aérea y longitud del tallo en la gramínea Miscanthus x giganteus.
Para la longitud de la espiga, el tratamiento Trich.+Ho13.15d mostró valores superiores (p < 0,001) al control absoluto y al resto de los tratamientos, excepto al testigo fertilizado, con el que compartió superíndices comunes (tabla 3). Estos resultados indican la influencia marcada de la combinación fraccionada de estos dos microorganismos sobre la planta.
Muchas rizobacterias contienen la enzima 1-aminociclopropano-1-ácido carboxílico (ACC) diaminasa. Esta enzima escinde el precursor del ACC, el etileno, en α-cetobutirato y amonio. Por tanto, reduce los niveles de etileno en las plantas sometidas a estrés (van Loon 2007), lo que permite que el sistema radical se pueda desarrollar sin la inhibición propia de este compuesto. Esto propicia mayor absorción de nutrientes por la planta.
El aislado de rizobio que se utilizó en este trabajo proviene de ecosistemas áridos de la provincia de Holguín, Cuba (Bécquer et al. 2016a). Según Kaplan et al. (2013), el aislamiento de bacterias promotoras del crecimiento vegetal en ecosistemas estresantes, como los ecosistemas áridos o de desiertos, puede proveer inoculantes que estimulen el desarrollo de los cultivos en ambientes derivados del cambio climático, lo que coincide con las condiciones ambientales estresantes presentes en el experimento. Saba et al. (2012) aseguraron que la colonización de raíces por Trichoderma spp. mejora frecuentemente el crecimiento y desarrollo, la productividad de los cultivos, su resistencia a estrés abiótico, así como la absorción y uso de nutrientes del suelo.
En la tabla 4 se muestra que para el peso seco de la parte aérea los tratamientos inoculados presentaron valores superiores (Trich.+Ho1315d y Ho13+Trich.15 d) (p<0,0001) al control absoluto, pero compartieron superíndices comunes con el testigo fertilizado.
Existen interrelaciones entre microorganismos en los ecosistemas, como sinérgicas, antagónicas, de competencia física y bioquímica. La multifuncionalidad de estos microorganismos en los sistemas agrícolas se expresa de acuerdo con factores bióticos, como la competencia con otros microorganismos, la composición biológica del suelo y el reconocimiento planta-microorganismo, así como los factores edafoclimáticos (Salinas y Soriano 2014). La interacción de las rizobacterias promotoras del crecimiento en plantas, como Bradyrhizobium sp. y hongos del género Trichoderma, depende de este tipo de factores para expresar sus potenciales efectos benéficos. Diversos autores informan acerca del aumento en el crecimiento vegetal como resultado de la asociación de cepas de Trichoderma con plantas, pero el efecto es mayor cuando las plantas se encuentran en condiciones subóptimas o en estrés biótico, abiótico o fisiológico (Bae et al. 2009 y Mastouri y Harman 2009).
Según el CMP (2016), los niveles de humedad detectados en el período experimental debieron implicar incremento de la evapotranspiración de las plantas. Esto hace crecer la demanda de agua y por consiguiente, genera mayor estrés hídrico en los cultivos. Sobre la base de estas afirmaciones, es lógico constatar el efecto benéfico de los tratamientos en los que se combinaron, de manera fraccionada, estos dos microorganismos en las variables analizadas.
Al calcular el IEI en la variable sobre la base del PSPA (tabla 4), se constató la alta eficiencia de los tratamientos Trich.+Ho1315d y Ho13+Trich.15 d. Otros tratamientos inoculados, como Ho13 y Ho13+Trich., a pesar de compartir superíndices comunes en el análisis ANOVA para la variable correspondiente, presentaron IEI negativos o muy bajos.
Es obvio notar que la aplicación combinada en el mismo espacio de tiempo del rizobio con el hongo, no influyó positivamente en los resultados de esta variable y de las demás variables estudiadas. Este resultado pudiera estar vinculado a la posible interacción antagonista entre ambos microorganismos. El ejemplo más conocido de antagonismo entre microorganismos es la producción de antibióticos, al disputarse alguna fuente de nutrientes o ubicación espacial.
En un estudio químico de los metabolitos antibióticos segregados por Trichoderma se demostró que estos se segregan cuando existe una verdadera competencia con otros microorganismos para asegurar su crecimiento y supervivencia en el suelo (Cupull et al. 2003). En este experimento, T. harzianum pudo producir metabolitos antibióticos y evitar el crecimiento y adecuación de Bradyrhizobium sp., y por tanto, su efecto estimulante. Bécquer et al. (2013), en un estudio in vitro, determinaron que una cepa de Sinorhizobium meliloti inhibió el crecimiento de la colonia de T. harzianum.
En febrero, marzo y abril transcurrieron las etapas fenológicas más importantes para el cultivo (desde germinación hasta el llenado de los granos), lo que coincidió con la menor ocurrencia de lluvias. No obstante, el peso seo de la espiga (tabla 4) de los tratamientos inoculados con Ho13+Trichod.15d y Trichoderma mostró superíndices superiores (p<0.0001) al control absoluto y al resto de los tratamientos inoculados, mientras que presentaron superíndices comunes con el testigo fertilizado.
De acuerdo con Saba et al. (2012), la respuesta estable a varios tipos de estrés de plantas inoculadas con Trichoderma, sugiere un mecanismo común mediante el que la asociación planta-hongo mejora la tolerancia a un amplio rango de estrés biótico y abiótico. Según Russo et al. (2012), la promoción del crecimiento y el biocontrol se puede deber al mismo microorganismo que influye positivamente en el desarrollo de la planta mediante diferentes mecanismos, como el incremento de la disponibilidad y la asimilación de minerales, la liberación de factores de crecimiento y la supresión de microorganismos patógenos. Esta afirmación se ajusta a las características de Trichoderma y se evidencia en los resultados que se obtuvieron en este trabajo. Harman et al. (2004) aseguran que la producción de ácidos orgánicos por parte de Trichoderma favorece la solubilización de fosfatos, micronutrientes y cationes minerales, como el hierro, manganeso y magnesio, por lo que la planta los absorbe mejor.
En la tabla 4 se observa que los valores superiores de IEI correspondieron a los tratamientos Trich.+Ho13.15d y Trichoderma. Es evidente la influencia de este hongo en la variable estudiada, así como en otras variables evaluadas en este trabajo.
Las especies del género Trichoderma, según informes de Hoyos-Carvajal et al. (2009), producen metabolitos secundarios diversos que promueven el crecimiento vegetal, incluyendo AIA y análogos de las auxinas. Según Gravel et al. (2007), T. atroviride puede producir y degradar ácido indolacético (AIA), la fitohormona auxínica más común en las plantas, además de poseer actividad de 1-aminociclopropano-1-ácido carboxílico diaminasa, la cual puede controlar la producción de etileno en la planta en estrés hídrico. Lucero et al. (2006) consideran que los hongos que se observan en los complejos estomáticos de gramíneas pratenses pueden desempeñar una función directa en la regulación de la evapotranspiración de las plantas, por lo que no se descarta que la inoculación con Trichoderma influye positivamente en ese sentido, ya que el experimento presentó alta evapotranspiración que debió afectar las plantas (CMP 2016).
Se concluye que los tratamientos con resultados superiores en las variables estudiadas fueron Trich.+Ho13.15 d, Ho13+Trich.15d y Trichoderma, aunque la combinación Trich.+Ho13.15 d se destacó por sus valores superiores en el mayor número de variables. Asimismo, las variables que más se favorecieron con los tratamientos inoculados fueron: peso seco de la parte aérea y peso seco de la espiga. El tratamiento donde se combinan los dos microorganismos en el mismo espacio de tiempo no ejerció efecto favorable para la planta, lo que sugiere que pudiera existir antagonismo entre ambos.
Se recomienda aplicar el tratamiento Trich.+Ho13. 15 d en la práctica agrícola, en condiciones ambientales similares a las del experimento.
REFERENCIAS
Bae, H., Sicher, R. C., Kim, M. S., Kim, S.-H., Strem, M. D., Melnick, R. L. & Bailey, B. A. 2009. “The beneficial endophyte Trichoderma hamatum isolate DIS 219b promotes growth and delays the onset of the drought response in Theobroma cacao”. Journal of Experimental Botany, 60(11): 3279–3295, ISSN: 0022-0957, DOI: 10.1093/jxb/erp165.
Bécquer, C. J., Galdo, Y., Ramos, Y., Peña, M. D., Almaguer, N., Peña, Y. F., Mirabal, A., Quintana, M. & Puentes, A. 2016a. “Rhizobia isolated from forage legumes of an arid cattle rearing ecosystem in Holguín, Cuba. Morpho-cultural evaluation and nodulation (Phase I)”. Cuban Journal of Agricultural Science, 50(4): 607–617, ISSN: 2079-3480.
Bécquer, C. J., Lazarovits, G. & Lalin, I. 2013. “Interacción in vitro entre Trichoderma harzianum y bacterias rizosféricas estimuladoras del crecimiento vegetal”. Cuban Journal of Agricultural Science, 47(1): 97–102, ISSN: 2079-3480.
Bécquer, G. C. J., Puentes, P. A. B., Ávila, C. U., Quintana, S. M., Galdo, R. Y., Medinilla, N. F. & Mirabales, V. A. 2016b. “Efecto de la inoculación con Bradyrhizobium sp. y Trichoderma harzianum en triticale (X. Triticosecale Wittmack), en condiciones de estrés por sequía”. Pastos y Forrajes, 39(1): 19–26, ISSN: 0864-0394.
Caballero-Mellado, J., Tenorio, S. S., Onofre, L. J., Castro, G. R., Estrada, de los S. P., Paredes, V. G., Peña, C. J. J., Díaz, M. R., Martínez, A. L., Bashan, Y., Puente, M. E., Salazar, B., Rivera, B. F., Aguilera, A. S., López, L. K., Hernández, F. J. L. & Álvarez, M. A. 2006. “Microbiología agrícola e interacciones microbianas con plantas”. Revista Latinoamericana de Microbiología, 48(2): 154–161, ISSN: 0034-9771.
Caraux, G. 1993. “Statistical summary on the analysis of the variance”. In: Technical handbook on symbiotic nitrogen fixation: legume/Rhizobium, Rome, Italy: FAO, pp. 1–10, ISBN: 978-92-5-103199-5, Available: <https://books.google.com.cu/books?id=tsl6MCV378kC>, [Consulted: September 5, 2017].
Chen, X.-C., Feng, J., Hou, B.-H., Li, F.-Q., Li, Q. & Hong, G.-F. 2005. “Modulating DNA bending affects NodD-mediated transcriptional control in Rhizobium leguminosarum”. Nucleic Acids Research, 33(8): 2540–2548, ISSN: 0305-1048, DOI: 10.1093/nar/gki537.
Chirino-Valle, I., Kandula, D., Littlejohn, C., Hill, R., Walker, M., Shields, M., Cummings, N., Hettiarachchi, D. & Wratten, S. 2016. “Potential of the beneficial fungus Trichoderma to enhance ecosystem-service provision in the biofuel grass Miscanthus x giganteus in agriculture”. Scientific Reports, 6, ISSN: 2045-2322, DOI: 10.1038/srep25109, Available: <http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4846873/>, [Consulted: September 5, 2017].
Christie, E. K. 1978. “Ecosystem processes in semiarid grasslands. I. Primary production and water use of two communities possessing different photosynthetic pathways”. Australian Journal of Agricultural Research, 29(4): 773–787, ISSN: 1444-9838, DOI: 10.1071/ar9780773.
CMP (Centro Meteorológico Provincial) 2016. Resumen climático y estado de la sequía en la Estación Experimental de Pastos y Forrajes de Sancti Spíritus. Período Enero/2016- Mayo/2016. Sancti Spíritus, Cuba: Instituto de Meteorología (INSMET), 15 p.
Cupull, S. R., Andreu, R. C. M., Pérez, N. C., Delgado, P. Y. & Cupull, S. M. del C. 2003. “Efecto de Trichoderma viride como estimulante de la germinación, en el desarrollo de posturas de cafetos y el control de Rhizoctonia solani Kuhn”. Centro Agrícola, 30(1): 21–25, ISSN: 0253-5785.
Erum, S. & Bano, A. 2008. “Variation in phytohormone production in Rhizobium strains at different altitudes of northern areas of Pakistan”. International Journal of Agriculture and Biology, 10(5): 536–540, ISSN: 1560-8530.
Fisher, R. A. 1935. The design of experiments. call no. OCLC: 2417943, Edinburgh: Oliver and Boyd.
Gravel, V., Antoun, H. & Tweddell, R. J. 2007. “Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation with Pseudomonas putida or Trichoderma atroviride: Possible role of indole acetic acid (IAA)”. Soil Biology and Biochemistry, 39(8): 1968–1977, ISSN: 0038-0717, DOI: 10.1016/j.soilbio.2007.02.015.
Harman, G. E., Howell, C. R., Viterbo, A., Chet, I. & Lorito, M. 2004. “Trichoderma species — opportunistic, avirulent plant symbionts”. Nature Reviews Microbiology, 2(1): 43–56, ISSN: 1740-1526, 1740-1534, DOI: 10.1038/nrmicro797.
Hernández, J. A., Pérez, J. J. M., Bosch, I. D. & Castro, S. N. 2015. Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA, 93 p., ISBN: 978-959-7023-77-7.
Hoitink, H. A. J., Madden, L. V. & Dorrance, A. E. 2006. “Systemic Resistance Induced by Trichoderma spp.: Interactions Between the Host, the Pathogen, the Biocontrol Agent, and Soil Organic Matter Quality”. Phytopathology, 96(2): 186–189, ISSN: 0031-949X, DOI: 10.1094/PHYTO-96-0186.
Hoyos-Carvajal, L., Orduz, S. & Bissett, J. 2009. “Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma”. Biological Control, 51(3): 409–416, ISSN: 1049-9644, DOI: 10.1016/j.biocontrol.2009.07.018.
Hutton, E. M. 1978. “Humid tropics a sleeping giant”. In: Hyder, D. M. (ed.), I International rangeland congress, Denver, Colorado, USA: Society for Range Management, pp. 137–139.
Kaplan, D., Maymon, M., Agapakis, C. M., Lee, A., Wang, A., Prigge, B. A., Volkogon, M. & Hirsch, A. M. 2013. “A survey of the microbial community in the rhizosphere of two dominant shrubs of the Negev Desert highlands, Zygophyllum dumosum (Zygophyllaceae) and Atriplex halimus (Amaranthaceae), using cultivation-dependent and cultivation-independent methods”. American Journal of Botany, 100(9): 1713–1725, ISSN: 0002-9122, 1537-2197, DOI: 10.3732/ajb.1200615.
Lucero, M. E., Barrow, J. R., Osuna, P. & Reyes, I. 2006. “Plant–fungal interactions in arid and semi-arid ecosystems: Large-scale impacts from microscale processes”. Journal of Arid Environments, 65(2): 276–284, ISSN: 0140-1963, DOI: 10.1016/j.jaridenv.2005.08.014.
Lyons, K. G., Maldonado-Leal, B. G. & Owen, G. 2013. “Community and Ecosystem Effects of Buffelgrass (Pennisetum ciliare) and Nitrogen Deposition in the Sonoran Desert”. Invasive Plant Science and Management, 6(1): 65–78, ISSN: 1939-7291, DOI: 10.1614/IPSM-D-11-00071.1.
Machado, R. G., de Sá, E. L. S., Bruxel, M., Giongo, A., Santos, N. da S. & Nunes, A. S. 2013. “Indoleacetic Acid Producing Rhizobia Promote Growth of Tanzania grass (Panicum maximum) and Pensacola grass (Paspalum saurae)”. International Journal of Agriculture & Biology, 15(5): 827‒834, ISSN: 1560–8530, 1814–9596.
Mastouri, F. & Harman, G. E. 2009. “Beneficial microorganism Trichoderma harzianum induces tolerance to multiple environmental and physiological stresses during germination in seeds and seedlings”. In: XIV International Congress on Molecular Plant-Microbe Interactions, Quebec, Canada: Laval University, Available: <http://www.ismpmi.org/Congress/Pages/XIV-International-Congress-on-MPMI.aspx>, [Consulted: September 5, 2017].
Persello-Cartieaux, F., Nussaume, L. & Robaglia, C. 2003. “Tales from the underground: molecular”. Plant, Cell & Environment, 26(2): 189–199, ISSN: 1365-3040, DOI: 10.1046/j.1365-3040.2003.00956.x.
Russo, A., Carrozza, G. P., Vettori, L., Felici, C., Cinelli, F. & Toffanin, A. 2012. “Plant Beneficial Microbes and Their Application in Plant Biotechnology”. In: Agbo, E. C. (ed.), Innovations in Biotechnology, Shanghai, China: InTech, pp. 57–72, ISBN: 978-953-51-0096-6, Available: <http://cdn.intechopen.com/pdfs/28707.pdf>, [Consulted: September 5, 2017].
Saba, H., Vibhash, D., Manisha, M., Prashant, K. S., Farhan, H. & Tauseef, A. 2012. “Trichoderma–a promising plant growth stimulator and biocontrol agent”. Mycosphere, 3(4): 524–531, ISSN: 2077-7019, DOI: 10.5943/mycosphere/3/4/14.
Saber, W. I. A., El-Hai, K. M. A. & Ghoneem, K. M. 2009. “Synergistic effect of Trichoderma and Rhizobium on both biocontrol of chocolate spot disease and induction of nodulation, physiological activities and productivity of Vicia faba”. Research Journal of Microbiology, 4(8): 286–300, ISSN: 1816-4935.
Salinas, V. R. & Soriano, B. B. 2014. “Efecto de Trichoderma viride y Bradyrhizobium yuanmingense en el crecimiento de Capsicum Annuum en condiciones de laboratorio”. Revista REBIOLEST, 2(2): 20–32.
Santillana, N., Zúñiga, D. & Arellano, C. 2012. “Capacidad promotora del crecimiento en cebada (Hordeum vulgare) y potencial antagónico de Rhizobium leguminosarum y Rhizobium etli”. Agrociencia Uruguay, 16(2): 11–17, ISSN: 2301-1548.
Schlindwein, G., Vargas, L. K., Lisboa, B. B., Azambuja, A. C., Granada, C. E., Gabiatti, N. C., Prates, F. & Stumpf, R. 2008. “Influência da inoculação de rizóbios sobre a germinação e o vigor de plântulas de alface”. Ciência Rural, 38(3): 658–664, ISSN: 0103-8478, DOI: 10.1590/S0103-84782008000300010.
Shaban, W. I. & El-Bramawy, M. A. 2011. “Impact of dual inoculation with Rhizobium and Trichoderma on damping off, root rot diseases and plant growth parameters of some legumes field crop under greenhouse conditions”. International Research Journal of Agricultural Science and Soil Science, 1(3): 98–108, ISSN: 2251-0044.
Solano, O. & Vázquez, R. 1999. “Modelo Agrometeorológico de Evaluación de la Sequía Agrícola”. In: Convención Trópico’99. Congreso de Meteorología Tropical, La Habana, Cuba, Referencia MT026.
StatPoint Technologies 2010. Statgraphics Centurion. (ser. Centurion), version XV, [Windows], Available: <http://statgraphics-centurion.software.informer.com/download/> .
Stiens, M., Schneiker, S., Keller, M., Kuhn, S., Pühler, A. & Schlüter, A. 2006. “Sequence Analysis of the 144-Kilobase Accessory Plasmid pSmeSM11a, Isolated from a Dominant Sinorhizobium meliloti Strain Identified during a Long-Term Field Release Experiment”. Applied and Environmental Microbiology, 72(5): 3662–3672, ISSN: 0099-2240, 1098-5336, DOI: 10.1128/AEM.72.5.3662-3672.2006.
Tsavkelova, E. A., Klimova, S. Y., Cherdyntseva, T. A. & Netrusov, A. I. 2006. “Microbial producers of plant growth stimulators and their practical use: A review”. Applied Biochemistry and Microbiology, 42(2): 117–126, ISSN: 0003-6838, 1608-3024, DOI: 10.1134/S0003683806020013.
Uchiumi, T., Ohwada, T., Itakura, M., Mitsui, H., Nukui, N., Dawadi, P., Kaneko, T., Tabata, S., Yokoyama, T., Tejima, K., Saeki, K., Omori, H., Hayashi, M., Maekawa, T., Sriprang, R., Murooka, Y., Tajima, S., Simomura, K., Nomura, M., Suzuki, A., Shimoda, Y., Sioya, K., Abe, M. & Minamisawa, K. 2004. “Expression Islands Clustered on the Symbiosis Island of the Mesorhizobium loti Genome”. Journal of Bacteriology, 186(8): 2439–2448, ISSN: 0021-9193, 1098-5530, DOI: 10.1128/JB.186.8.2439-2448.2004.
van Loon, L. C. 2007. “Plant responses to plant growth-promoting rhizobacteria”. European Journal of Plant Pathology, 119(3): 243–254, ISSN: 0929-1873, 1573-8469, DOI: 10.1007/s10658-007-9165-1.
Vincent, J. M. 1970. A Manual for the Practical Study of Root-nodule Bacteria. (ser. IBP handbook, no. ser. 15), Blackwell Scientific Publ., 164 p., Google-Books-ID: dcQcAQAAIAAJ, Available: <https://books.google.com.cu/books?id=dcQcAQAAIAAJ>, [Consulted: September 5, 2017].
Wolffhechel, H. & Jensen, F. D. 1992. “Use of Trichoderma harzianum and Gliocladium vitens for the Biological Control of Post-emergence Damping-off and Root Rot of Cucumbers Caused by Pythium ultimum”. Journal of Phytopathology, 136(3): 221–230, ISSN: 1439-0434, DOI: 10.1111/j.1439-0434.1992.tb01301.x.
Recibido: 20/6/2017
Aceptado: 12/7/2017
C. J. Bécquer, Instituto de Investigaciones de Pastos y Forrajes, Estación Experimental Sancti Spíritus, Apdo. 2255, ZP. 1, C. P. 62200, Sancti Spíritus, Cuba. Email: pastossp@enet.cu














