My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cuban Journal of Agricultural Science
On-line version ISSN 2079-3480
Cuban J. Agric. Sci. vol.53 no.4 Mayabeque Oct.-Dec. 2019 Epub Dec 05, 2019
CIENCIA ANIMAL
Efecto del cinamaldehído en la degradabilidad ruminal in vitro y la producción de ácidos grasos volátiles.
1Department of Animal Production, University of Murcia, Murcia 30071, Spain
El objetivo de esta investigación fue estudiar el efecto del cinamaldehído en la degradabilidad ruminal de los nutrientes y la producción total y la proporción molar de ácidos grasos volátiles en un sistema ruminal in vitro (DaisyII Ankom Technology,USA). La dieta estaba compuesta por una mezcla de semilla de cebada: heno de alfalfa (70:30) que se incubó con 4 tratamientos: sin control aditivo o negativo (CN), con monensina a 7,5 ppm o control positivo (CP) y con cinamaldehído a 250 (C250) y 500 ppm (C500). El efecto inhibidor de cinnamaldehyde en la desaparición de MS, FDN y FDA (de 48 a 72 h de tiempo de incubación, P <0.01) fue similar al tratamiento con CP. Todos los tratamientos suplementados tendieron a disminuir la degradabilidad potencial de MS, PB, FDN, FDA, como la degradabilidad efectiva de la MS, FDN y FDA. Sin embargo, a diferencia de la monensina, el cinamaldehído aumentó la producción total de AGV y no afectó la proporción molar de AGV. Las dos dosis evaluadas de cinamaldehído mostraron el mismo efecto. Los resultados indicaron que cinnamaldehyde modificó la fermentación ruminal in vitro.
Palabras-clave: cabra; canela; monensina; fermentación ruminal; incubadora artificial
INTRODUCCIÓN
Los animales rumiantes son incapaces de producir enzimas degradadoras de la fibra. Han desarrollado una relación simbiótica con microorganismos ruminales (bacterias, hongos y protozoos) que les proporcionan proteínas, vitaminas y ácidos grasos volátiles a cambio de un hábitat adecuado para el crecimiento. Al contrario de los rumiantes salvajes, los rumiantes domésticos a menudo se alimentan de gran cantidad de grano y poca fibra. Cuando los rumiantes se alimentan con raciones deficientes en fibra, se interrumpen los mecanismos fisiológicos de la homeostasis, disminuye el pH ruminal, se altera la ecología microbiana y el animal se vuelve más susceptible a los trastornos metabólicos y, en algunos casos, a las enfermedades infecciosas. Algunos trastornos pueden ser contrarrestados por los aditivos alimenticios como ionóforos (Russell y Rychlik, 2001).
Uno de los aditivos comúnmente utilizados en los rumiantes domésticos es la monensina, debido a su efecto positivo en la mejora del metabolismo de la energía y el nitrógeno, y su efecto preventivo contra los trastornos digestivos derivados de la fermentación anormal del rumen (Castillo et al. 2004). Sin embargo, el uso de antibióticos como promotores del crecimiento en el ganado ha sido limitado en la Unión Europea debido a su probable implicación en el desarrollo de la resistencia a los antibióticos microbianos. Para enfrentar esta prohibición, se deben proponer alternativas para mantener la salud animal, la productividad y la seguridad microbiana de los alimentos.
Las plantas producen varios compuestos secundarios con actividad antimicrobiana (Cowan 1999). El cinamaldehído es el principal compuesto del aceite esencial de canela y su efecto antimicrobiano in vitro ha sido ampliamente demostrado (Hili et al. 1997, Helander et al. 1998 y Valero y Salmerón 2003). Se ha reportado que el cinamaldehído podría considerarse una alternativa potencial a la monensina para modificar la fermentación del rumen en el ganado de carne (Khorrami et al. 2015). El cinamaldehído tenía un potencial limitado para mejorar la eficiencia alimentaria y el crecimiento en corderos alimentados con dietas basadas en concentrados (Chaves et al. 2011). Se informó un efecto de la dieta en ovejas cuando se usó cinamaldehído para modificar la fermentación del rumen (Mateos et al. 2013).No se dispone de datos del cinamaldehído utilizado como aditivo para las cabras Murciano-Granadina. Además, se ha demostrado que los aceites esenciales son aditivos alimentarios prometedores para mitigar las emisiones de metano y amoníaco (Cobellis et al. 2016). Sin embargo, el modo de acción y los aditivos de los aceites esenciales en el microbioma del rumen siguen siendo poco conocidos (Cobellis et al. 2016).
Se evaluó el efecto del cinamaldehído en la fermentación in vitro del rumen de cabra. Para lograr esto, se midió la degradabilidad de la materia seca, las proteínas y la fibra en una incubadora artificial. También se determinaron las concentraciones de ácidos grasos volátiles (ácidos acético, propiónico y butírico) y cinamaldehído en el fluido ruminal.
MATERIALES Y MÉTODOS
Materiales y productos químicos. El sustrato utilizado para la incubación fue la mezcla de (base de materia seca) 700 g de grano de cebada (Hordeum vulgare) y 300 g de heno de alfalfa (Medicago sativa). El grano de cebada y el heno de alfalfa se molieron a través de un tamiz de 1 mm (Molino de martillo, Culatti, Italia). El cinamaldehído, la monensina (95 %) y el ácido propiónico se suministraron por Fluka Chemika (Switzerland). El ácido acético se adquirió en Riedel-de Haen (Alemania) y el ácido butírico y 4-metilvalérico en Sigma Aldrich (USA).
Líquido ruminal. El líquido ruminal se extrajo de dos cabras Murciano-Granadina fistuladas, alimentadas con heno de alfalfa ad libitum. Los fluidos del rumen se agruparon y se transportaron al laboratorio en un termo sellado. Luego, se filtró inmediatamente a través de cuatro capas de estopilla y se purgó con CO2 para mantener las condiciones anaeróbicas.
Incubaciones y tratamientos in vitro. Las incubaciones in vitro se realizaron en la incubadora DaisyII (Ankom Technology,USA.) (Mandebvu et al. 2001). La incubadora está compuesta por cuatro frascos de digestión (2 L de capacidad) mantenidos a 39.5 ºC en rotación constante y bajo atmósfera saturada de CO2. Cada frasco de digestión se llenó con solución tampón precalentada (39.5ºC) (que contenía 1317 mL de solución A: KH2PO4, 10 g/L; MgSO4,.7H2O 0.5 g/L; NaCl, 0.5 g/L, CaCl2, 2H2O, 0.1 g/L y CO (NH2)2, 0.5 g/L y 267 mL de solución B: Na2CO3, 15 g/L y Na2S.9H2O, 1 g/L, pH ajustado a 6,8); 400 mL de líquido ruminal y 16 mL de solución aditiva.
Se probaron cuatro tratamientos, uno por cada frasco in vitro: control negativo (CN), control positivo (CP) con monensina 7,5 ppm y cinnamaldehído a 250 ppm (C250) y 500 ppm (C500). Los aditivos (monensina y cinamaldehído) se disolvieron inicialmente en 16 mL de etanol. Con el fin de evitar toda confusión debido a los efectos principales del etanol, este producto también se añadió (16 mL) al tratamiento de control negativo (CN). Las concentraciones seleccionadas de monensina y cinamaldehído se basaron en datos publicados, que habían mostrado propiedades antimicrobianas in vitro, para la monensina Dennis et al. (1981), Domescik y Martin (1999); Wang et al. (2004) y para cinnamaldehyde Hili et al. (1997) y Chang et al. (2001) y Valero y Salmerón (2003).
Se pesaron veintiocho muestras (0,5 g) por frascos en bolsas de filtro ANKOM F57 (ANKOM Technology, USA). Las bolsas (tamaño 5,5 cm x 5 cm) tenían un tamaño de poro de 25 µm y se sellaron térmicamente. Se retiraron cuatro bolsas por tratamiento a 0, 4, 8, 12, 24, 48 y 72 horas de incubación. Las bolsas se lavaron inmediatamente con agua corriente hasta que el agua estuvo clara, se secaron en estufa a 60 °C durante 48 h y se pesaron. El contenido de las bolsas se congeló hasta su posterior análisis.
Análisis químico. La materia seca se determinó secando las muestras a 60ºC durante 48 h; la proteína cruda (PC) por el método Kjeldahl (AOAC, 1990); la fibra detergente neutra (FDN) y la fibra detergente ácida (FDA) por el método Van Soest y Roberston (1991).
Preparación de muestras para análisis de CG. A las 48 h de la incubación, se recogieron dos muestras de 50 mL de líquido ruminal de cada frasco. Las muestras se centrifugaron a 5.000 g durante 20 minutos y el sobrenadante se acidificó con 1 mL de ácido sulfúrico al 50%. El sobrenadante se almacenó a -20ºC. Para el análisis de CG, se mezclaron 5 mL de muestras ruminales acidificadas, 5 mL de agua desionizada y 0,5 mL de una solución estándar interna (4 ácido metil-n-valérico 30 mM) y se centrifugaron (7 minutos a 7.500 g).
Condiciones de análisis de la CG. La determinación de los ácidos grasos volátiles y el cinamaldehído en el líquido ruminal se realizó utilizando un cromatógrafo de gases Thermo Finnigan Trace (Thermo, Italia), equipado con un detector de ionización de llama y columna capilar de sílice fundida TR-FFAP de 30 m × 0,25 mm i.d., 0,25 µm (Teknokroma, España). La temperatura de la estufa se mantuvo a 90ºC durante 1 minuto y aumentó de 90 a 125ºC a una velocidad de 2,6ºC/ min y de 125 a 180ºC a 10 ºC/min. Las temperaturas del inyector y del detector fueron de 220 y 260ºC, respectivamente. El flujo del gas portador fue de 2.0 mL/min y el volumen de inyección fue de 1 μL. El flujo de aire del FID fue de 350 mL/min, mientras que el flujo de H2 fue de 35 mL/min (Madrid et al. 1999). El procesamiento de datos se realizó a través del Chrom-Card Data System (Finnigan, Italia). Todos los productos se determinaron en comparación con el área del pico del estándar interno (ácido 4 metil-n-valérico).
Cálculos y análisis estadístico. Los valores de desaparición de MS, PB, FDN y FDA de las bolsas de filtro en cada tiempo de incubación se ajustaron a la ecuación exponencial descrita por Ørskov y McDonald (1979) y = a + b (1-e-ct), donde y es el la pérdida del componente de alimentación analizado de la bolsa de filtro en el tiempo t, a es la fracción soluble, b es la fracción insoluble potencialmente degradable y c es la tasa fraccional de degradación b. Cuando el valor de a es negativo o el valor de b es mayor que 100, se empleó la ecuación descrita por McDonald (1981) y = b (1-e-c (tL)) donde L indica el tiempo que falta para comenzar la degradación de la fracción b. La degradabilidad potencial (DP) es la suma de las fracciones a y b. La degradabilidad efectiva (DE) se calculó por la ecuación descrita por Ørskov y McDonald (1979) DE = a + ((bc)/(c + r)) o por la ecuación descrita por McDonald (1981) DE = ((bc)/(c + r)) (- (c + r) L) asumiendo un valor constante de la tasa fraccional de paso (r) de 0.06 h-1 (Sauvant et al. 2004).
Los datos de fermentación en la incubadora DAISYII se analizaron por ANOVA. Para la degradación de nutrientes, el modelo utilizado fue Y = µ + A + B + AB + ԑ, donde µ es la media, A y B son los efectos del tipo de aditivo y el tiempo de incubación, respectivamente, AB es la interacción tipo de aditivo x tiempo de incubación y ԑijk es el error. Los datos de los AGV se analizaron por ANOVA. Las diferencias entre las medias de tratamiento se determinaron mediante la prueba Least Significant Difference (LSD). La significancia estadística se estableció cuando P <0.05. Todos los cálculos se realizaron utilizando SPSS (1997).
RESULTADOS Y DISCUSIÓN
La composición química de la dieta incubada se presenta en la tabla 1. La dieta fue 12.87 % PB, 28.54 % FDN y 12.84 % FDA.
Table 1 Chemical composition of incubated mixed diet (as DM basis) a
| Composition (g/kg DM) | Mixed diet (700 g barley grain + 300 g alfalfa hay) |
|---|---|
| OM | 941.6 |
| Ash | 58.1 |
| CP | 128.7 |
| NDF | 285.4 |
| ADF | 128.4 |
| ADL | 19.6 |
a OM = organic matter; CP = crude protein; NDF = neutral-detergent fibre; ADF = acid-detergent fibre; ADL = acid-detergent lignin.
Degradabilidad de la materia seca. La desaparición de la materia seca según el tipo de tratamiento y el tiempo de incubación, como la cinética de la degradabilidad de la MS se muestran en la tabla 2. Hubo interacción significativa entre el tiempo de incubación y el tratamiento (P = 0,007). Los aditivos (P <0.05) influyeron en la desaparición de la MS. En los tiempos de incubación de 48 y 72 horas, los tratamientos con CP, C250 y C500 redujeron (P <0,001) la desaparición de la MS en comparación con el tratamiento con CN. Por otro lado, la desaparición de la MS (P <0.001) aumentó cuando el tiempo de incubación avanzó. Todos los aditivos redujeron la degradabilidad potencial de la MS (tabla 2) en comparación con el tratamiento con CN (79.4, 78.5, 78.6 vs 83.6 %). La disminución de la DP se correspondió con una reducción de la fracción degradable b. Los estudios in vitro (Jalc et al. 1992 y Wang et al. 2004) demostraron una reducción de la desaparición de la MS cuando se agregó monensina a 2,5 y 15 ppm. El mismo efecto para la monensina se informó en estudios in vivo (Rogers et al. 1997 y Wang et al. 2004). Para una mezcla de aceites esenciales (timol (5-metil-2- (1-metiletil) fenol), guayacol (2-metoxifenol), limoneno (1-metil-4-(1-metiletenil) ciclohexeno) se reportó una reducción de la desaparición de MS in situ para alimentos concentrados como guisantes (Pisum sativum) (Molero et al. 2004) o harina de soja (Glycine max) (Newbold et al. 2004). La mezcla de estos aceites esenciales inhibió el crecimiento de los cultivos más puros de bacterias ruminales en concentraciones de menos de 100 ppm (McIntosh et al. 2003).
Table 2 Effect of treatments on dry matter degradability. Disappearance kinetic’s according to Ørskov and McDonald (1979) model
| Treatmenta | Incubation time (h) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | 4 | 8 | 12 | 24 | 48 | 72 | SEM | P-value | |
| Negative control | 44.5 | 50.8bc | 62.6 | 64.7 | 72.6 | 82.3c | 83.0c | 0.5 | 0.001 |
| Monensin 7.5ppm | 46.3 | 54.8c | 60.5 | 63.2 | 72.4 | 76.8b | 80.0b | 0.5 | 0.001 |
| Cinnamaldehyde 250ppm | 45.5 | 47.9b | 60.2 | 66.3 | 73.1 | 75.9b | 79.2b | 0.4 | 0.001 |
| Cinnamaldehyde 500ppm | 44.2 | 48.1b | 59.8 | 65.9 | 73.7 | 76.1b | 79.7b | 0.6 | 0.001 |
| SEM | 1.1 | 0.7 | 0.8 | 0.5 | 0.3 | 0.4 | 0.3 | ||
| P-value | 0.895 | 0.015 | 0.635 | 0.110 | 0.314 | 0.001 | 0.005 | ||
| Exponential equation: | |||||||||
|
|
|
|
PD (%)d | ED (%)e | R2 | RSDf | |||
| Negative control | 44.4 | 39.2 | 0.061 | 83.6 | 64.2 | 95.6 | 3.0 | ||
| Monensin 7.5ppm | 46.9 | 32.5 | 0.062 | 79.4 | 63.4 | 95.6 | 2.4 | ||
| Cinnamaldehyde 250ppm | 43.4 | 35.1 | 0.075 | 78.5 | 62.9 | 94.5 | 3.0 | ||
| Cinnamaldehyde 500ppm | 42.8 | 35.8 | 0.077 | 78.6 | 62.9 | 93.6 | 3.3 | ||
a Incubation time x treatment interaction, P = 0.007.
b,c Means with different superscript within a column are significantly different (P<0.05).
d PD = a + b.
e ED = a + [( bc)/(c+r)], assuming a constant value of r of 0.06 h-1.
f RSD = Residual standard deviation.
Degradabilidad de la proteína bruta. La desaparición de la proteína bruta según el tipo de tratamiento y el tiempo de incubación, como la cinética de la degradabilidad de la PB se muestran en la tabla 3. Hubo interacción significativa entre el tiempo de incubación y el tratamiento (P = 0.030). Los efectos de los aditivos probados en la degradación de la PB no fueron tan notables, ya que se encontró una fracción soluble (a) de PB muy alta. La monensina y el cinamaldehído no afectaron la desaparición de la PB (P> 0.05), aunque se observó interacción significativa (P <0.05) entre el tipo de tratamiento y el tiempo de incubación (tabla 3). Además, a las 48 h de incubación, la desaparición de la PB fue menor (P <0,001) en los tratamientos suplementados que en el tratamiento CN (94.9, 94.9 y 93.3 % vs 98.1 % para los tratamientos con PB, C250, C500 y CN respectivamente). La fracción potencialmente degradable (b) disminuye ligeramente cuando se incluyen los aditivos, se observó una tendencia similar en la DP. Es sabido que la monensina disminuye la degradación ruminal de la PB (Van Nevel y Demeyer 1977 y Hillaire et al. 1989). Ghorbani et al. (2010) demostraron que la monensina podría disminuir la cantidad de amoníaco en el líquido ruminal. Este efecto podría deberse al hecho de que la momensina afecta negativamente a la población de bacterias grampositivas que tienen una alta actividad de producción de amoníaco (Duffield et al. 2002). Sin embargo, la síntesis microbiana ruminal no parece verse afectada por la inclusión de monensina (Ghorbani et al. 2010). Por otro lado, algunos estudios no encontraron ningún efecto de la monensina en la degradación de la PB (Vanhaecke et al. 1985), mientras que otros mostraron aumento de la degradación de la PB (Benchaar et al. 2006), probablemente debido a varios factores, como la concentración de monensina o el tipo de dieta utilizada. La degradación in situ de CB también puede reducirse por productos de plantas antimicrobianas. Una mezcla de timol (5-metil-2-(1-metiletil)fenol), guaiacol (2-metoxifenol) y limoneno (1-metil-4-(1-metiletenil) ciclohexeno) redujo la degradación de la PB de la harina de soya en las ovejas( Newbold et al. 2004) y las semillas de lupino (Lupinus angustifolius), guisantes verdes (Pisum sativum) y harina de girasol (Helianthus annuus) disminuyeron la degradación de la PB en las novillas en crecimiento alimentadas con una dieta altamente concentrada (Molero et al. 2004). Tager y Krause (2010) demostraron que la digestibilidad de la proteína bruta fue baja con cinamaldehído y eugenol (500 mg/L/d).
Table 3 Effect of treatments on crude protein degradability. Disappearance kinetic’s according to Ørskov and McDonald (1979) model
| Treatmenta | Incubation time (h) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | 4 | 8 | 12 | 24 | 48 | 72 | SEM | P-value | |
| Negative control | 79.0 | 81.2b | 88.0 | 89.1 | 94.1 | 98.1d | 98.4 | 0.3 | 0.001 |
| Monensin 7.5ppm | 81.0 | 84.9c | 87.3 | 88.4 | 94.5 | 94.9c | 98.2 | 0.4 | 0.001 |
| Cinnamaldehyde 250ppm | 81.5 | 80.5b | 87.5 | 90.8 | 93.8 | 94.9c | 97.6 | 0.4 | 0.001 |
| Cinnamaldehyde 500ppm | 79.2 | 84.8c | 89.6 | 90.7 | 95.1 | 93.3b | 97.4 | 0.5 | 0.001 |
| SEM | 0.9 | 0.3 | 0.9 | 0.5 | 0.2 | 0.2 | 0.2 | ||
| P-value | 0.714 | 0.013 | 0.798 | 0.293 | 0.303 | 0.001 | 0.401 | ||
| Exponential equation: : | |||||||||
|
|
|
|
PD (%)e | ED (%)f | R2 | RSDg | |||
| Negative control | 78.4 | 20.5 | 0.063 | 98.9 | 88.9 | 96.3 | 1.4 | ||
| Monensin 7.5ppm | 81.2 | 16.4 | 0.056 | 97.6 | 89.1 | 93.8 | 1.5 | ||
| Cinnamaldehyde 250ppm | 79.9 | 17.0 | 0.066 | 96.9 | 88.8 | 88.7 | 2.2 | ||
| Cinnamaldehyde 500ppm | 80.2 | 14.2 | 0.090 | 94.4 | 88.7 | 83.0 | 2.6 | ||
a Incubation time x treatment interaction, P = 0.030.
b,c,d Means with different superscript within a column are significantly different (P<0.05).
e PD = a + b.
f ED = a + [( bc)/(c+r)], assuming a constant value of r of 0.06 h-1.
g RSD = Residual standard deviation
Degradabilidad de la fibra. En la tabla 4 y 5 se muestran las desapariciones de la FDN y la FDA según el tipo de tratamiento y el tiempo de incubación, así como la cinética de la degradabilidad de la FDN y la FAD. Hubo interacción significativa entre el tiempo de incubación y el tratamiento (P = 0,001) tanto para la FDN como para la FDA. Las degradaciones de FDN y FDA se redujeron (P <0,001) con la suplementación de aditivos. Además, el efecto del cinamaldehído a 250 ppm en la degradación de la fibra fue similar al observado con la monensina. La desaparición de la fibra para el tratamiento con C500 no comenzó hasta las 8 h de incubación para la degradación de FDN y hasta las 12 h de incubación en todos los tratamientos para la degradación de FDA. El tratamiento con C500 mostró la fase de latencia a partir de la cual comenzó la degradación de la FDN. La fase de latencia fue necesaria para la fracción de FDA en todos los tratamientos utilizados. Este resultado es consistente con el hecho de la FDA no tiene fracción soluble (Van Soest, 1994). Los tratamientos con PB, C250 y C500 tendieron a reducir la DP y la DE de la fracción de fibra, en comparación con el tratamiento de CN. El efecto inhibitorio de la monensina en la degradación de la fibra está bien documentado por otros autores en ensayos in vitro e in situ (Jalc et al. 1992). El efecto de los extractos de plantas en la degradación de las fibras depende de su estructura química. De esta forma, los taninos (Hervás et al. 2003) y las saponinas (Wina et al. 2005) podrían reducir la degradación in situ de la FDN, mientras que el extracto de Achillea millefolium que contiene flavonoides, incrementa las degradabilidades de FDN y FDA (Broudiscou et al. 2002).
Table 4 Effect of treatments on neutral detergent fiber degradability. Disappearance kinetic’s according to Ørskov and McDonald (1979) or McDonald (1981) model
| Treatmenta | Incubation time (h) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | 4 | 8 | 12 | 24 | 48 | 72 | SEM | P-value | |
| Negative control | 6.0d | 14.9d | 19.7c | 24.6d | 29.8c | 44.3c | 49.5d | 0.3 | 0.001 |
| Monensin 7.5ppm | 5.2d | 14.5d | 18.8c | 21.0c | 25.1b | 31.5b | 37.9c | 0.3 | 0.001 |
| Cinnamaldehyde 250ppm | 2.3c | 9.9c | 16.2c | 23.3cd | 26.3b | 27.8b | 34.6bc | 0.4 | 0.001 |
| Cinnamaldehyde 500ppm | 0.0b | 0.0b | 0.0b | 17.4b | 25.6b | 31.5b | 31.7b | 0.3 | 0.001 |
| SEM | 0.3 | 0.1 | 0.6 | 0.3 | 0.4 | 0.5 | 0.5 | ||
| P-value | 0.008 | 0.001 | 0.001 | 0.005 | 0.050 | 0.001 | 0.001 | ||
| Exponential equation: | |||||||||
|
|
|
|
|
PD (%)e | ED (%)f | R2 | RSD g | ||
| Negative control | 8.0 | 45.3 | 0.033 | 53.3 | 24.1 | 98.1 | 2.1 | ||
| Monensin 7.5ppm | 7.7 | 29.0 | 0.047 | 36.7 | 20.4 | 94.2 | 2.5 | ||
| Cinnamaldehyde 250ppm | 2.1 | 29.3 | 0.085 | 31.4 | 19.3 | 94.2 | 2.6 | ||
| Cinnamaldehyde 500ppm | 34.2 | 0.048 | 2.38 | 34.6 | 11.8 | 88.6 | 4.9 | ||
a Incubation time x treatment interaction, P = 0.001.
b,c,d Means with different superscript within a column are significantly different (P<0.05).
e PD = a + b.
f ED = a + [( bc)/(c+r)] or [( bc)/(c+r)](-(c+r)L), assuming a constant value of r of 0.06 h-1.
g RSD = Residual standard deviation.
Table 5 Effect of treatments on acid detergent fiber degradability. Disappearance kinetic’s according to McDonald (1981) model.
| Treatmenta | Incubation time (h) | ||||||
|---|---|---|---|---|---|---|---|
| 12 | 24 | 48 | 72 | SEM | P-value | ||
| Negative control | 5.0d | 11.0c | 28.3c | 37.7c | 0.4 | 0.001 | |
| Monensin 7.5ppm | 0.0b | 2.2b | 12.6b | 22.1b | 0.2 | 0.001 | |
| Cinnamaldehyde 250ppm | 5.2d | 9.1c | 11.3b | 20.7b | 0.5 | 0.001 | |
| Cinnamaldehyde 500ppm | 2.8c | 9.1c | 15.4b | 18.0b | 0.3 | 0.001 | |
| SEM | 0.2 | 0.7 | 0.6 | 0.7 | |||
| P-value | 0.003 | 0.040 | 0.001 | 0.002 | |||
| Exponential equation | |||||||
|
|
|
L (h) | PD (%)e | ED (%)f | R2 | RSD g | |
| Negative control | 39.6 | 0.025 | 4.35 | 39.6 | 8.0 | 92.1 | 4.2 |
| Monensin 7.5ppm | 23.5 | 0.019 | 6.18 | 23.5 | 3.5 | 82.9 | 3.5 |
| Cinnamaldehyde 250ppm | 19.8 | 0.027 | 3.11 | 19.8 | 4.7 | 86.1 | 2.8 |
| Cinnamaldehyde 500ppm | 19.6 | 0.029 | 3.71 | 19.6 | 5.6 | 93.5 | 1.9 |
a Incubation time x treatment interaction, P = 0.001.
b,c,d Means with different superscript within a column are significantly different (P<0.05).
e PD = a + b.
f ED = [( bc)/(c+r)](-(c+r)L), assuming a constant value of r of 0.06 h-1.
g RSD = Residual standard deviation.
Ácidos grasos volátiles. El efecto de los tratamientos en la producción de ácidos grasos volátiles se muestra en la tabla 6. El efecto principal de la monensina en el metabolismo de la energía ruminal es aumentar la producción de ácido propiónico y reducir la producción de ácido acético, lo que resulta en menor relación acético: propiónico (Wang et al. 2004). En este estudio, este efecto también se encontró. El cinamaldehído aumentó la producción total de AGV (P <0.01) en comparación con CN o PB, pero no afectó la proporción molar de acetato, propionato o butirato en comparación con los tratamientos de control. Cuando se agregó cinamaldehído a la concentración de 2,2 mg/mL en un sistema de cultivo continuo, la producción total de AGV y la proporción molar de propionato no se afectaron, pero se notó una proporción molar inferior de acetato y un aumento numérico en la proporción molar de butirato (Busquet et al. 2005). En incubadoras similares, la adición de 0,22 mg/mL de un extracto de canela con 59 % de cinamaldehído aumentó la proporción molar de acetato y disminuyó la proporción molar de propionato y butirato durante el período de adaptación. Sin embargo, estos efectos desaparecieron después de 6 días de fermentación (Cardozo et al. 2004). Otro estudio (Wina et al. 2005) también informó aumento en la producción total de AGV debido a extractos de plantas. Por lo tanto, la adición de 2 o 4 mg/mL de extracto con metanol de Sapindus rarak que contiene saponinas a incubadoras in vitro de jeringas de vidrio, incrementó la producción total de AGV a las 48 h de incubación. A diferencia de, una dosis de 540 mg/L de cinamaldehído redujo la producción total de AGV en una incubación de 16 horas de mezcla de microorganismos de rumen mixto con dietas de contenido de concentrado medio y alto, mientras que las dosis más bajas (180, 60 y 20 mg/L) no afectaron la producción total de AGV en comparación con el grupo control (Mateos et al. 2013). De esta manera, Macheboeuf et al. (2008) no encontraron aumento de la producción total de AGV con suplementación de cinamaldehído a dosis de 132 o 264 mg/L, pero la producción total de AGV se redujo con dosis de cinamaldehído de 396 y 661 mg/L. Blanch et al. (2016) describen la reducción total de AGV con una dosis de 172 mg/L de cinamaldehído.
Table 6 Effect of treatments on volatile fatty acids production at 48 h of in vitro incubation
| Treatments | Total VFA (mM) | Molar proportion VFA (%) | ||
|---|---|---|---|---|
| Acetic acid | Propionic acid | Butyric acid | ||
| Rumen fluid at 0 h of incubation | 7.45 | 78.94 | 9.79 | 11.25 |
| Rumen fluid at 48 h of incubation | ||||
| Negative control | 21.06 b | 70.17 | 16.76 b | 13.05 a |
| Monensin 7.5 ppm | 16.65 b | 66.16 | 23.74 a | 10.09 b |
| Cinnamaldehyde 250 ppm | 28.17 a | 69.61 | 16.70 b | 13.66 a |
| Cinnamaldehyde 500 ppm | 28.91 a | 69.85 | 17.92 b | 12.18 ab |
| SEM | 0.64 | 0.82 | 0.45 | 0.37 |
| P-value | 0.003 | 0.152 | 0.002 | 0.021 |
a-b Means with different superscript within a column are significantly different (P<0.05)
Cuando se realizaron los análisis de cromatografía de gases, se encontró un pico en las muestras de rumen con tratamientos con cinamaldehído (figura 1). Este pico se identificó utilizando una solución estándar de cinamaldehído. Como consecuencia, el método desarrollado podría usarse para determinar tanto los AGV y los compuestos derivados de plantas como el cinamaldehído en el fluido ruminal, método en el que tampoco sería necesaria una extracción con solvente apolar.
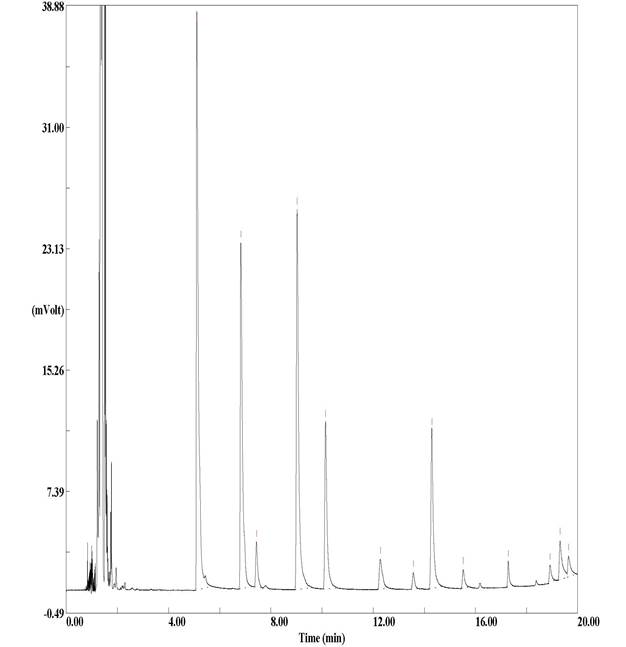
Figure 1 Chromatogram of rumen fluid with cinnamaldehyde (500 ppm) at 48h of incubation. Peaks: 1= acetic acid, 2= propionic acid, 3= butyric acid, 4= 4 methyl n-valeric acid, 5= cinnamaldehyde.
En conclusión, los resultados indicaron que el cinamaldehído modificó la fermentación ruminal in vitro de la cabra. Este compuesto fenólico redujo la MS y la degradación de la fibra de la misma manera que la monensina. Sin embargo, a diferencia de la monensina, el cinamaldehído aumentó la producción total de AGV y no afectó la proporción molar de AGV. Las dos dosis de cinamaldehído utilizadas mostraron efecto idéntico y probablemente fueron demasiado altas. Se requieren investigaciones futuras con dosis más bajas y estudios in vivo.
AGRADECIMIENTOS
P. Catalá-Gregori recibió una beca de investigación (AP2002-3340) del Ministry of Education and Science of Spain.
REFERENCIAS
AOAC, 1990. Official methods of analysis. 15th ed. Assoc. Offic. Anal. Chem., Inc., Arlington, VA. USA. ISBN: 978-0935584424. [ Links ]
Benchaar, C., Petit, H.V., Berthiaume, R., Whyte, T.D. & Chouinard, P. Y. 2006. Effects of addition of essential oils and monensin premix on digestion, ruminal fermentation, milk production, and milk composition in dairy cows. J. Dairy Sci. 89: 4352-4364. ISSN: 0022-0301. http://doi.org&10.3168/jds.58022-8302(06)72482-1 [ Links ]
Blanch, M., Carro, M.D., Ranilla, M.J., Viso, A., Vázquez-Añón, M. & Bach, A. 2016. Influence of a mixture of cinnamaldehyde and garlic oil on rumen fermentation, feeding behavior and performance of lactating dairy cows. Anim. Feed Sci. Technol: 219, 313-323. ISSN: 0377-8401. http://doi.org/10.1016/j. anifeedsci.2016.07.002. [ Links ]
Broudiscou, L.P., Papon, Y. & Broudiscou, A.F. 2002. Effects of dry plant extracts on feed degradation and the production of rumen microbial biomass in a dual outflow fermenter. Anim. Feed Sci. Technol . 101, 183-189. ISSN: 0377-8401. http://doi.org/10.1016/S0377-8401(2)00221-3. [ Links ]
Busquet, M., Calsamiglia, S., Ferret, A. & Kamel, C. 2005. Screening for effects of plant extracts and active compounds of plants on dairy cattle rumen microbial fermentation in a continuous culture system. Anim. Feed Sci. Technol . 123-124:597-613. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2005.03.008. [ Links ]
Cardozo, P.W., Calsamiglia, S., Ferret, A. & Kamel, C. 2004. Effects of natural plant extracts on ruminal protein degradation and fermentation profiles in continuous culture. J. Anim. Sci. 82: 3230-3236. ISSN: 0021-8812. http://doi.org/10.2527/2004.82113230x. [ Links ]
Castillo, C., Benedito, J.L., Méndez, J., Pereira, V., López-Alonso, M., Miranda, M. & Hernández, J. 2004. Organic acids as a substitute for monensin in diets for beef cattle. Anim. Feed Sci. Technol: 115, 101-116. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2004.02.001. [ Links ]
Cobellis, G., Trabalza-Marinucci, M., Yu, Z. 2016. Critical evaluation of essential oils as rumen modifiers in ruminant nutrition: A review. Sci. Total Environ. 545-546, 556-568. ISSN: 0048-9697. http://doi.org/10.1016/j.scitotenv.2015.12.103. [ Links ]
Chang, S.T., Chen, P.F. & Chang, S.C. 2001. Antibacterial activity of leaf essential oils and their constituents from Cinnamomum osmophloeum. J. Ethnopharmacol. 77: 123-127. ISSN: 0378-8741. http://doi.org/10.1016/ S0378-8741(01)00273-2 [ Links ]
Chaves, A.V., Dugan, M.E.R., Stanford, K., Gibson, L.L., Bystrom, J.M., McAllister, T.A., Van Herk, F. & Benchaar, C. 2015. A dose-response of cinnamaldehyde supplementation on intake, ruminal fermentation, blood metabolites, growth performance, and carcass characteristics of growing lambs. Livest. Sci. 141: 213-220. ISSN: 1871-1413. http://doi.org/10.1016/jlivsci.2011.06.006. [ Links ]
Cowan, M.M. 1999. Plant products as antimicrobial agents. Clin. Microbiol. Rev. 12: 564-582. ISSN1098-6618. DOI:10.1182/CMR.12.4.564. [ Links ]
Dennis, S.M., Nagaraja, T.G. & Bartley, E.E. 1981 Effect of lasalocid or monensin on lactate production from in vitro rumen fermentation of various carbohydrates. J. Dairy Sci. 64, 2350-2356. ISSN: 0022-0302. DOI:10.3168/jds.S0022-0302(81)82857-3. [ Links ]
Domescik, E.J. & Martin, S.A., 1999. Effects of laidlomycin propionate and monensin on the in vitro mixed ruminal microorganism fermentation. J. Anim. Sci. 77: 2305-2312. ISSN: 0021-8812. http://doi.org/10.2527/1999.778305x. [ Links ]
Duffield, T., Bagg, R., DesCoteaux, L., Bouchard, E., Brodeur, M., DuTremblay, D., Keefe, G., LeBlanc, S. & Dick, P. 2002. Prepartum monensin for the reduction of energy associated disease in postpartum dairy cows. J. Dairy Sci. 85: 397-405. ISSN: 0022-0302. DOI: 10.3168/jus.S0022-0302(2)74087-3. [ Links ]
Ghorbani, B., Ghoorchi, T., Amanlou, H. & Zerehdaran, S. 2010. Effects of using monensin and different levels of crude protein on milk production, blood metabolites and digestion of dairy cows. Asian-Australasian J. Anim. Sci. 24: 65-72. ISSN: 1011-2367. http://doi.org/10.5713/ajas.2011.40623. [ Links ]
Helander, I.M., Alakomi, H.L., Latva-Kala, K., Mattila-Sandholm, I., Pol, T., Smid, E.J., Gorris, L.G.M. & Von Wright, A. 1998. Characterization of the action of selected essential oil components on gram-negative bacteria. J. Agric. Food Chem. 46: 3590-3595. ISSN: 1520-5118. http://doi.org/10.1021/j6980154m. [ Links ]
Hervás, G., Frutos, P. Giraldes, F.J., Mantecón, A.R. & Álvarez Del Pino, M.C. 2003. Effect of different doses of quebracho tannins extract on rumen fermentation in ewes. Anim. Feed Sci. Technol. 109: 65-78. ISSN: 0377-8401. http://doi.org/10.1016/S0377-8401(3)00208-6. [ Links ]
Hili, P., Evans, C.S., Veness, R.G. 1997. Antimicrobial action of essential oils: the effect of dimethylsulphoxide on the activity of cinnamon oil. Lett. Appl. Microbiol. 24, 269-275. ISSN: 1472-765X. http://doi.org/10.1016/j.1472-765X-1997.00073.X. [ Links ]
Hillaire, M.C., Jouany, J.P., Gaboyard, C. & Jeminet, G. 1989. In vitro study of the effect of different ionophore antibiotics and of certain derivatives on rumen fermentation and on protein nitrogen degradation. Reprod. Nutr. Dev. 29: 247-257. [ Links ]
Jalc, D., Baran, M., Vendrak, T., Siroka, P. 1992. Effect of monensin on fermentation of hay and wheat bran investigated by rumen simulation technique (Rusitec). Basal parameters of fermentation. Arch. Tierernahr. 42: 147-152. [ Links ]
Khorramia, B., Vakili, A.R., Danesh Mesgarana, M. & Klevenhusenb, F. 2015.Thyme and cinnamon essential oils: Potential alternatives for monensin as a rumen modifier in beef production systems. Anim. Feed Sci. Technol. 200: 8-16. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2014.11.009. [ Links ]
Macheboeuf, D., Morgavi, D.P., Papon, Y., Mousset, J.-L. & Arturo-Schaan, M. 2008. Dose-response effects of essential oils on in vitro fermentation activity of the rumen microbial population. Anim. Feed Sci. Technol. 145, 335-350. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2007.05.044. [ Links ]
Madrid, J., Megías, M.D. & Hernández, F. 1999. Determination of short chain volatile fatty acids in silages from artichoke and orange by-products by capillary gas chromatography. J. Sci. Food Agric. 79: 580-584. ISSN: 1097-0010. http://doi.org/10.1002/(SICI)1047-0010(19990315)79:4<580::AID. [ Links ]
Mandebvu, P., Klingener, J.L., LaCoss, D.D., Ballard, C.S., Sniffen, C.J. & Kramer, S.R. 2001. Effects of source and level of nitrogen, and changing buffer/ruminal fluid at 48h on in vitro digestion of feedstuffs. Anim. Feed Sci. Technol. 93: 43-54. ISSN: 0377-8401. http://doi.org/10.1016/S0377-8401(01)00268-1. [ Links ]
McDonald, I. 1981. A revised model for the estimation of protein degradability in the rumen. J. Agric. Sci., Camb. 96: 251-252. [ Links ]
McIntosh, F.M., Williams, P., Losa, R., Wallace, R.J., Beever, D.A. & Newbold, C.J. 2003. Effects of essential oils on rumen microorganisms and their protein matabolism. Appl. Environ. Microbiol. 69: 5011-5014. ISSN: 1098-5336. DOI: 10.1128/AEM.69.8.504-5014.2003. [ Links ]
Mateos, I., Ranilla, M.J., Tejido, M.L., Saro, C., Kamel., C. & Carro, M. D. 2013. The influence of diet type (dairy versus intensive fattening) on the effectiveness of garlic oil and cinnamaldehyde to manipulate in vitro ruminal fermentation and methane production. Anim. Prod. Sci. 53(4): 299-307. ISSN: 1836-0934.http://doi.org/10.1071/AN12167. [ Links ]
Molero, R., Ibars, M., Calsamiglia, S., Ferret, A. & Losa, P. 2004. Effects of a specific blend of essential oil compounds on dry matter and crude protein degradability in heifers fed diets with different forage to concentrate ratios. Anim. Feed Sci. Technol. 114: 91-104. ISSN: 0377-8401. http://doi.org/10.1016/anifeed.2003.11.011. [ Links ]
Newbold, C.J., McIntosh, F.M., Williams, P., Losa, R. & Wallace, R.J. 2004. Effects of a specific blend of essential oil compounds on rumen fermentation. Anim. Feed Sci. Technol. 114, 105-112. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2003.12.006. [ Links ]
Ørskov, E.R. & McDonald, I. 1979. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage. J. Agric. Sci., Camb. 92: 499-503. ISSN: 1469-5146.http://doi.org/10.1017/S0021859600063048. [ Links ]
Rogers, M., Jouany, J.P., Thivend, P., Fontenot, J.P. 1997. The effects of short-term and long-term monensin supplementation, and its subsequent withdrawal on digestion in sheep. Anim. Feed Sci. Technol . 65: 113-127. ISSN: 0377-8401. http://doi.org/10.1016/S0377-8401(96)01089-9. [ Links ]
Russell, J.B. & Rychlik, J.L. 2001. Factors that alter rumen microbial ecology. Sci. 292: 1119-1122. ISSN: 1095-9303. DOI: 10.1126/science.1058830. [ Links ]
Sauvant, D., Pérez, J.M. & Tran, G. 2004. Tablas de composición y de valor nutritivo de las materias primas destinadas a los animales de interés ganadero. Eds. Mundi-Prensa, Madrid, Spain. ISBN: 978 8484761778. [ Links ]
SPPS. 1997. Software for Windows, release 10.0. SPSS Inc., Chicago, IL. [ Links ]
Tager, L.R. & Krause, K.M. 2010. Effects of cinnamaldehyde, eugenol, and capsicum on fermentation of a corn-based dairy ration in continuous culture. Can. J. Anim. Sci. 90: 413-420. ISSN: 1918-1825. http://doi.org/10.4141/CJAS09080. [ Links ]
Valero, M. & Salmerón, M.C. 2003. Antibacterial activity of 11 essential oils against Bacillus cereus in tyndallized carrot broth. Int. J. Food Microbiol. 85: 73-81. ISSN: 0168-1605. http://doi.org/10.1016/S0168-1605(02)00484-1. [ Links ]
Van Nevel, C.J. & Demeyer, D.I. 1977. Effect of monensin on rumen metabolism in vitro. Appl. Environ. Microbiol. 34: 251-257. ISSN: 1098-5336. [ Links ]
Van Soest, P.J. 1994. Nutritional ecology of the ruminant. 2nd ed. Cornell University Press, New York. USA. ISBN: 978-0801 427725. [ Links ]
Van Soest, P.J. & Roberston, J.B. 1991. Methods for dietary fiber, neutral detergent fiber and nonstarch polysaccharides in relation to animal nutrition. J. DairySci. 74: 3588-3597. ISSN: 022-0302. http://doi.org/10.3168/jds.S0022-0302(9)78551-2. [ Links ]
Vanhaecke, H., van Nevel, C.J., Dendooven, R. & Demeyer, D.I. 1985. Effect of monensin on fermentation pattern and soybean protein degradation in the rumen of sheep. Arch. Tierernahr. 35: 279-286. [ Links ]
Wang, Y., Alexander, T.W. & McAllister, T.A. 2004. In vitro effects of monensin and tween 80 on ruminal fermentation of barley grain:barley silage-based diets for beef cattle. Anim. Feed Sci . Technol. 116: 197-209. ISSN: 0377-8401. http://doi.org/10.1016/j.anifeedsci.2004.06.006. [ Links ]
Wina, E., Muetzel, S., Hoffmann, E., Makkar, H.P.S. & Becker, K. 2005. Saponins containing methanol extract of Sapindus rarak affect microbial fermentation, microbial activity and microbial community structure in vitro. Anim. Feed Sci. Technol . 121: 159-174. ISSN: 0377-8401.http://doi.org/10.1016/j.anifeedsci.2005.02.016. [ Links ]
Recibido: 17 de Enero de 2019; Aprobado: 05 de Mayo de 2019











 text in
text in 


