My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cuban Journal of Agricultural Science
On-line version ISSN 2079-3480
Cuban J. Agric. Sci. vol.53 no.4 Mayabeque Oct.-Dec. 2019 Epub Dec 05, 2019
CIENCIA ANIMAL
Contaminantes fúngicos en piensos para ganado siciliano y primeros estudios sobre la actividad enzimática de aislados de Aspergillus.
1Dipartmento di Scienze Agrarie, Alimentari e Forestali (SAAF), Università degli Studi di Palermo, Viale Delle Scienze, Ed. 5, 90128 Palermo, Italy
2Instituto de Ciencia Animal (ICA), San José de Las Lajas, Mayabeque, Cuba
Los objetivos de este estudio fueron: 1) determinar la contaminación fúngica total en materias primas y ganado sicilianos, 2) evaluar la aparición de Aspergillus spp., Penicillium spp. y Fusarium spp, 3) identificar hongos pertenecientes al género Aspergillus y 4) determinar su capacidad de producir enzimas celulolíticas. Se recolectaron catorce muestras de alimento en una fábrica de piensos cerca de Palermo (Sicilia, Italia). El análisis de la micobiota total se realizó en Sabourad Dextrose Agar (SAB) y Potato Dextrose Agar (PDA) y los recuentos totales de hongos se expresaron como UFC/g. Los aislados de Aspergillus spp. se seleccionaron en función de la frecuencia de aislamiento y se identificaron utilizando características micro y macro morfológicas y análisis de secuencia ITS. La capacidad de los aislados de Aspergillus para producir enzimas celulolíticas se probó cualitativamente mediante un ensayo in vitro a dos temperaturas, 25 y 30 °C, y en condiciones estáticas y de agitación. La población total de hongos varió de 1.11x106 a 1.31x108 y de 1.11x103 a 1.58x106 UFC/g en PDA y SAB, respectivamente. Todas las muestras de pienso mostraron la presencia recurrente de colonias pertenecientes, principalmente, a los géneros ubicuos Aspergillus, Fusarium y Penicillium. Ocho aislados de Aspergillus spp. se obtuvieron e identificaron como A. amstelodami, A. awamori, A. flavus, A. niger, A. oryzae y A. tubingensis. Entre ellos, A. awamori, A. niger y A. tubingensis mostraron la mayor actividad enzimática. La presencia de potenciales aislados micotoxigénicos de Aspergillus spp. en los piensos analizados representan un riesgo para la salud animal; además, su capacidad para producir enzimas celulolíticas puede afectar seriamente la calidad del pienso.
Palabras-clave: mohos toxigénicos; materias primas; alimentos de origen animal; actividad celulolítica
INTRODUCCIÓN
La contaminación fúngica en alimentos y piensos causa importantes pérdidas económicas en los rendimientos agrícolas primarios, en las industrias transformadoras y en las explotaciones ganaderas (Godfray et al. 2016). Los principales hongos contaminantes (mohos), que pertenecen a varios géneros ubicuos, se caracterizan por la producción de grandes masas de conidias que se propagan fácilmente por aire al suelo, al agua, a las plantas y a los animales (Adhikari et al. 2004). La contaminación fúngica de las materias primas también se produce durante la precosecha (hongos producidos en el campo) y los períodos poscosecha, como los procesos de almacenamiento y transformación (hongos producidos por el almacenamiento) (Krnjaja et al. 2008 y Whitlow et al.2010). Los hongos contaminantes perjudican la preservabilidad y el valor nutricional de los alimentos y piensos mediante la producción de enzimas líticas y representan un riesgo potencial para la salud del consumidor por la actividad micotoxigénica (McNeil et al. 1984).
La actividad celulolítica está ampliamente distribuida en los hongos contaminantes pertenecientes al Tipo Ascomycota, como en los géneros Bulgaria, Chaetomium, Helotium, Neurospora, Aspergillus, Cladosporium, Fusarium, Geotrichum, Myrothecium, Paecilomyces, Penicillium y Trichoderma (Lynd et al. 2002 y Tian et al. 2009). Dominan, tanto en abundancia como en actividad, la comunidad microbiana responsable de la descomposición de los residuos de celulosa (Wilson 2011).
Entre estas, las especies que pertenecen al género Aspergillus son capaces de producir una gran variedad de glucanasas que permiten la degradación completa de la celulosa.
Además, las especies que pertenecen a los géneros Aspergillus, Fusarium y Penicillium, capaces de producir micotoxinas peligrosas, pueden causar trastornos metabólicos que producen efectos biológicos en animales como toxicidad hepática y renal, efectos en el sistema nervioso central y efectos estrogénicos (Greco et al. 2014). Algunas micotoxinas contaminantes se deben a la contaminación secundaria en humanos a través de huevos, carne o leche (efecto de arrastre), con efectos tóxicos agudos y crónicos (Volkel et al. 2011).
En particular, la contaminación de los piensos con hongos y sus esporas se describe en todo el mundo. En las regiones tropicales, Aspergillus spp. predominan en varios piensos y las especies de Penicillium, Fusarium y Alternaria son contaminantes recurrentes de los granos (Prasad et al. 2016). En Sicilia, estudios recientes sobre materias primas y piensos locales mostraron niveles bajos de contaminación por micotoxinas, en comparación con productos importados, mientras que muy pocos son los datos sobre el nivel de colonización de hongos (Finoli y Vecchio 2003, Gallo et al. 2008 y Russo 2015).
El objetivo de este estudio fue evaluar, en las materias primas sicilianas y los piensos para ganado, la contaminación fúngica total y detectar el porcentaje de los tres géneros micotoxigénicos potenciales (Aspergillus, Fusarium y Penicillium). Además, los aislados de Aspergillus más recurrentes, identificados a nivel de especie mediante metodologías morfológicas y moleculares, se analizaron para evaluar su actividad celulolítica.
MATERIALES Y MÉTODOS
Muestreo. Un total de catorce muestras de piensos (tabla 1) se recogieron en una fábrica de piensos ubicada en la provincia de Palermo (Sicilia, Italia) siguiendo las normas metodológicas (Reg. CE 1441/2007; Reg. CE 401/2006; DM 20/04 / 1978). Se tomaron aleatoriamente partes alícuotas de 600 g de diferentes partes de la bolsa o contenedor de cada pienso, tanto de las áreas de empaque como de almacenamiento. Las muestras se colocaron en bolsas plásticas estériles, se transportaron al laboratorio y se almacenaron a 4°C hasta su posterior análisis.
Table 1 Feed samples collected in a feed mill in the province of Palermo
| Code | Sample | Composition | Sampling area |
|---|---|---|---|
| 1 | Flaked broad bean | Raw material | Packaging area |
| 2 | Oat | Raw material | |
| 3 | Poultry feed | Soy flour, cornmeal, maize, wheat bran | |
| 4 | Flaked maize | Raw material | |
| 5 | Swine feed | Maize, wheat bran, barley, sunflower flour, carob, citrus peel | |
| 6 | Horses feed (West Performance) | Wheat bran, broad bean, flaked barley, carobs, maize, oat flour, molasses | |
| 7 | Cattle feed | Maize, barley, carobs, broad bean | |
| 8 | Poultry feed | Soy, corn, wheat bran, maize | Finished product storage area |
| 9 | Horses feed (West Performance) | Wheat bran, broad bean, flaked barley, carobs, maize, oat flour, molasses | |
| 10 | Flacked broad bean | Raw material | |
| 11 | Cattle feed | Maize, barley, carobs, broad bean | |
| 12 | Flaked maize | Raw material | |
| 13 | Horses feed (Superior House) | Flaked broad bean, flaked maize, flaked barley, flaked oat, flaked corn, sunflower flour | |
| 14 | Ruminants feed | Broad bean, barley flour, maize, wheat bran |
Contaminación fúngica. El aislamiento y la enumeración de colonias fúngicas realizaron utilizando una técnica de dilución en serie y placa de extensión (Maina et al. 2016). Todas las muestras se molieron en un molino hasta 0.25 mm y 1 g de cada muestra se homogeneizó en 10 mL de agua destilada esterilizada. Las muestras se analizaron por triplicado. Se inocularon partes alícuotas (0.1 mL) de diluciones en serie de diez veces en Sabouraud Dextrose Agar (SAB) y Potato Dextrose Agar (PDA) para evaluar la eficacia del medio (el mayor número de colonias). Todas las placas se incubaron a 22 ° C durante 9 días y el recuento total de hongos (UFC/g) y el porcentaje relativo de colonias de Aspergillus, Fusarium y Penicillium se evaluaron con estereomicroscopio cada 3 días. Colonias individuales de Aspergillus spp. se subcultivaron en PDA y se obtuvieron cultivos puros monoconidiales de cada cepa y se utilizaron para una caracterización adicional. Todos los aislados se mantuvieron en agar PDA en plano inclinado y se crioconservaron en glicerol al 15 % a -80°C.
Identificación morfológica de especies de Aspergillus. Las características macro-morfológicas de los aislados de Aspergillus se determinaron en PDA, SAB y Agar Czapek dox (CZ) de acuerdo con Lin y Dianese (1976) y Thathana et al. (2017). Para cada aislado de Aspergillus, los tapones del borde de las colonias puras de 7 días se tomaron con un perforador de corcho estéril de 3 mm y se colocaron individualmente en el centro de placas de 10 cm de diámetro con los tres medios diferentes, en tres repeticiones. Las placas se incubaron a 25°C durante 9 días y el diámetro, la tasa de crecimiento, el color (conidios y reverso), la forma y la textura de cada colonia se registraron cada 3 días. Se realizaron observaciones microscópicas en el microscopio Axioskop (Zeiss, Oberkochen, Alemania) acoplado a una cámara digital AxioCam MRc5 (Zeiss, Oberkochen, Alemania). Las imágenes se capturaron utilizando el software AxioVision 4.6 (Zeiss, Oberkochen, Alemania). Las características microscópicas fueron las cabezas conidiales, la forma y el diámetro de las vesículas, la presencia de metulas y el tamaño y la forma de los fialidos y las conidias (30-50 mediciones) (tabla 3). La identificación se realizó mediante claves taxonómicas (Barnett y Hunter 1972, von Arx 1981, Cole y Kendrick 1989, Pitt y Hocking 1999 y Klich, 2002).
Extracción de ADN, PCR y secuenciación. El ADN genómico se extrajo de colonias puras de los aislados de Aspergillus más recurrentes siguiendo el método basado en CTAB (Torta et al. 2015). El ADN se suspendió en 100 µL de TE 1x (0,121 g de Tris 10 mM y 0,037 g de EDTA 1 mM en 100 mL de agua destilada) cuantificado usando NanoDrop ND-1000 y almacenado a -20°C. Los cebadores ITS1F (Gardes y Bruns 1993) e ITS4 (White et al. 1990) se usaron para la amplificación de la región ITS1-5.8S-ITS2. El ensayo de PCR se realizó en un volumen de reacción total de 25 µL que consta de tampón de PCR 10X (Thermo Scientific), 0,2 mM de cada dNTPs, 0,3 µM de cada cebador, 0,5 U de ADN polimerasa Taq (Dream Taq , Thermo Scientific) y 1 µL de ADN objetivo. La amplificación se llevó a cabo en un termociclador MultiGene OptiMax (Labnet International Inc.) con un ciclo de desnaturalización inicial a 94°C durante 3 minutos seguido de 35 ciclos a 94°C durante 30 segundos, alineamiento a 55°C durante 30 segundos, elongación a 72°C durante 45 s, con una extensión final a 72°C durante 10 min.
Los productos de PCR se separaron por electroforesis en gel de agarosa al 1 % y se detectaron amplicones bajo transiluminador UV (330 nm).
Los productos de PCR se purificaron utilizando el protocolo Exo I-SAP de acuerdo con las instrucciones del fabricante (Applied Biosystems, Foster City, CA). El cebador ITS1F se usó en la reacción de secuenciación. Las reacciones de secuenciación se realizaron con BigDye Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, Foster City, CA) seguido de precipitación con etanol/EDTA/acetato de sodio (según las instrucciones del fabricante). Finalmente, la electroforesis capilar se realizó en el analizador genético 3500 (Applied Biosystems, Foster City, CA). Las secuencias se alinearon contra las ya depositadas en las bases de datos GenBank utilizando la herramienta BLASTn (Altschul et al. 1990). Se depositaron nuevas secuencias en GenBank (tabla 3).
Determinación cualitativa de la actividad celulolítica. La actividad celulolítica de los aislados de Aspergillus se realizó de acuerdo con Mandels et al. (1976) y Ghorbani et al. (2015). Las cepas se cultivaron en 10 mL de medio líquido Mandels (Mandels et al. 1976) en tubos que contenían tiras de papel Whatman No 1 de 1x6 cm y se incubaron a temperaturas de 25 y 30°C en condiciones estáticas, para evaluar el efecto de temperatura en la actividad celulolítica. El control fueron tubos no inoculados. La actividad celulolítica también se evaluó en condiciones de agitación (90 rpm) a 30°C. Después de 5, 10, 15 y 21 días, se evaluó el crecimiento de hongos y la maceración de papel utilizando una escala de calificación de 0 a 5 (0 = sin crecimiento de hongos y sin maceración; 5 = colonización completa del papel y maceración).
Análisis estadístico. Los datos sobre contaminación fúngica total se sometieron a análisis de varianza (ANOVA) a través del programa Statgraphics Plus 5.1. Los promedios se compararon mediante la prueba de comparación múltiple Fisher LSD (P ≤ 0,05).
RESULTADOS
Contaminación fúngica de muestras de pienso. Todas las muestras de pienso mostraron contaminación fúngica, y el recuento total de hongos varió dentro de las muestras y también en relación con el medio de cultivo (figura 1). Al tercer día de incubación, en PDA, se observaron colonias de hongos solo en la muestra 1 (habas en hojuelas), mientras que en SAB estuvieron presentes en 12 de las 14 muestras de pienso. A los 6 días, el número de colonias de hongos aumentó en todas las muestras tanto en SAB como en PDA. Estos valores permanecieron bastante constantes hasta el noveno día, pero en PDA la población total de hongos fue mayor que en SAB. La población total varió de 1.11x106 a 1.31x108 y de 1.11x103 a 1.58x106 UFC/g en PDA y SAB respectivamente. Se observaron diferencias estadísticamente significativas a los nueve días de incubación dentro de las muestras de pienso en ambos medios, aunque la contaminación fúngica total fue similar en las dos áreas de muestreo (tabla 2). La avena (muestra 2) y el pienso para aves (muestra 8) mostraron el nivel más alto de contaminación fúngica total en PDA y en SAB respectivamente (tabla 2). Con respecto a los posibles géneros micotoxigénicos de hongos, se obtuvieron colonias pertenecientes a Aspergillus, Fusarium y Penicillium en 3 (muestras 1, 3, 12, en PDA) y en 4 (1, 3, 11, 12 en SAB) de 14 muestras. La frecuencia de los tres géneros aislados se muestra en la figura 2. En general, Fusarium sp. fue la especie aislada prevalente (de 10 y 7 muestras, respectivamente en PDA y SAB). La Penicillia, aislada de 5 y 4 muestras en PDA y SAB respectivamente, mostró la frecuencia más baja. Sin embargo, el porcentaje de los tres géneros varió según el medio de cultivo. Las colonias de Aspergillus spp. se aislaron con mayor frecuencia en SAB, mientras que Fusarium spp. y Penicillium en PDA. Con respecto a la población total de hongos, la frecuencia de aislamiento de las colonias de Aspergillus fue de aproximadamente 10 % en ambos medios (datos no mostrados), mientras que en cada muestra el porcentaje varió de 14 a 36 % y de 1.33 a 70 % en PDA y SAB respectivamente.
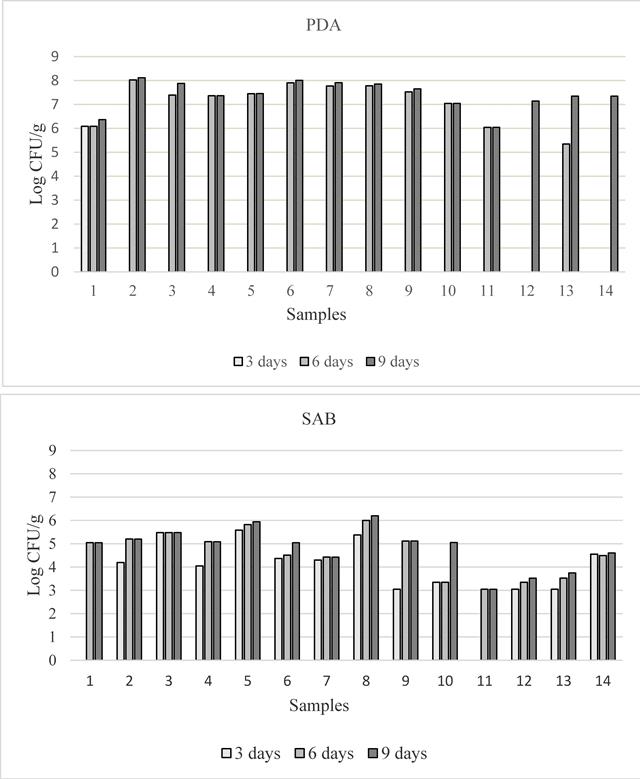
Figure 1 Total fungal contamination detected in the 14 feed samples at 3, 6 and 9 days of incubation, on PDA (above) and SAB (below)
Table 2 Total fungal contamination in the analyzed feed samples at 9 days of incubation on PDA and SAB, expressed in Log of UFC/g and relative percentage of Aspergillus colonies.
| SAMPLE | PDA | %Aspergillus | SAB | %Aspergillus |
|---|---|---|---|---|
| 1= Flaked broad bean | 6.37 + 2.28 a | 0 | 5.05 + 1.84 ab | 0 |
| 2= Oat | 8.12 + 0.39 c | 25 | 5.20 + 0,30 ab | 59 |
| 3= Poultry feed | 7.88 + 0,40 abc | 0 | 5.48 + 0.22 ab | 0 |
| 4= Flaked maize | 7.37 + 0.46 ab | 36 | 5.09 + 1.85 ab | 0 |
| 5= Swine feed | 7.46 + 0.41 ab | 31 | 5.94 + 0.08 bc | 3 |
| 6= Horses feed | 8.01 + 0.88 bc | 0 | 5.05 + 1.74ab | 0 |
| (West Performance) | ||||
| 7= Cattle feed | 7.91 + 0.17 bc | 18 | 4.43 + 0.09 a | 8 |
| 8= Poultry feed | 7.85 + 0.14 abc | 14 | 6.20 + 0.26 c | 1.33 |
| 9= Horses feed | 7.65 + 0.09 ab | 20 | 5.12 + 0.52 ab | 70 |
| (West Performance) | ||||
| 10= Flacked broad bean | 7.05 + 2.50 a | 0 | 5.05 + 1.63ab | 66 |
| 11= Cattle feed | 6.05 + 2.17 a | 0 | 3.05 + 1.17a | 0 |
| 12= Flaked maize | 7.15 + 0.59 a | 0 | 3.52 + 1.22a | 0 |
| 13= Horses feed | 7.35 + 0.66 ab | 0 | 3.74 + 1.30 a | 60 |
| (Superior House) | ||||
| 14= Ruminants feed | 7.35 + 2.50 ab | 0 | 4.60 + 1.54a | 0 |
abcdIn each column, values followed by same letters are not statistically different according to Fisher LSD Test (P≤0.05).

Figure 2 Frequency of Aspergillus, Fusarium and Penicillium isolated at 9 days of incubation on PDA (above) and SAB (below) from 14 feed samples
Identificación de Aspergillus spp. Aspergillus spp. se aislaron 8 de las 14 muestras de pienso y se seleccionaron ocho aislamientos pertenecientes a la Sección Nigri, Sección Flavi y Sección Nidulantes, en función de la frecuencia de aislamiento y de las características macro-morfológicas. Las cepas pertenecientes a la Sección Nigri presentaron colonias de color marrón oscuro a negro e inversa de color amarillo pálido o amarillo claro; los conidióforos que portaban vesículas esféricas fueron uniseriados o biseriados produciendo conidios globulares o subglobulares (lisos, finamente rugosos o rugosos). Los aislados pertenecientes a la Sección Flavi se caracterizaron por conidios maduros amarillo verdosos típicos, inverso de color amarillo claro a amarillo; principalmente conidióforos uniseriados con vesículas globulares que producen conidios globulares (lisos o finamente rugosos). Los aislados de la sección Nidulantes presentaron colonias de color amarillo pálido o amarillo e inverso, color amarillo o naranja pálido; microscópicamente presentaron conidióforos uniseriados, vesículas subglobulares, esporas rugosas subglobulares y células características de Hulle. Basado en las características morfológicas, los aislados se identificaron como Aspergillus amstelodami (L. Mangin) Thom & Church (figura 3), Aspergillus awamori Nakaz., Aspergillus flavus Link., Aspergillus niger Tiegh., Aspergillus oryzae (Ahlb.) Cohn. y Aspergillus tubingensis Mosseray (tabla 3).
Un amplicón de aproximadamente 500 a 600 pb de la región ribosómica, que incluye los dos ITS1 e ITS2 no codificantes, y el gen de ADNr 5.8S se amplificó a partir de 8 aislados de Aspergillus spp. Los aislados Apergillus spp. tuvieron una alta coincidencia con las secuencias publicadas en el GenBank mostrando identidades máximas de 99 a 100 % con secciones Nigri de Apergillus (A. awamori, A. niger, A. tubingensis), Flavi (A. flavus, A. oryzae) y Nidulantes (A. amstelodami) (tabla 3).
Table 3 Morphological features of the 8 Aspergillus spp. isolated from feed samples. T= teleomorph (sexual reproductive stage); A= anamorph (asexual reproductive stage)
| Isolates | Feed samples | Colour on PDA | Colony growth at 25°C (mm) | Stage | Conidiophores | Conidia shape | Conidia size (µm) | Vesicle size (µm) | Hulle’s cell | Species | GenBank Accession number | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PDA | SAB | CZ | ITS | ||||||||||
| SAAF 7 | 5 | Black | 55x57 | 60x65 | 66x67 | A | Biseriate | Rough | 4.6-5.7 | 55-70 | - | MK503962 | |
| SAAF 12 | 8 | Black | 83x83 | 85x85 | 85x85 | A | Biseriate | Rough | 4.5-6 | 25-40 | - | MK503964 | |
| SAAF 15 | 9 | Black | 79x81 | 80x82 | 83x84 | A | Biseriate | Rough | 4.6-5.8 | 30-45 | - | MK503966 | |
| SAAF 14 | 7 | Dark-brown | 35x36 | 32x33 | 45x47 | A | Biseriate | Smooth | 3.5-4.1 | 20-40 | - | MK503965 | |
| SAAF 10 | 12 | Black | 80x80 | 85x85 | 85x85 | A | Biseriate | Smooth | 4-6 | 40-50 | - | MK503963 | |
| SAAF 4 | 7 | Green | 67x70 | 75x75 | 83x83 | A | Biseriate | Smooth -finely rough | 3.2-5.8 | 18-36 | - | MK503960 | |
| SAAF 17 | 10 | Yellow-green | 75x75 | 80x80 | 75x75 | A | Biseriate | Smooth | 5.3-7.2 | 25-40 | - | MK503967 | |
| SAAF 6 | 2 | Yellow | 25x25 | 25x25 | 30x30 | T | Uniseriate | Rough | 4.3-6.5 | 20-25 | + | MK503961 | |
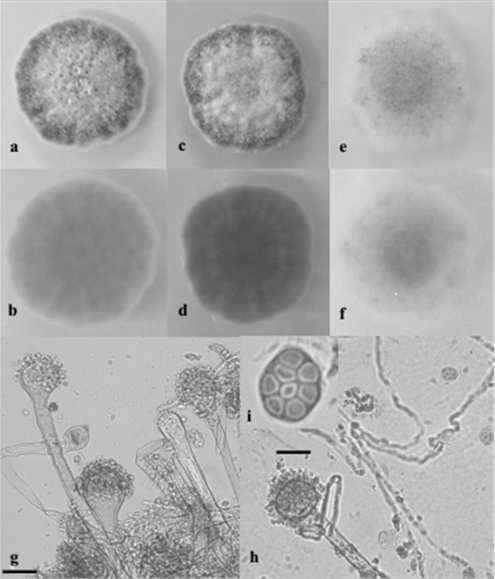
Figure 3 Macroscopic and microscopic features of A. amstelodami SAAF 6. 10 days- old colonies grown on PDA (a = F; b = R), SAB (c = F; d = R) and CZ (e = F; f = R); g, h ) Conidiophores, vesicles and conidial head; i) ascus and ascospores. F = Front, R = Reverse. Bar: g, h, = 25 µm; i = 10 µm
Determinación cualitativa de la actividad celulolítica. Todas las cepas de Aspergillus mostraron actividad celulolítica, creciendo en el papel de filtro (tabla 4). En todos los tubos de control no se alteró el papel de filtro. Las cepas A. niger SAAF 7, A. awamori SAAF 10 y A. tubingensis SAAF 14 mostraron la mayor actividad celulolítica, macerando completamente el papel al final de la prueba. Por otro lado, la temperatura pareció afectar la capacidad celulolítica. A 25 ºC, el papel de filtro generalmente estaba menos macerado, mientras que A. amstelodami SAAF 6 mostró actividad celulolítica solo a esta temperatura. La agitación indujo una maceración mayor o menor del papel de filtro dependiendo de la cepa de Aspergillus.
Table 4 Cellulolytic activity of eight Aspergillus strains, detected up to 21 days after inoculation at 25 and 30 °C in static (S) and shaking (Sh) condition.
| Strains | 25 ºC S | 30 ºC S | 30 ºC Sh | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5 | 10 | 15 | 21 | 5 | 10 | 15 | 21 | 5 | 10 | 15 | 21 | |
|
|
1 | 1 | 2 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
|
|
1 | 1 | 2 | 2 | 1 | 1 | 1 | 2 | 1 | 2 | 3 | 5 |
|
|
1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
|
|
1 | 1 | 2 | 2 | 0 | 1 | 3 | 5 | 1 | 1 | 3 | 5 |
|
|
1 | 1 | 1 | 1 | 1 | 3 | 4 | 5 | 1 | 1 | 3 | 5 |
|
|
1 | 2 | 3 | 4 | 1 | 1 | 2 | 2 | 0 | 1 | 2 | 4 |
|
|
1 | 1 | 1 | 1 | 1 | 2 | 2 | 3 | 1 | 1 | 1 | 1 |
|
|
1 | 1 | 1 | 1 | 1 | 2 | 2 | 2 | 1 | 1 | 2 | 4 |
DISCUSIÓN
En este estudio, por primera vez, se monitorearon catorce muestras de pienso recolectadas en dos áreas de muestreo en un molino en Sicilia para detectar la presencia de hongos contaminantes. El nivel de contaminaciones fúngicas en todas las muestras de pienso varió de aproximadamente de 3 a 8 Log CFU/g con la presencia recurrente de colonias que pertenecen principalmente a los géneros ubicuos Aspergillus, Fusarium y Penicillium, los principales mohos toxigénicos. Entre ellos, Fusarium fue el género predominante aislado de las muestras, seguido de Aspergillus y Penicillium, de acuerdo con los resultados de otros estudios realizados en Italia y Europa (Chadd 2004, Covarelli et al. 2011 y Gregori et al. 2013). Además, la eficacia del medio de cultivo también se probó revelando diferencias en la estimación de las poblaciones de hongos en los dos medios de agar utilizados. El PDA medio universal, que garantiza el aislamiento del mayor número de colonias de hongos, permite evaluar la población total de hongos, mientras que para evaluar la población de Aspergillus se debe preferir SAB (Krnjaja et al. 2008). Con respecto a las dos áreas muestreadas, nuestros datos no mostraron diferencias significativas, pero los niveles de contaminación fúngica total y, sobre todo, la presencia de hongos toxigénicos revelaron técnicas inapropiadas durante la cadena de producción de pienso, lo que indica baja calidad y mal tratamiento de los materiales.
Por lo general, la población de estos contaminantes fúngicos en piensos y alimentos está estrictamente relacionada con las concentraciones relativas en micotoxinas, en particular en materiales mal almacenados o exportados durante mucho tiempo (Dalcero et al. 1998, Krysinska-Traczyk et al. 2001, Gonzalez Pereyra et al. 2012 y Greco et al. 2014). Por el contrario, en materias primas sicilianas y piensos terminados para ganado, a pesar de la presencia de estos contaminantes fúngicos, estudios previos indican que los metabolitos peligrosos (toxinas afla, ochra y Fusarium) resultaron estar ausentes o detectados a bajo nivel (Finoli y Vecchio, 2003, Gallo et al. 2008 y Russo 2015). Sin embargo, el alto nivel de contaminantes fúngicos causa en los piensos y alimentos la pérdida de valor nutricional, debido a su degradación por la actividad enzimática (Driehuis and Oude Elferink. 2000, Megan et al. 2003 y Amigot et al. 2006).
Entre los hongos contaminantes, algunas especies dentro del género Aspergillus son las más críticas por su actividad micotoxigénica y celulolítica, causando un riesgo potencial para la salud animal y humana y para la degradación de la sustancia trófica (Hanif et al. 2004 y Patyshakuliyeva 2016). Se evaluó cualitativamente la producción de enzimas celulolíticas por cepas de Aspergillus aisladas de muestras de pienso analizadas. A. niger, A. tubingensis y A. awamori mostraron el nivel de expresión más alto del complejo enzimático de celulasa. Sobre esta base, los piensos de avena y para aves, los piensos para animales más contaminados, pueden haber perdido la mayor parte de su calidad organoléptica y nutricional.
Como se presenta en los resultados, la mayor actividad celulolítica se muestra en las especies de Aspergillus que forman parte de la "sección Nigri", en este caso A. niger, A. awamori y A. tubingensis, las más utilizadas a nivel industrial. Estos hongos, caracterizados por alta distribución en todo el mundo, también se consideran los hongos más comunes que ocurren en la descomposición de los alimentos (Raper y Fennell, 1965) por la producción de gran variedad de enzimas, tales como celulasas, xilanasas, proteasas y fitasas, principalmente, y también α-amilasas, pectinasas, amiloglucosidasas y lactasas (Krishna 2005 y Aguiar 2010). En cuanto al efecto de la temperatura en la actividad celulolítica de los microorganismos, se observó mayor tasa de degradación en la mayoría de los casos a 30ºC. Es necesario señalar que la temperatura es uno de los principales factores que afectan el rendimiento de la biomasa, un aspecto que está estrechamente relacionado con el tipo de microorganismo que se está probando. Cada tipo de microorganismo tiene una cierta temperatura óptima de crecimiento donde expresa su mayor productividad. Las temperaturas cercanas a esta también pueden tener un efecto similar. Varios autores proponen temperaturas óptimas para el crecimiento de diferentes especies de Aspergillus entre 25-35ºC (Passamani et al. 2014). Por otro lado, la temperatura afecta no solo el crecimiento de la biomasa sino también la producción de diferentes metabolitos. Varios autores han informado temperaturas óptimas para la producción de celulasas en especies de Aspergillus entre 30-35ºC (Bastawde 1992, Velkovska et al. 1997, Shahriarinour et al., 2011 y Saithi et al. 2016).
Por otra parte, una vez que los microorganismos han secretado sus enzimas en los medios, la actividad enzimática está condicionada por diferentes factores como el pH, la fuerza iónica, la temperatura, entre otros (Seager et al. 2016). Estos factores condicionan un rango óptimo de actividad que varía según el tipo de enzima. Aunque, en relación con la temperatura, un aumento de esta trae un aumento en la velocidad de la reacción y, en consecuencia, en la actividad enzimática (Voet et al. 2016).
Con respecto al efecto de la agitación, se observa que al final de los 21 días de experimentación, todas las cepas con agitación, excepto en el caso de A. niger, tenían mayor actividad celulolítica con respecto a aquellas sin agitación. Esto se debe, principalmente, al hecho de que los sistemas agitados permiten una mayor interacción del microorganismo con el sustrato, lo que permite mejor colonización y uso de la superficie específica del sustrato que resulta en mayor producción de enzimas. (Jeong et al. 2006).
Con respecto a la actividad micotoxigénica (no evaluada en este estudio), entre las seis especies de Aspergillus identificadas, A. niger y A. flavus se informan como agentes de micotoxicosis humana y animal, la primera asociada con la producción de ocratoxina A, y la segunda con las aflatoxinas B1 y B2 (Yu, 2012). Sin embargo, no todas las cepas de estas especies pueden metabolizar micotoxinas peligrosas. De hecho, se sabe que en las especies de A. flavus solo alrededor del 40-50 % de las cepas producen aflatoxinas y solo alrededor del 20 % de las cepas de A. niger son ocratoxigénicas (Abarca et al. 2001 y Davari et al. 2015).
Aunque la detección de hongos toxigénicos en las muestras analizadas no necesariamente indica que las micotoxinas se producen naturalmente en el pienso, estas alertan sobre el riesgo potencial de contaminación. Otras especies aisladas de muestras de piensos, como A. awamori y A. oryzae, no asociadas con la producción de metabolitos tóxicos, se utilizan en gran medida en biotecnologías alimentarias (Siedenberg et al.1998 y Takagi 2014).
CONCLUSIONES
Este primer estudio sobre la evaluación del nivel de contaminación por hongos en las materias primas y ganado sicilianos mostró la presencia de Aspergillus spp., Penicillium spp. y Fusarium spp, en los materiales muestreados. En particular, las secciones de Apergillus Nigri (A. awamori, A. niger, A. tubingensis), Flavi (A. flavus, A. oryzae) y Nidulantes (A. amstelodami) se identificaron mediante metodologías morfológicas y moleculares. Se observó la producción de enzimas celulolíticas en todas las cepas de Aspergillus, pero A. niger SAAF 7, A. awamori SAAF 10 y A. tubingensis SAAF 14 mostraron la mayor actividad de degradación.
Sobre la base de estos resultados, se supone que el pienso más contaminado por estos hongos puede ser el más degradado desde el punto de vista nutricional.
Esta investigación resalta la importancia de un monitoreo y control continuo de la contaminación por hongos en los alimentos y piensos. Deben implementarse estrategias destinadas a prevenirlos en el campo, durante el almacenamiento y en toda la cadena de producción de piensos. El control de estos contaminantes fúngicos y corregir las técnicas de producción de piensos para animales, de hecho, puede asegurar no solo alto nivel de salud del animal sino también alto nivel de calidad de los piensos, tanto en palatabilidad como en valores nutricionales.
REFERENCES
Abarca, M.L., Accensi, F., Bragulat, M.R. & Cabanes, F.J. 2001. Current importance of ochratoxin A-producing Aspergillus spp. J. Food Prot. 64 (6): 903-906. doi:10.4315/0362-028x-64.6.903. [ Links ]
Adhikari, A., Sen, M., Gupta-Bhattacharya, S. & Chanda, S. 2004. Airborne viable, non-viable, and allergenic fungi in a rural agricultural area of India: a 2-year study at five outdoor sampling stations. Sci. Total Environ. 326 (1-3): 123-141. doi: 10.1016/j.scitotenv.2003.12.007. [ Links ]
Aguiar, C.M. 2010. Hidrólise enzimática de resíduos lignocelulósicos utilizando celulases produzidas pelo fungo Aspergillus niger. PhD Thesis. Brasil: Universidade Estadual do Oeste do Paraná. [ Links ]
Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D. J., 1990. Basic local alignment search tool. J. Mol. Biol. 215 (3): 403-410. doi:1016/S0022-2836(05)80360-2. [ Links ]
Amigot, S.L., Fulgueira, C.L., Bottai, H. & Basilico, J.C. 2006. New parameters to evaluate forage quality. Postharvest. Biol. Tec. 41(2): 215-224. . doi:1016&j.pastharubio.2006.03.004 [ Links ]
Barnett, H.L. & Hunter, B.B. 1972. Illustrated genera of imperfect fungi. 3rd Ed., Burgess Publishing Co., Minneapolis, 241 p. [ Links ]
Bastawde, K.B.1992. Cellulolytic enzymes of a thermotolerant Aspergillus terreus strain and their action on cellulosic substrates. World J. Microbiol. and Biotech. 8: 45-49. doi:10.1007/BF01200683. [ Links ]
Chadd, S. 2004. Mycotoxicological challenges to European animal production : a rewiev. In: 55th Annual Meeting of the EAAP, in Adamovi M., Bočarov-Stančić A., Đorđevi N., Daković A., Adamović I. (2005): Mycotoxins in the silage-causes of creating, aftermath and protection from acting. Zbornik Matice srpske za prirodne nauke. 108: 51-57. [ Links ]
Cole, G.T. & Kendrick, B. 1989. Biology of Conidial Fungi. 1st Ed. Academic Press, New York, 486 p. [ Links ]
Covarelli, L., Beccari, G. & Salvi, S. 2011. Infection by mycotoxigenic fungal species and mycotoxin contamination of maize grain in Umbria, central Italy. Food Chem. Toxicol. 49: 2365-2369. doi: 10.1016/j.fet.2011.06.47. [ Links ]
Dalcero, A., Magnoli, C., Luna, M., Ancasi, G., Reynoso, M.M., Chiacchiera, S., Miazzo, R. & Palacio, G. 1998. Mycoflora and naturally occurring mycotoxins in poultry feeds in Argentina. Mycopathologia 141(1): 37-43. doi: 10.1023/A:1006868002985. [ Links ]
Davari, E., Mohsenzadeh, M., Mohammadi, Gh. & Rezaeian-Doloei, R. 2015. Characterization of aflatoxigenic Aspergillus flavus and A. parasiticus strain isolates from animal feedstuffs in northeastern Iran. Iran. J. Vet. Res. 16 (2): 150-155. doi:10.22099/ijvr.2015.3037. [ Links ]
Driehuis, F. & Oude Elferink, S.J.W.H. 2000. The impact of the quality of silage on animal health and food safety: A review. Vet. Q. 22 (4): 212-216. doi:10.1080/01652176.2000.9695061. [ Links ]
Finoli, C. & Vecchio, A. 2003. Occurrence of aflatoxins in feedstuff, sheep milk and dairy products in Western Sicily. Italian J. Animal Sci. 2(3) : 191-196. doi:10.4081/ijas2003.191. [ Links ]
Gallo, G., Lo Bianco, M., Bognanni, R. & Saimbene, G., 2008. Mycotoxins in durum wheat grain: hygienic-health quality of sicilian production. J. Food Sci. 73(4):42-47. doi:10.10.1111/j.1750-3841.2008.00704.X. [ Links ]
Gardes, M. & Bruns, T.D. 1993. ITS primers with enhanced specificity for basidiomycetes application to the identification of mycorrhizae and rusts. Mol Ecol. 2: 113-118. [ Links ]
Ghorbani, F., Karimi, M., Biria, D., Kariminia, A. & Jeihanipour, A., 2015. Enhancement of fungal delignification of rice straw by Trichoderma viride to improve its saccharification. Biochem. Eng. J. 101 (15): 77-84. doi:10.1016/j.bej.2015.05.003. [ Links ]
Godfray, H.C.J., Mason-D'Croz, D. & Robinson, S. 2016. Food system consequences of a fungal disease epidemic in a major crop. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1709: 371. [ Links ]
Gonzalez Pereyra, M.L., Chiacchiera, S.M., da Rocha Rosa, C.A., Sager, R., Dalcero, A.M. & Cavaglieri, L.R. 2012. Fungal and mycotoxin contamination in mixed feeds: evaluating risk in cattle intensive rearing operations (feedlots). Rev. Bras. Med. Vet. 34(4): 311-318. doi:10.1098/rstb.2015.0467. [ Links ]
Greco, M.V., Franchi, M.L., Golba, S.L.R., Pardo, A.G. & Pose, G.N. 2014. Mycotoxins and mycotoxigenic fungi in poultry feed for food-producing animals. Scientific World Journal. 1-9. doi:10.1155/2014/968215. [ Links ]
Gregori, R., Meriggi, P., Pietri, A., Formenti, S., Baccarini, G. & Battilani, P. 2013. Dynamics of fungi and related mycotoxins during cereal storage in silo bags. Food Control 30: 280-287. doi:10.1016/j.foodcont.2012.06.033. [ Links ]
Hanif, A., Yasmeen, A. & Rajoka, M.I. 2004. Induction, production, repression, and de-repression of exoglucanase synthesis in Aspergillus niger. Biores Technol. 94:311-319. doi:10.1016/j.biotech.2003.12.013 [ Links ]
Jeong, C., Chakrabarty, D., Hahn, E.J., Lee, H.L. & Paek, K.Y.. 2006. Effects of oxygen, carbon dioxide and ethylene on growth and bioactive compound production in bioreactor culture of ginseng adventitius roots. Biochem. Eng. J. 27(3): 252-263. doi:10.1016/j.2005.08.025. [ Links ]
Klich, M.A. 2002. Identification of common Aspergillus species. The Netherlands, Centralbureau voor Schimmelcultures, Utrecht, 116 p. [ Links ]
Krishna, C. 2005. Solid State Fermentation Systems - An Overview. Critical Reviews in Biotechnology., 25: 1-30. doi:10.1080/07388550590925383. [ Links ]
Krnjaja, V., Stojanovic, Lj., Cmiljanic, D., Trenkovski, S. & Tomasevic, D. 2008. The presence of potentially toxigenic fungi in poultry feed. Biotechnol. Anim. Husb. 24 (5-6): 87-93. doi:10.2298/BA0806087K. [ Links ]
Krysinska-Traczyk, E., Keicana, I., Perkowski, J. & Dutkiewicz, J. 2001. Levels of fungi and mycotoxins in samples of grain and grain dust collected on farms in Eastern Poland. Ann. Agric. Environ. Med. 8 : 269-274. [ Links ]
Lin, M.T. & Dianese, J.C, 1976. A coconut-agar medium for rapid detection of aflatoxins production by Aspergillus spp. Phytopathology, 66, 1466-69. doi:10.1094/Phyto-66-1466. [ Links ]
Maina, A., Wagacha, J., Mwaura, F., Muthomi, J. & Woloshuk, C. 2016. Postharvest practices of maize farmers in Kaiti district, Kenya and the impact of hermetic storage on populations of Aspergillus spp. and aflatoxin contamination. J. Food Res. 5(6): 53-62. doi:10.5539/jfr.v5n6p53. [ Links ]
Mandels, M., Andreotti, R. & Roche, C. 1976. Measurement of saccharifying cellulase. Biotechnol. Bioengng. Syrup. 6:21-33. doi:10.1186/1754-6834-2-21. [ Links ]
McNeil, M., Darvill, A.G., Fry, S.C. & Albersheim, P. 1984. Structure and function of the primary cell walls of plants. Annu. Rev. Biochem. 53: 625-663. doi:10.1146/annurev.bl.53070184.003205. [ Links ]
Megan, N., Hope, R., Cairns, V. & Aldred, D. 2003. Post-harvest fungal ecology : impact of fungal growth and mycotoxin accumulation in stored grain. Eur. J. Plant. Pathol. 109: 723-730. doi:10.1023/A:1026082425177. [ Links ]
Passamani, F.R., Hernandes, T., Lopes, N.A., Bastos, S.C., Santiago, W.D., Cardoso, M.D. & Batista, L.R. 2014. Effect of temperature, water activity, and pH on growth and production of ochratoxin A by Aspergillus niger and Aspergillus carbonarius from Brazilian grapes. J. Food Prot . 77(11):1947-52. doi: 10.4315/0362-028X.JFP-13-495. [ Links ]
Patyshakuliyeva, A., Arentshorst, M., Allijn, I.E. & Ram, A.F.J. 2016. Improving cellulase production by Aspergillus niger using adaptive evolution. Biotechnol. Lett. 38: 969. doi:10.1007/s10529-016-2060-0. [ Links ]
Pitt, J.I. & Hocking, A.D. 1999. Fungi and food spoilage. 2nd Ed. Aspen publication, Gaithersburg, 576 p. [ Links ]
Prasad, R., Souri, S., Sharma, A. K., Sharma, G. & Merera, C. 2016. Contaminants and toxins in foods and feeds. Int. J. Environ. Sci. Technol. 2(1): 82-89. [ Links ]
Raper, K.B & Fennell, D.I. 1965. The genus Aspergillus. Williams and Wilkins Co., Baltimore, 686 p. [ Links ]
Russo G., 2015. Progetto SISACER. Report tecnico sul monitoraggio del contenuto in micotossine in campioni di grano duro siciliano. 10.13140/RG.2.1.1579.5604. Soluzioni Innovative per la Sicurezza Alimentare nella filiera CERealicola (S.I.S.A.C.E.R.)- CUP: G63F11000560004 Ente finanziatore: Assessorato Attività Produttive della Regione Siciliana Responsabile scientifico Prof. Agatino Russo (Università degli Studi di Catania) Soggetto attuatore del monitoraggio del contenuto in Micotossine: Consorzio di Ricerca Gian Pietro Ballatore Referente scientifico per il monitoraggio delle micotossine: dott. Giuseppe Russo. [ Links ]
Seager, S., Slabaugh, M & Hansen, M. 2016. Chemistry for Today: General, Organic, and Biochemistry (9th ed.). Cengage Learning. 960p. [ Links ]
Saithi, S., Borg, J., Nopharatana, M., & Tongta, A. 2016. Mathematical Modeling of Biomass and Enzyme Production Kinetics by Aspergillus niger in Solid-State Fermentation at Various Temperatures and Moisture Contents., Journal of Microbial & Biochemical Technology. 8(2): 123-130. doi:10.4172/1948-5948.1000274. [ Links ]
Shahriarinour, M., Wahad, M.N., Ariff, A. B., Mustafa, S., & Mohama, R.. 2011. Kinetics of cellulase production by Aspergillus terreus at various levels of dissolved oxygen tension in a stirred tank bioreactor., BioResources. 6 (4): 4909-4921. [ Links ]
Siedenberg, D., Gerlach, S.R., Schugerl, K., Giuseppin, M.L.F. & Hunik, J., 1998. Production of xylanase by Aspergillus awamori on synthetic medium in shake flask cultures. Process Biochem. 33(4): 429-433. doi:10.1016/S0032-9592(97)00090-3. [ Links ]
Takagi, S., 2014. Koji mold (Aspergillus oryzae). AccessScience, McGraw-Hill Education. doi:10.1036/1097-8542.400130. [ Links ]
Thathana, M.G., Murage, H., Abia, A.L.K. & Pillay, M. 2017. Morphological characterization and determination of aflatoxin-production potential of Aspergillus flavus isolated from Maize and Soil in Kenia. Agriculture 7(10): 80. doi:10.3390/agriculture71000080. [ Links ]
Tian, C., Beeson, W.T., Iavarone, A.T., Sun, J., Marletta, M.A., Cate, J.H. & Glass, N.L. 2009. Systems analysis of plant cell wall degradation by the model filamentous fungus Neurospora crassa. Proc. Natl. Acad. Sci. U S A. 106: 22157-22162. [ Links ]
Torta, L., Lo Piccolo, S., Piazza, G., Burruano, S., Colombo, P., Ottonello, D., Perrone, R., Di Maida, G., Pirrotta, M., Tomasello, A. & Calvo, S. 2015. Lulwoana sp., a dark septate endophyte in roots of Posidonia oceanica (L.) Delile seagrass, Plant. Biol. 17(2): 505-11. doi:10.1111/plb.12246. [ Links ]
Velkovska, S., Marten, M.R., and Ollis, D. F. 1997 Kinetic model for batch cellulase production by Trichoderma reesei RUT C30., SF J. Biotechnol. 54: 83-94. doi:10.1016/S0168-1656(47)01669-6. [ Links ]
Voet, D., Voet, J. & Pratt, C. 2016. Fundamentals of Biochemistry: Life at the Molecular Level (5th ed.). Wiley. [ Links ]
Volkel, I., Schröer-Merker, E. & Czerny, C.P. 2011. The Carry-Over of mycotoxins in products of animal origin with special regard to its implications for the European Food Safety Legislation. Food Nutr. Sci. 2: 852-867. doi:10.4236/fns.2011.28117. [ Links ]
von Arx, J.A. 1981. Genera of fungi sporulating in culture. 3rd Ed. Cramer, Lichtenstein, 424 p. [ Links ]
White, T.J., Bruns, T., Lee, S. & Taylor, J.W. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: a guide to methods and application. Innis, M. A.,Gelfand, D.H., Sminsky, J. J. and White, T. J. Eds. P 315-322. doi:10.1016/B978-0-12-372180-8.50042-1. [ Links ]
Whitlow, L.W., Hagler, Jr. & Diaz, D.E. 2010. Mycotoxins in feeds. Feedstuffs. 14: 74-84. [ Links ]
Wilson, D.B .2011. Microbial diversity of cellulose hydrolysis. Curr. Opin. Microbiol. 14: 259-263. doi:10.1016/j.mib.2011.04.004. [ Links ]
Yu, J. 2012. Current understanding on aflatoxin biosynthesis and future perspective in reducing aflatoxin contamination. Toxins. 4: 1024-1057. doi:10.3390/toxins4111024. [ Links ]
Recibido: 25 de Marzo de 2019; Aprobado: 01 de Julio de 2019











 text in
text in 


