My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cuban Journal of Agricultural Science
On-line version ISSN 2079-3480
Cuban J. Agric. Sci. vol.53 no.4 Mayabeque Oct.-Dec. 2019 Epub Dec 05, 2019
CIENCIA DE LOS PASTOS
Efecto del cobre en el rendimiento fotosintético, la eficiencia simbiótica y la biosorción de rizobios asociados con el Gramo de caballo [Macrotyloma uniflorum (Lam.) Verdc.]
1Department of Botany and Microbiology, Acharya Nagarjuna University, Andhra Pradesh, India
El objetivo del presente estudio fue evaluar la capacidad de la tolerancia al cobre (Cu) en rizobios y mejorar el rendimiento fotosintético, la eficiencia simbiótica y el potencial de biosorción en rizobios inoculados en plantas de Gramo de caballo [Macrotyloma uniflorum (Lam.) Verdc.]. Cuatro cepas de rizobios HGR-4, 6, 13, 25 cultivadas en diferentes concentraciones de cobre (Cu) se inocularon individualmente en plantas de Gramo de caballo. Entre ellas, las plantas de Gramo de caballo inoculadas con la cepa HGR-4 mostraron valores de PN mejorados hasta 500 µg g-1 de concentración de Cu. La nodulación fue máxima tras la inoculación con HGR-6 a 300 µg g-1 de Cu e inoculación con HGR-4, 13 y 25 a 100 µg g-1. La cantidad de leghemoglobina fue máxima en las plantas de Gramo de caballo inoculadas con la cepa HGR-13 a 500 µg g-1 de Cu. El potencial de biosorción de la cepa HGR-6 (GQ483458 Rhizobium sp., ATCC 2336) se determinó mediante espectroscopía de absorción atómica (AA). Se demostró la máxima biosorción de Cu tanto en nódulos como en muestras de suelo. Este estudio demuestra que la rizobio tolerante a Cu, es decir, HGR-4, 6, 13 y 25, mejora el rendimiento fotosintético, la formación de vainas, la eficiencia simbiótica y el potencial de biosorción. Por lo tanto, las plantas de Gramo de caballo asociadas con rizobios podrían usarse eficazmente en la fitorremediación de suelos contaminados con metal (Cu).
Palabras-clave: Biosorción; toxicidad metálica; fitorremediación; rizobios
INTRODUCCIÓN
La contaminación de metales pesados en los suelos está muy extendida debido a las actividades humanas, agrícolas e industriales (Beladi et al. 2011); como resultado la presencia de trazos de metales pesados en los suelos agrícolas que conducen a una amenaza para la seguridad alimentaria y la salud pública (Dary et al. 2010). Esta acumulación de metales pesados conduce a la pérdida anormal de la fertilidad del suelo y actividades microbianas (Krujatz et al. 2011). Una de las condiciones ambientales estresantes es la contaminación de los suelos en los que crecen con metales como el cobre (Cu), zinc (Zn), cobalto (Co) y manganeso (Mn). Todos estos metales son esenciales para el crecimiento de las plantas y los microbios, pero a altas concentraciones son tóxicos y afectan negativamente el crecimiento microbiano y de las plantas, la nodulación y la actividad nitrogenasa de las plantas (Ahmad et al. 2012). El cobre (Cu) no es solo un metal pesado sino también un micronutriente esencial para el crecimiento y desarrollo de las plantas (Szira et al. 2014) (Thounaojam et al. 2012).
La influencia de los microorganismos del suelo en la calidad del suelo y la salud de las plantas ha recibido más atención recientemente. Estos microorganismos pueden promover la adquisición de nutrientes por parte de las plantas (Vimal et al. 2017), la mineralización de fósforo orgánico (Meyer et al. 2017) y la producción de fitohormonas (Kurepin et al. 2015) disminuye los efectos negativos del estrés ambiental. Las bacterias promotoras del crecimiento de las plantas se han utilizado ampliamente para aumentar la capacidad de las plantas huésped para tolerar y absorber metales pesados del suelo (Kamran et al.2017). Algunos microorganismos resistentes a los metales también podrían promover el crecimiento de las plantas en condiciones de estrés por metales pesados, por lo tanto, más biomasa aumenta la eficiencia de la fitorremediación.
La simbiosis leguminosa-Rhizobium se ha propuesto como una técnica prometedora para la fitorremediación de suelos contaminados debido a su actividad beneficiosa en la fijación simbiótica de nitrógeno (Jian et al. 2019). Algunos rizobios han sobrevivido bajo la contaminación por metales pesados. A pesar de su asociación simbiótica, su capacidad de fijación de nitrógeno se pierde (Broos et al. 2004). La aplicación de especies de Rhizobium tolerantes a metales pesados con la planta proporciona alta eficiencia para la fitorremediación (Dary et al. 2014). También tiene la ventaja adicional de proporcionar compuestos de N al suelo mediante la fijación biológica de nitrógeno en los nódulos de la raíz, incluso en suelos contaminados con metales (Hao et al. 2014). Esto mejora la fertilidad del suelo.
El Gramo de caballo es una leguminosa de pulso importante y se cultiva ampliamente en suelos rojo claro y grava de la India peninsular. La importancia de este cultivo es su adaptabilidad a las condiciones climáticas pobres y adversas, que no son adecuadas para otras leguminosas de pulso. Se cultiva ampliamente como una leguminosa de grano y forraje en los estados de Tamil Nadu, Karnataka, Andhra Pradesh y Orissa del sur de la India.
Los estudios actuales apuntan a analizar el efecto de la simbiosis planta-rizobia tolerante a Cu en el rendimiento fotosintético, la eficiencia simbiótica y el potencial de biosorción de las plantas de Gramo de caballo tras la inoculación con las cepas rizobianas elegidas.
MATERIALES Y MÉTODOS
El Gramo de caballo [Macrotyloma uniflorum (Lam.) Verdc.], pertenece a la especie Macrotyloma uniflorum del género Macrotyloma en la familia Fabaceae/Leguminoseae del orden Fabales en el Reino Plantae. Se obtuvieron semillas de Gramo de caballo de los campos locales de Andhra Pradesh, India, para estudios de nodulación.
Diseño experimental y tratamientos. Inoculación con cepas de rizobios cultivadas en diferentes concentraciones de cobre (Cu): El experimento se llevó a cabo durante la temporada de Kharif en el Jardín Botánico, Universidad Acharya Nagarjuna, Andhra Pradesh, India. Las semillas de Gramo de caballo se esterilizaron en la superficie con etanol al 70 % durante 3 minutos seguido de hipoclorito de sodio durante 3 minutos. Luego las semillas se lavaron en agua estéril y se secaron. La suspensión rizobial de los aislados HGR-4 (GQ483457), HGR-6 (GQ483458), HGR-13 (GQ483459) y HGR-25 (GQ483460) se cultivaron en caldo de extracto de levadura de manitol (ELM) en matraces agitados a 120 rpm a 28ºC. ± 2ºC durante 3 días (densidad celular de 6×109 células mL-1). Estas suspensiones se inocularon en plantas de Gramo de caballo. La inoculación se realizó en semillas esterilizadas que se recubrieron con las cepas de rizobios (remojando las semillas en medio de cultivo líquido durante 2 horas usando goma arábiga al 10% (peso/volumen) como adhesivo para administrar aproximadamente 109 células semilla-1). Las semillas inoculadas (20 semillas maceta-1) se sembraron en macetas de barro utilizando 2 kg de suelo esterilizado (esterilizado en autoclave a 121ºC durante 3 horas durante tres días sucesivos). Los controles se mantuvieron con semillas tratadas en agua destilada esterilizada. La tolerancia al Cu de las plantas de Gramo de caballo sin inoculación rizobial también se analizó con varios suplementos de Cu, es decir, 50, 100, 300 y 500 µg g-1 de kg-1 en suelo no esterilizado. Se mantuvieron triplicados para cada tratamiento. Las macetas se regaron cuando fue necesario y se mantuvieron por separado en condiciones de campo abierto y se les permitió crecer.
Análisis de plantas para el comportamiento fotosintético (FS) y la eficiencia simbiótica: Después de 40 días de tratamiento, se determinó la tasa fotosintética neta (FN) con un Sistema Fotosintético Portátil ADC Bioscientific, Reino Unido. Las mediciones se realizaron a concentraciones ambientales de CO2 entre las 09.00 y las 10.00 a.m. en un día de cielo despejado. Estas plantas fueron observadas para la nodulación regularmente después de que aparecieron las plántulas. Se recogieron al azar cinco plantas en cada tratamiento y se observaron las características de la nodulación, es decir, número, tamaño, forma, color, distribución de los nódulos después de 40 días de la siembra, ya que se observó previamente que la mayor nodulación de Gramo de caballo ocurrió a los 40 días.
Análisis bioquímico: Para el análisis bioquímico, se recolectaron plantas cultivadas en diferentes concentraciones de Cu, se estimó el contenido de leghemoglobina después de 40 d de la siembra (Tu et al. 1970). Se estimaron el pH del suelo, la materia orgánica, el nitrógeno total (N) (Jackson 1973) y el fósforo total (P) (Olsen et al. 1954). También se analizó la cantidad de arena, limo y arcilla presente en el suelo (Black 1965). La concentración de Cu presente en el control, así como en el suelo inoculado y las muestras de nódulos se determinaron por ICP-AAS (THERMO AAS Modelo No: ICE 3000).
Análisis estadístico: El análisis estadístico se realizó en tres réplicas para cada tratamiento. La media y el error estándar (EE) se calcularon utilizando Microsoft Office Excel 2007. Para conocer la significación estadística, todos los valores fueron analizados por ANOVA, utilizando IBM SPSS Statistics, Versión 20 (Armonk 2011). Las barras indican medias de ± EE y fueron significativas al 5 % de nivel de significancia (NDS). Valor de p <0,05.
RESULTADOS Y DISCUSIÓN
Las plantas de Gramo de caballo han mostrado cambios significativos en su tasa fotosintética neta (FN) tras la inoculación con cepas de Rhizobium cultivadas en diferentes concentraciones de Cu. Las plantas expuestas a Cu han mostrado una disminución en la FN (Ahmad et al. 2008). A 20 µM de concentración de Cu disminuyó la FN de aproximadamente 55 % sobre el control (Burzynski y Zurek 2007). Las plantas de Gramo de caballo inoculadas con la cepa HGR-6 han mostrado su FN máxima [10.44 µmol (CO2) m-2s-1] a 100 µg g-1. Las plantas inoculadas con HGR-25 también han mostrado valores máximos de FN a esta concentración. Pero, los valores fueron bajos en comparación con HGR-6 (figura 1). Las plantas inoculadas con la cepa HGR-4 tienen valores de FN mejorados con un aumento en la concentración de Cu de hasta 500 µg g-1. El CuCl2 a bajas concentraciones (0.1 mM) mejoró la tasa máxima de asimilación de CO2 en el sorgo dulce (Poor et al.2015). Las plantas inoculadas con la cepa HGR-13 han mostrado FN máxima solo a 50 µg g-1. La FN se inhibió significativamente (100 %) y se vio afectada de manera similar por dos concentraciones de Cu2 +, es decir, 0.062 y 0.33 M (González-Mendoza et al.2013). Cu ha mostrado un fuerte efecto negativo en la FN en las plantas de cebada. A 20 mg de Cu kg-1 se redujo a 56-57 % en comparación con las plantas de control (Vassilev et al. 2003). Este efecto está por debajo del 20 %. Inicialmente, el Cu destruye el ciclo de reducción de carbono fotosintético y posteriormente influye en el transporte de electrones fotosintéticos (Burzynski y Klobus 2004). Las plantas se mantuvieron (96 horas) en solución nutritiva Hoagland sin Cu, en solución Hoagland completa (Cu 0.5 µM) y en medio Hoagland con Cu de 1 a 100 µM. La ausencia y la presencia de Cu por encima de 1 µM inhibió la FN (Costa et al.2018). La FN disminuyó 24, 77 y 89 % en el tratamiento con 0.1, 1 y 3 m mol L-1 Cu en comparación con el control (Nisha et al.2016). Se muestra claramente que el Cu aumentó los valores de FN de las plantas de Gramo de caballo con la inoculación previa de rizobios.
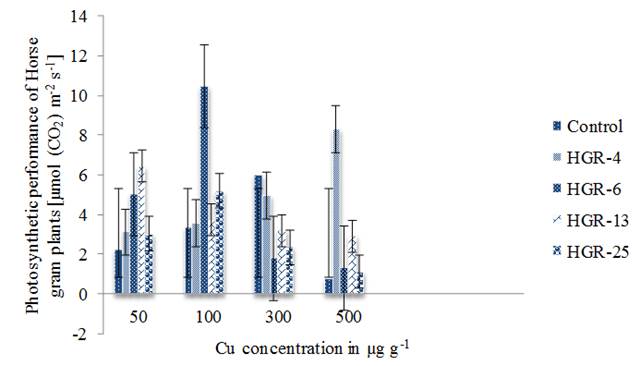
Figure 1 Copper effect on photosynthetic performance of Horse gram plants inoculated with four Rhizobium stains. Bars indicate mean ± SE. All the values were analyzed by ANOVA using IBM SPSS Statistics Version 20 and were significant at 5% level of significance (LOS). P value < 0.05.
Las cepas de rizobios de Gramo de caballo han demostrado su capacidad para formar nódulos efectivos en todas las concentraciones de metales analizadas. En nuestro estudio, se observaron nódulos después de 13 días de la siembra y se formaron tanto en la raíz principal como en las raíces laterales. El número total de nódulos formados por planta varió de 12 a 18 (figura 2). Las plantas inoculadas con la cepa HGR-6 han mostrado una nodulación máxima a 300 µg g-1. Pero, las cepas HGR-4, 13 y 25 han mostrado 100 µg g-1. Después de eso, el número de nódulos disminuyó al aumentar la concentración de Cu. Las concentraciones crecientes de Cu en solución libre de N o suelo en maceta redujeron la masa y el volumen de nódulos frescos (Sánchez-Pardo et al. 2012). El efecto adverso del Cu excesivo en la fijación biológica simbiótica de nitrógeno (FBN) ha demostrado un efecto inhibitorio del crecimiento, desarrollo y función del nódulo del microsimbionte (Stan et al. 2011) (Sánchez-Pardo et al. 2012). El Cu a 192 µM en solución nutritiva libre de N redujo el peso del nódulo junto con el número de nódulos en Lupines albus L. y Glycine max L. (Sanchez-Pardo et al. 2012). Los metales pesados a altas concentraciones reducen la eficiencia de la nodulación simbiótica con Rhizobium y también inhiben el crecimiento de las plantas (Jian et al.2019).
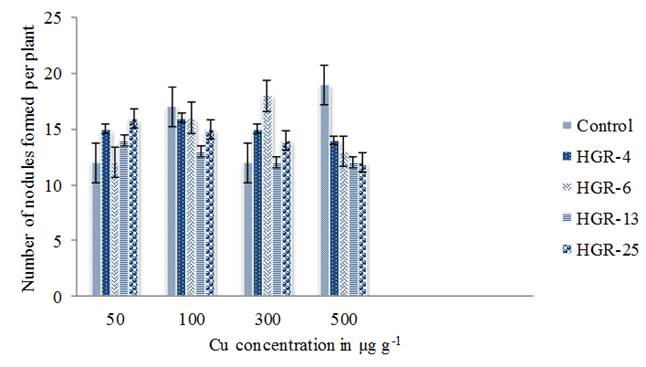
Figure 2 Nodulation of Horse gram plants inoculated with Rhizobium strains in response to Copper. Bars indicate mean ± SE. All the values were analyzed by ANOVA using IBM SPSS Statistics Version 20 and were significant at 5% level of significance (LOS). P value < 0.05.
Existen algunas variaciones en la capacidad de tolerar la toxicidad de Cu entre las asociaciones de rizobia-leguminosa. La asociación rizobia-Acacia auriculaeformis tiene mayor tolerancia a Cu2 + que la asociación Rhizobium-Lespedeza formosa (Nie et al. 2002). El exceso de Cu redujo el número de nódulos funcionales y las células infectadas en los nódulos (Hao et al. 2015). La inoculación de gramo verde con Bradyrhizobium sp. bajo estrés de Cu disminuyó el número de nódulos en 23 % a 1338 mg kg-1 del suelo, en comparación con el control (Wani et al. 2007). Los altos niveles de Cu redujeron el número de nódulos y el peso en Vigna unguiculata (Kopittke et al. 2007). El número de nódulos formados fue alto a baja concentración de Cu (50 mg kg-1) después de eso, disminuyeron al aumentar la concentración de Cu (Manivasagaperumal et al. 2011). La reducción en el número de nódulos bajo estrés de Cu también se observó en Lupin, soya y Vigna (Sanchez-Pardo et al. 2012). Los experimentos con macetas han demostrado que 400 mg kg-1 Cu2 + inhibieron en gran medida el crecimiento de la planta de Medicago lupulina, pero la doble inoculación de Sinorhizobium meliloti CCNWSX0020 y Agrobacterium tumefaciens CCNWGS0286 aumentó significativamente el número de nódulos (Jian et al.2019).
La cantidad de leghemoglobina fue máxima en las plantas de Gramo de caballo inoculadas con las cepas HGR-4, 6 y 25 a 300 µg g-1 de Cu (figura 3). Pero, las plantas inoculadas con la cepa HGR-13 han mostrado 500 µg g -1 . Cu a una concentración de 192 μM, en solución nutritiva libre de N redujo el nitrógeno total de las plantas en Lupinus albus L. y Glycine max L. (Sanchez-Pardo et al. 2012). Cu causa reducción en el contenido de proteínas del nódulo citosol, las fracciones de bacteroides y la concentración de leghemoglobina del nódulo citosol (Younis 2007). La toxicidad de Cu en la producción de leghemoglobina fue independiente de la rizobia inoculada (Hao et al. 2014). Se observó una reducción significativa en el nitrógeno total del brote cuando se aumentó el Cu de 0 a 100 mg de Cu L-1 in vitro e in vivo. En los estudios basados en suelo en macetas, el aumento de la concentración de Cu de 0-100 mg g-1 resultó en una drástica disminución en el nitrógeno total del brote de 39.2 y 36.2 % para GM3 y CP1 en comparación con 17.2 y 18.2 para PV1 y PV2 respectivamente (Hamisi Tindwa et al. 2014). La reducción en la fijación de nitrógeno bajo estrés de Cu se debe a su acumulación en la corteza interna y las zonas infectadas del nódulo induciendo anormalidades en la estructura y ultraestructura de los nódulos (Sanchez-Pardo et al. 2012). El S. meliloti CCNWSX0020 tolerante a Cu puede establecer una relación simbiótica normal con la planta hospedadora bajo estrés de Cu y la actividad de la nitrogenasa indica que ha formado nódulos efectivos bajo estrés de Cu (Jian et al.2019).
La producción de leghemoglobina fue bastante sensible al estrés del Cu en los nódulos generados por cepas mutantes y de tipo salvaje. La fijación de nitrógeno en el trébol blanco se redujo a la mitad a 428 mg Cu kg-1 (Broos et al. 2004) pero estas concentraciones estaban por encima del valor normal en Woburn para el Cu total (99 mg kg-1). Las plantas inoculadas de Medicago lupulina cultivadas en presencia de exceso de Cu han mostrado un ligero aumento en el contenido de N en brotes y raíces (Kong et al. 2015). El contenido de nitrógeno en los brotes podría considerarse como el suministro de N a través de la fijación de N en los nódulos de la raíz. La cepa S. meliloti CCNWSX0020 resistente a Cu puede sobrevivir bajo la concentración de Cu utilizada y promueve un nivel normal de nitrógeno vegetal (Kong et al. 2015). Se detectó un aumento significativo en el contenido de nitrógeno en las plantas después de la coinoculación de S. meliloti y Agrobacterium tumefaciences que aumentó significativamente el contenido de N de la porción sobre el suelo en un 19 % en comparación con el control en presencia de 400 mg kg-1 Cu2 + (Jian et al.2019). La cantidad de nitrógeno total (%) y fósforo (%) presente en el suelo es 0.85 y 1.24, respectivamente. El contenido total de materia orgánica en el suelo es 1.20, arena 18, limo 16, arcilla 42 y el pH del suelo es 6.44.

Figure 3 Leghaemoglobin content in root nodules of Horse gram plants inoculated with Rhizobium strains in response to Copper. Bars indicate mean ± SE. All the values were analyzed by ANOVA using IBM SPSS Statistics Version 20 and were significant at 5% level of significance (LOS). P value < 0.05.
Además de la fijación de nitrógeno, la rizobia resistente a los metales demuestra la producción de sustancias reguladoras del crecimiento de las plantas o los efectos sobre la solubilidad y la biodisponibilidad de los metales que afectan la absorción de los metales en la planta (Pajuelo et al. 2011). El mecanismo de bioacumulación / biosorción bacteriana junto con otras características promotoras del crecimiento de las plantas explicaron el crecimiento mejorado de la planta en suelos contaminados con metales (Zaidi et al. 2006). En este estudio, el potencial de biosorción de la cepa HGR-6 se determinó mediante Espectroscopía de Absorción Atómica (EAA), como la cantidad de metal presente en el medio después del tratamiento con el aislado. Los resultados han demostrado que el aislado fue capaz de absorber Cu a una concentración de 500 µg g-1 en nódulos de la raíz y también en muestras de suelo inoculadas con la cepa HGR-6 (figura 4 y 5). Por lo tanto, el uso de microbios para la reducción/desintoxicación de metales pesados es una de las opciones preferidas y se considera un enfoque rentable en tecnologías de remediación.

Figure 4 Metal (Cu) biosorption by the strain HGR-6 in soil determined by AAS. Bars indicate mean of ± SE. All the values were analyzed by ANOVA using IBM SPSS Statistics Version 20 and were significant at 5% level of significance (LOS). P value < 0.05.
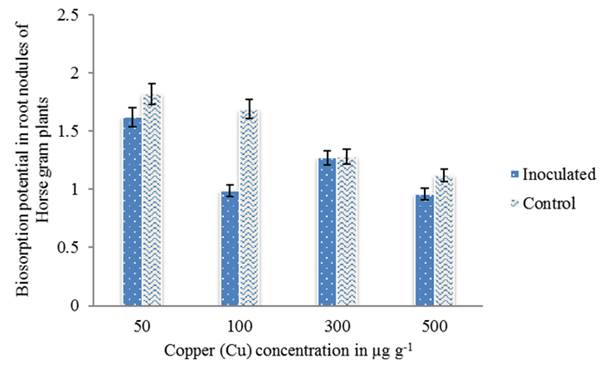
Figure 5 Metal (Cu) biosorption in root nodules of Horse gram plants inoculated with the strain HGR-6 determined by AAS. Bars indicate mean of ± SE. All the values were analyzed by ANOVA using IBM SPSS Statistics Version 20 and were significant at 5% level of significance (LOS). P value < 0.05.
Estas bacterias también pueden proteger a las plantas de los efectos tóxicos de los metales a través de un mecanismo de adsorción/desorción. La disminución en la concentración de metales después de la inoculación de rizobios sugirió el papel de la cepa RP5 en la eliminación de estos metales a través del mecanismo de adsorción-desorción (Mammaril et al. 1997). Las células muertas de Mesorhizobium amorphae CCNWGS0123 son un absorbente eficaz para la eliminación de Cu de una solución acuosa. La eliminación de Cu2 + aumentó significativamente al disminuir el pH hasta 5.0 (Mohamd et al. 2012).
Este estudio demuestra que los rizobios tolerantes a Cu, es decir, HGR-4, 6, 13 y 25, mejoraron el rendimiento fotosintético, la eficiencia simbiótica y el potencial de biosorción en las plantas de Gramo de caballo inoculadas con rizobios. Por lo tanto, las plantas de Gramo de caballo asociadas con rizobios podrían usarse en la fitorremediación de suelos contaminados con metal (Cu).
AGRADECIMIENTOS
E.P agradece a la University Grants Commission (UGC), Nueva Delhi, por su ayuda financiera en virtud de la Beca Post-Doctoral (PDF). Un sincero agradecimiento al Departamento de Botánica y Microbiología, Universidad Acharya Nagarjuna, Andhra Pradesh, India, por proporcionar un analizador fotosintético
REFERENCIAS
Ahmed, H. A.H. & Naim, S. I. 2008. Heavy metals in eleven common species of fish from the Gulf of Aqaba, Red sea. Jordan. Journal of Biological Science, 1(1): 13-18. ISSN: 1727-3048 (print); 1812-5719 (online). [ Links ]
Ahmad, E., Zaidi, A., Khan, K. S. & Oves, M. 2012. Heavy metal toxicity to symbiotic nitrogen-fixing microorganism and host legumes. In: Toxicity of heavy metals to legumes and bioremediation. pp. 29-44. ISBN: 978-3-7091-0729-4 (print); 978-3-7091-0730-0 (online). [ Links ]
Armonk, N. Y. 2011. IBM Corp. SPSS Statistics for windows, Version 20.0. In: ftp://public.dhe.ibm.com/software/analytics/spss/documentation/statistics/20.0/de/client/Manuals/IBM_SPSS_Conjoint.pdf. [ Links ]
Beladi, M., Habibi, D., Kashani, A., Paknejad, F. & Nooralvandi, T. 2011. Phytoremediation of Lead and Copper by Sainfoin (Onobrychis vicifolia): Role of antioxidant enzymes and biochemical biomarkers. American-Eurasian Journal of Agricultural and Environmental Science, 10(3): 440-449. ISSN: 1818-6769 (print); 1990-4053 (online). [ Links ]
Black, C. A. 1965. Methods of Soil Analysis. Part. 2 Chemical and biological properties. American Society of Agronomy, Madison, Wisconsin, USA. ISBN: 0-89118-072-9. [ Links ]
Broos, K., Uyttebroek, M., Mertens, J. & Smolders, E. 2004. A survey of symbiotic nitrogen fixation by white clover grown on metal contaminated soils. Soil Biology and Biochemistry, 36(4): 633-640. ISSN: 0038-0717. [ Links ]
Burzynski, M. & Klobus, G. 2004. Changes of photosynthetic parameters in Cucumber leaves under Cu, Cd, and Pb stress. Photosynthetica, 42(2): 505-510. ISSN: 0300-3604 (print); 1573-9058 (online). [ Links ]
Burzynski, M. & Zurek, A. 2007. Effects of copper and cadmium on photosynthesis in cucumber cotyledons. Photosynthetica, 45(2): 239-244. ISSN: 0300-3604 (Print) 1573-9058 (Online). [ Links ]
Costa, M. B., Tavares, F.V., Martinez, C. B., Colares, I. G. & Martins, G. M. G. 2018. Accumulation and effects of copper on aquatic macrophytes Potamogeton pectinatus L.: Potential application to environmental monitoring and phytoremediation. Ecotoxicology and Environmental Safety, 155(1): 117-124. ISSN: 0147-6513. DOI: 10.1016/j.ecoenv.2018.01.062. [ Links ]
Dary, M., Chamber-Perez, M. A., Palomeres, A. J. & Pajuelo, E. 2010. In situ phytostabilisation of heavy metal polluted soils using Lupinus luteus inoculated with metal resistant plant growth promoting rhizobacteria. Journal of Hazardous Materials, 177(1-3): 323-330. ISSN: 0304-3894. [ Links ]
González-Mendoza, D., Espaday Gil, F., Escoboza-Garcia, F., Santamaria, J. M. & Zapata-Perez, O. 2013. Copper stress on photosynthesis of Black Mangle (Avicennia germinans). Academia Brasileira de Ciencias, 85(2): 665-670. ISSN: 0001-3765 (print); 1678-2690 (online). [ Links ]
Hamisi, Tindwa, Ernest, Semu & Gottfried P., Msumali. 2014. Effects of elevated copper levels of biological nitrogen fixation and occurrence of rhizobia in Tanzanian coffee-cropped soil. Journal of Agricultural Science and Applications, 3(1): 13-19. ISSN: 2227-6475 (print); 2227-6483 (online). DOI: 10.14511/jasa.2014.030103. [ Links ]
Hao, X., Taghavi, S., Xie, P., Orbach, M. J., Alwathnani, H. A., Rensing, C. & Wei, G. H. 2014. Phytoremediation of heavy and transition metals aided by legume-rhizobia symbiosis. International Journal of Phytoremediation, 16(2): 179-202. ISSN: 1522-6514 (print); 1549-7879 (online). [ Links ]
Hao, X., Xie, P., Zhu, Y.G., Taghavi, S., Wei, G. & Rensing, C. 2015. Copper tolerance mechanisms of Mesorhizobium amorphae and its role in aiding phytostabilization by Robinia pseudoacacia in copper contaminated soil. Environmental Science and Technology, 49(4): 2328-2340. ISSN: 0013-936X (print); 1520-5851 (online). DOI: 10.1021/es504956a. [ Links ]
Jackson, M. L. 1973. Soil Chemical Analysis. Prentice Hall of India Ltd., New Delhi, India. ISBN: 0-88192-453-9. [ Links ]
Jian, L., Bai, X., Zhang, H., Song, X. & Li, Z. 2019. Promotion of growth and metal accumulation of alfalfa by coinoculation with Sinorhizobium and Agrobacterium under copper and zinc stress. Peer J, 5(7): 7.e6875. ISSN: 2167-8359. DOI: 10.7717/peerj.6875. [ Links ]
Kamran, M., Bibi, S., Xu, R., Hussain, S., Mehmood, K. & Chaudhary, H. J. 2017. Phyto-extraction of chromium and influence of plant growth promoting bacteria to enhance plant growth. Journal of Geochemical Exploration 182(2): 269-274. ISSN: 0375-6742. DOI 10.1016/j.gexplo.2016.09.005. [ Links ]
Kong, Z. Y., Glick, B. R., Duan, J., Ding, S. L., Tian, J., McConkey, B. J. & Wei, G. H. 2015. Effects of 1-aminocyclopropane-1-carboxylate (ACC) deaminase-over producing Sinorhizobium meliloti on plant growth and copper tolerance of Medicago lupulina. Plant Soil, 391(1-2): 383-398. ISSN: 0032-079X (Print); 1573-5036 (Online) doi: 10.1007/s11104-015-2434-4. [ Links ]
Kopittke, P. M., Dart, P. J. & Menzies, N. W. 2007. Toxic effects of low concentrations of Cu on nodulation of cowpea (Vigna unguiculata). Environmental Pollution, 145(1): 309-315. ISSN: 0957-4352. [ Links ]
Krujatz, F., Harstrick, A., Neortemann, B. & Greis, T. 2011. “Assessing the toxic effects of nickel, cadmium and EDTA on growth of the plant growth-promoting rhizobacterium Pseudomonas brassicacearum”. Water Air and Soil Pollution, 223(3): 1281-1293. Doi: 10.1007/s11270-011-0944-0. ISSN: 1567-7230 (print); 1573-2940 (online). [ Links ]
Kurepin, L. V., Park, M. J., Lazarovits, G. & Bernards, M. A. 2015. Burkholderia phytofirmans-induced shoot and root growth promotion is associated with endogenous changes in plant growth hormone levels. Plant Growth Regulation, 75(1): 199-207. ISSN: 0167-6903 (Print) 1573-5087 (Online). DOI 10.1007/s10725-014-9944-6. [ Links ]
Mamaril, J. C., Paner, E. T. & Alpante, B. M. 1997. Biosorption and desorption studies of chromium (iii) by free and immobilized Rhizobium (BJVr 12) cell biomass. Biodegradation, 8(4): 275-285. ISSN: 0923-9820. [ Links ]
Manivasagaperumal, R., Vijayarengan, P., Balamurugan, S. & Thiyagarajan, G. 2011. Effect of copper on growth, dry matter yield and nutrient content of Vigna radiata (L.) Wilczek. Journal of Phytology, 3(3): 53-62. ISSN: 2075-6240. [ Links ]
Meyer, G., Bunemann, E. K., Frossard, E., Maurhofer, M., Mader, P. & Oberson, A. 2017. Gross phosphorus fluxes in a calcareous soil inoculated with Pseudomonas protegens CHA0 revealed by 33P isotopic dilution. Soil Biology and Biochemistry , 104(1): 81-94. ISSN: 0038-0717. DOI 10.1016/j.soilbio.2016.10.001. [ Links ]
Mohamad, O. A., Hao, X., Xie, P., Hatab, S., Lin, Y. & Wei, G.. 2012. Biosorption of copper (II) from aqueous solution using non-living Mesorhizobium amorphae strain CCNWGS0123” Microbes Environment, 27(3): 234-41. ISSN: 1342-6311. [ Links ]
Nie, X., Lan, C., Zhang, Z., Shu, W. & Huang, M. 2002. Effects of copper on rhizobia-Acacia auriculaeformis symbiotic association. Ying Yong Sheng Tai Xue Bao, 13(2): 137-40. ISSN: 1001-9332. [ Links ]
Nisha, V. K. & Sharma, P. K. 2016. Photosynthesis in Copper mediated plant is affected due to oxidative damage caused by reactive oxygen species (ROS) generation. International Journal of Recent Scientific Research, 7(10): 14009-14115. ISSN: 0976-3031. [ Links ]
Olsen, S. R., Cole, C. V., Watanabe, F. S. & Dean, L. A. 1954. Estimation of available phosphorus in soil by extraction with sodium carbonate. 19. USDA Circular No. 939. [ Links ]
Pajuelo, E., Rodrguez-Llorente, I. D., Lafuente, A. & Caviedes, M. A. 2011. Legume-Rhizobium symbioses as a tool for bioremediation of heavy metal polluted soils. In: Biomanagement of metal-contaminated soils. Khan, M. S., Zaidi, A., Goel, R. & Musarrat, J. (eds.), 20: 95-123. ,ISBN: 978-94-007-1913-2 (print); 978-94-007-1914-9 (online). DOI: 10.1007/978-94-007-1914-9. [ Links ]
Poor, P., Ordog, A., Wodala, B. & Tari, I. 2015. Effect of EDTA-assisted copper uptake on photosynthetic activity and biomass production of Sweet Sorghum. Cereal Research Communications, 43(4): 604-615. ISSN: 0133-3720 (print); 1788-9170 (online). [ Links ]
Sánchez-Pardo, B., Fernández-Pascual, M. & Zornoza, P. 2012. Copper micro localisation, ultrastructural alterations and antioxidant responses in the nodules of white lupin and soybean plants grown under conditions of copper excess. Environmental and Experimental Botany, 84(1): 52-60. ISSN: 0098-8472. [ Links ]
Stan, V., Gament, E., Corena, C.P., Voaides, C., Dusa, M. & Plopeanu, G. 2011. Effects of heavy metal from polluted soils on the Rhizobium diversity. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 39 (1): 88-95. ISSN: 0255-965X. [ Links ]
Szira, F., Monostori, I., Galiba, G., Rakszegi, M. & Balint, A. F. 2014. Micronutrient contents and nutritional values of commercial wheat flours and flours of field-grown wheat varieties - A survey in Hungary. Cereal Research Communications , 42(2): 293-302. ISSN: 0133-3720 (print); 1788-9170 (online). [ Links ]
Thounaojam, T. C., Panda, P., Mazumdar, P., Kumar, D., Sharma, G. D., Sahoo, L. & Panda, S. K. 2012. Excess copper induced oxidative stress and response of antioxidants in rice. Plant Physiology and Biochemistry, 53(1): 33-39. ISSN: 0981-9428. DOI: 10.1016/j.plaphy.2012.01006. [ Links ]
Tu, J. C., Ford, R. E. & Garu, C. R. 1970. Some factors affecting the nodulation and nodule efficiency in Soy beans infected by Soy bean mosaic virus. Phytopathology, 60(11): 1653-1656. ISSN: 0031-949X (print); 1943-7684 (online). DOI: 10.1094/Phyto-60-1653. [ Links ]
Vimal, S. R., Singh, J. S., Arora, N. K. & Singh, S. 2017. Soil-plant-microbe interactions in stressed agriculture management: a review. Pedosphere, 27(2): 177-192. ISSN: 1002-0160. DOI: 10.1016/S1002-0160(17)60309-6. [ Links ]
Vassilev, A., Lidon, F., Ramalho, J.C., Dp Ceu Matos, M. & Gracam, D.A. 2003. Effects of excess Cu on growth and photosynthesis of Barley plants. Implication with a screening test for Cu tolerance. Journal of central European Agriculture, 4(3): 225-236. ISSN: 1332-9049. [ Links ]
Wani, P. A., Khan, M. S. & Zaidi, A. 2007. Cadmium, chromium and copper in green gram plants. Agronomy for Sustainable Development, 27(2): 145-153. ISSN: 1774-0746. [ Links ]
Younis, M. 2007. Response of Lablab purpureus-Rhizobium symbiosis to heavy metals in pot and field experiments. World Journal of Agricultural Science, 3(1): 111-122. ISSN: 1817-3047. [ Links ]
Zaidi, S., Usmani, S., Singh, B. R. & Musarrat, J. 2006. Significance of Bacillus subtilis strain SJ-101 as a bioinoculant for concurrent plant growth promotion and nickel accumulation in Brassica juncea. Chemosphere, 64(6): 991-997. ISSN: 0045-6535. DOI: 10.1016/j.Chemosphere.2005.12.057. [ Links ]
Recibido: 22 de Noviembre de 2018; Aprobado: 26 de Junio de 2019











 text in
text in 


