INTRODUCCIÓN
Las anomalías congénitas se definen como todas aquellas alteraciones estructurales presentes en el momento del nacimiento y originadas por un desvío del desarrollo embriofetal normal. Su estudio sistemático recibe la denominación de teratología, término que inicialmente se refería solamente a las malformaciones anatómicas macroscópicas. Sin embargo, las definiciones actuales se han extendido para incluir anomalías del desarrollo más sutiles como el retraso del desarrollo intrauterino, alteraciones conductuales, muerte intrauterina y otras deficiencias funcionales (Lane y Aucker, 2009; Barrow, 2013).
La teratología ostenta un lugar histórico en el desarrollo de pruebas preclínicas normativas, desde que en 1950 la compañía alemana Chemie-Grünenthal lanzara la talidomida, un fármaco que desató una "epidemia de malformaciones congénitas", que afectaba principalmente las extremidades. Este hecho tuvo una enorme influencia sobre la formulación de la industria farmacéutica como la conocemos hoy, y desde entonces miles de sustancias teratogénicas han sido descubiertas (Barrow, 2013).
Como consecuencia, aparecieron multitud de regulaciones que exigían el desarrollo de pruebas que permitieran asegurar que un fármaco podía ser usado durante la gestación sin consecuencias negativas, para lo cual se establecieron los estudios de potencial teratogénico. Tales estudios requieren amplios conocimientos de teratología, sustentados sobre la base de la anatomía, la embriología y la anatomía patológica. El objetivo de esta revisión es puntualizar aspectos generales sobre los mecanismos de producción de anomalías congénitas y los elementos a tener en cuenta para su detección e interpretación en ensayos preclínicos.
Generalidades
Parte del éxito de la supervivencia de los embriones y fetos durante su desarrollo depende de que cuenten con la información genética adecuada y un ambiente óptimo, sin influencias lesivas. Ante alteraciones en el material genético o la presencia de agentes nocivos, es probable que ocurran alteraciones en el desarrollo o defectos congénitos. Algunos ocasionan la muerte embrionaria o fetal, mientras que otros no son diagnosticados sino hasta el nacimiento y muchos no se reconocen en los neonatos. Por ejemplo, solo la mitad de los casos de hidrocefalia y solo el 6 % de las estenosis de píloro se detectan al nacer (Rojas y Walker, 2012).
Las anomalías congénitas suelen desarrollarse en la etapa embrionaria (momento de mayor susceptibilidad, sobre todo durante la organogénesis) y por tanto se excluyen las malformaciones posteriores al nacimiento, provocadas por fuentes externas como traumatismos, así como los daños producidos por afecciones infecciosas que se establecen una vez que el órgano ya se ha formado. Por ejemplo, un animal puede nacer con hepatitis y su hígado presentar las lesiones características. Se hablará entonces de una enfermedad fetal o una lesión fetal (Barrow, 2002).
A los efectos interpretativos de la gravedad de una anomalía determinada, resulta importante determinar si esta constituye una variación o una malformación. Las malformaciones provocan casi unívocamente efectos adversos para la supervivencia y la salud, por ejemplo, la ectopia cardiaca; mientras que las variaciones se definen como un cambio que ocurre dentro del rango de normalidad de la población y es poco probable que causen afecciones, como en el caso de las costillas supernumerarias o la polidactilia (Hofmann et al., 2016).
Mecanismos de acción teratogénicos
Los efectos adversos como resultado de la exposición a teratógenos incluyen muerte embrionaria o fetal, defectos estructurales, perturbaciones del crecimiento fetal y alteraciones funcionales. Morgan et al. (2016) y Haroun (2017) refieren que entre los teratógenos reconocidos se encuentran algunos virus (por ejemplo, los virus de la peste porcina clásica y la diarrea viral bovina), protozoos (Toxoplasma spp.), factores ambientales (altas temperaturas, radiación), químicos (mercurio, alcohol) y medicamentos terapéuticos (inhibidores del sistema renina-angiotensina, talidomida, isotretinoína, warfarina, ácido valproico, carbamazepina).
Un defecto congénito en particular puede ser causado por muchos factores diferentes (alteraciones genéticas, agentes ambientales, medicamentos, condición física de la madre) así como por diferentes mecanismos, mientras que un proceso patológico específico puede ofrecer diferentes resultados en dependencia de factores tales como la edad del embrión o feto al momento de la exposición, la dosis del teratógeno, la duración del periodo de exposición y la susceptibilidad genética (van Gelder et al., 2010). Se estima que el 10 % de las anomalías son atribuibles a factores ambientales, el 25 % a factores genéticos y el 65 % a causas desconocidas, probablemente multifactoriales (Rojas y Walker, 2012).
Los mecanismos mediante los cuales esos factores pueden alterar el desarrollo normal de un embrión son los mismos que determinan la embriogénesis, solo que desviados por la intervención del agente teratogénico. Se describen básicamente cinco: inducción, diferenciación celular, muerte celular, crecimiento y motilidad celular (Noden y Lahunta, 1990). Van Gelder et al. (2010) actualizan y amplían estos mecanismos, definiendo los siguientes seis: antagonismo del ácido fólico, disrupción de las células de la cresta neural, disrupción endocrina, estrés oxidativo, disrupción vascular y teratogénesis de receptores específicos o mediados por enzimas.
El mecanismo de inducción puede fallar de dos maneras, por carencia o por exceso. Ante una ausencia de inducción el nuevo órgano no se forma y tiene lugar una agenesia, mientras que cuando esta es incompleta puede ocurrir que el órgano inducido solamente inicie su desarrollo, siendo así una estructura parcial y dando lugar a una disgenesia. Por ejemplo: normalmente, la notocorda ejerce un efecto inductor sobre el ectodermo suprayacente, causando su transformación en neuroectodermo. Si está ausente la acción inductora de la notocorda en el extremo cefálico del embrión, se producirá agenesia encefálica o anencefalia, una malformación letal caracterizada por la ausencia del cráneo y ambos hemisferios cerebrales. Por otro lado, si el órgano o estructura inductora ejerce su acción de manera exagerada o se presenta por duplicado, se produce una duplicación del órgano inducido (Vetpraxis, 2009; Marsa et al., 2015).
Son frecuentes las anomalías provocadas por fallas en el mecanismo de muerte celular programada (apoptosis). El fenómeno se observa comúnmente en conductos, cuya luz permanece obliterada durante la etapa embrionaria, debido a la multiplicación de sus células de revestimiento interno (Espinosa, 2014). Normalmente, ocurre la apoptosis de estas células y la luz del conducto reaparece, pero en su ausencia se produce una malformación denominada atresia. Por otro lado, si el proceso es incompleto el conducto presentará un estrechamiento denominado estenosis. Por ejemplo: la luz del tubo intestinal de los embriones presenta áreas cerradas por la proliferación celular, que se reabren conforme avanza la gestación. Si la reapertura no ocurre se genera una atresia intestinal, y si la apertura es incompleta, una estenosis intestinal (Díaz et al., 2016).
Otra causa importante de malformaciones congénitas es el estrés oxidativo, el cual está involucrado en la patogenia de un amplio espectro de defectos, incluidas las malformaciones esqueléticas, defectos en las extremidades, labio/paladar hendido y anomalías cardiovasculares. Este fenómeno consiste en un desbalance entre la generación de especies reactivas de oxígeno (ERO) y los mecanismos de defensa antioxidantes celulares, y tiene como consecuencia la oxidación irreversible de ADN, proteínas y lípidos, que conduce a la inactivación de muchas enzimas y a la muerte celular (van Gelder et al., 2010).
El embrión en desarrollo es especialmente susceptible a los altos niveles de ERO debido a sus débiles defensas antioxidantes, particularmente en los estadios tempranos de la organogénesis, a pesar que las enzimas placentarias tienen un rol en la protección contra el estrés oxidativo. Se conoce que existen varias drogas inductoras de estrés oxidativo como mecanismo teratogénico principal, entre ellas la talidomida, el ácido valproico y algunos suplementos de hierro, aunque también se ha demostrado en estudios con animales que la hipoxia seguida de reperfusión es alta productora de ERO y, en consecuencia, teratogénica (Foster et al., 2008).
En muchas ocasiones, el componente genético resulta decisivo para la presentación de anomalías congénitas. La determinación de este factor como origen del trastorno es difícil de establecer, principalmente porque se presentan manifestaciones fenotípicas diversas, que en ocasiones aparentan no estar relacionadas. Pese a esto, multitud de estudios han permitido establecer que el mecanismo de acción puede ser por interacción de uno o varios genes, siempre acompañado de un efecto decisivo de las condiciones ambientales. Tal es el caso de los defectos del tubo neural (DTN), que constituyen un grupo común de anomalías del sistema nervioso central. Surgen cuando el tubo neural, precursor embrionario del cerebro y la médula espinal, fracasa en cerrarse durante la etapa de la neurulación. Los dos tipos más importantes de DTN son la espina bífida (cierre incompleto de la columna vertebral) y la anencefalia (ausencia total o parcial del cerebro) (van Gelder et al., 2010; Rojas y Walker, 2012).
Defectos de la pared abdominal
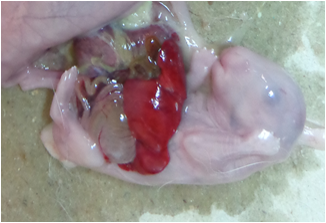
Los defectos de la pared abdominal son algunas de las anomalías congénitas más comunes. Entre ellos, la gastrosquisis y el onfalocele son dos de los más frecuentes en neonatos. La primera se caracteriza por la protrusión de los órganos abdominales a través de un pequeño orificio, usualmente al lado derecho del ombligo (Fig. 1). Su frecuencia natural de presentación en biomodelos, evaluada por varios autores en conejos Nueva Zelanda Blanco y Japanese White, oscila entre 0,08 y 1,1 % (Rorije et al., 2012; Kawamura et al., 2012; Allais y Reynaud, 2013).
La etiología de la gastrosquisis está sujeta a debate. La idea más común apoya la patogénesis ocurrida en el útero como un accidente vascular, y a partir de aquí se plantean dos teorías: La primera sugiere una involución de la vena umbilical, causada por la necrosis de la pared abdominal al lado derecho del defecto. La segunda teoría propone una involución prematura de la arteria vitelina causada por la fragilidad de la pared abdominal, con la consecuente ruptura y evisceración del contenido. Ambas se sustentan en las observaciones de atresia intestinal asociada a gastrosquisis, que se vinculan a la etiología isquémica (Cáceres et al., 2012).
Otros autores establecen que se origina por una debilidad abdominal, que produce una hernia al lado del cordón umbilical secundaria a un defecto muscular en la integración mesenquimatosa, o a una isquemia (Díaz et al., 2016). Sin embargo, es probable que tanto esta como las variantes anteriormente mencionadas desemboquen en el mismo trastorno.
Anatómicamente, se encuentra el cordón umbilical a la izquierda del defecto de la pared abdominal (la gastrosquisis del lado izquierdo es muy rara), con una sección de piel sana entre ambos. El músculo recto (situado por fuera del defecto) es normal y las asas intestinales herniadas no están recubiertas por peritoneo, sino que están engrosadas, adheridas sobre sí mismas y cubiertas por una espesa cáscara fibrosa, con zonas de infarto (Campos Lozada y Sánchez, 2004).
El onfalocele, por su parte, constituye cerca del 40 % de los defectos de la pared abdominal diagnosticados. Se caracteriza por un gran orificio localizado en la línea media, a través del cual sobresalen los órganos abdominales recubiertos por un saco membranoso, aunque excepcionalmente este puede romperse. Su diámetro puede variar, desde una pequeña hendidura hasta grandes defectos que afectan incluso la cara anterior del tórax y la pelvis (Christison-Lagay et al., 2011).
Su incidencia oscila alrededor de 1 en 4 000, aunque se conoce que muchos fetos con esta malformación no llegan a término. Este defecto es atribuido a una falla en el retorno de las asas intestinales a la cavidad abdominal, después de la rotación y herniación fisiológica en el cordón umbilical. Se diferencia macroscópicamente de la hernia umbilical en que esta última presenta las asas intestinales recubiertas por piel, no una membrana transparente (Makris et al., 2009; Cáceres et al., 2012).
Pérdida embrionaria y fetal
Aunque no son malformaciones ni defectos orgánicos, la pérdida embrionaria y fetal son unos de los efectos más graves de los agentes teratogénicos.
La ocurrencia de mortalidad embrionaria suele acompañarse de reabsorción, que si ocurre de forma tardía deja evidencias morfológicas que pueden utilizarse como elemento diagnóstico. Se observarán puntos oscuros en la mucosa uterina, que se corresponden con los sitios de implantación. Cuando la reabsorción es tardía, sobre estos puntos pueden identificarse fácilmente los restos embrionarios de los placentarios; mientras que cuando la reabsorción es muy temprana dichos sitios solo serán visibles después de sumergir el útero en sulfato de sodio (Buschmann, 2013; Pérez, 2014).
La muerte fetal puede ser observada de diferentes maneras, de las cuales las más comunes son la momificación fetal, la maceración fetal y el aborto (Daniels y Marley, 2008). La momificación fetal se define como la retención de un feto muerto, mientras el útero conserva un estado aséptico. Este feto se va deshidratando progresivamente y se observará disminuido de tamaño, de aspecto seco y con un color marrón o negruzco que le da la piel un aspecto similar al cuero; además el útero envuelve firmemente al feto momificado (Voglemann et al., 2008; Urbano, 2010). La maceración fetal se diferencia de la anterior en que el feto muerto atraviesa un proceso de putrefacción, debido a la entrada de bacterias en el útero. Por lo general la evidencia morfológica son los huesos del feto, aunque si se produce de manera temprana, los productos de la maceración pueden ser expulsados en forma de un escaso exudado purulento.
El aborto, definido como la expulsión del feto antes de que finalice el periodo de gestación (Cruz y Moreno, 2015), es un fenómeno observado con frecuencia cuando existe exposición a teratógenos que inducen malformaciones letales. Dado que puede tener lugar varios días después de la muerte del feto, el mismo presentará cierto grado de autolisis.
Estudios de teratogenicidad
Varios episodios, como el de la talidomida, demostraron con creces la necesidad de ensayar en animales de laboratorio todos los medicamentos antes de utilizarlos en seres humanos, sobre todo cuando los pacientes potenciales son mujeres embarazadas. De aquí surge la reglamentación de realizar estudios de detección de teratogenicidad en biomodelos, que avalen o descrediten la seguridad del fármaco (Barrow, 2002).
Deben usarse obligatoriamente dos especies, una roedora (preferiblemente la rata) y una no roedora (como el conejo). El conejo tiene diferente placenta y fisiología del embarazo que los roedores y, por poner un ejemplo, presenta reducción de extremidades ante la talidomida, al contrario que la rata (Wise, 2013).
Estos estudios tienen como objetivo identificar efectos letales o de otro tipo en el feto o la madre. El tratamiento de las madres se realiza al menos desde la implantación hasta el sacrificio un día antes del parto. Se cuentan los fetos, las reabsorciones y muertes fetales, el peso fetal (que es muy sensible) y se estudia detalladamente la morfología externa, visceral y esquelética. Se considera que las manifestaciones de teratogenia más relevantes en estos casos son la muerte embrionaria o fetal, las alteraciones del crecimiento y los defectos estructurales (de Miguel et al., 2010).
Análisis de toxicidad sobre las madres y examen externo de la morfología fetal
En ocasiones la aparición de anomalías congénitas no es el resultado de la acción directa del teratógeno sobre los embriones o fetos, sino que tienen su origen en un efecto tóxico de este sobre la madre, lo cual influye adversamente sobre los organismos en desarrollo. Se ha encontrado relación entre este fenómeno y varios trastornos (paladar hendido, malformaciones en las costillas, peso fetal disminuido, incremento de la mortalidad fetal), por lo que resulta de gran importancia que en los estudios convencionales de teratología se realicen pruebas que permitan determinar su ocurrencia. La toxicidad materna se observará, por lo general, en forma de reducciones significativas en la ingesta y la ganancia de peso (indicador más común y significativo), aparición de efectos adversos sobre la salud u ocurrencia de mortalidad (Rogers et al., 2005; Danielsson, 2013).
Por otro lado, la realización de un examen externo de la morfología fetal resulta de gran importancia, pues permite evaluar tres de las más importantes manifestaciones de teratogenicidad: la ocurrencia de muerte fetal, la presencia de malformaciones y las alteraciones del crecimiento. En esta etapa del estudio se tienen en cuenta, además de los hallazgos evidentemente significativos, otros que permiten determinar efectos teratogénicos más complejos. Por ejemplo, se considerará relevante la aparición de tamaños de camada pequeños acompañados de bajo peso fetal, cuando lo normal es que ambos factores sean inversamente proporcionales (Buschmann, 2013; Wise, 2013).
Evaluación de la morfología esquelética y visceral fetal
El examen de las anormalidades esqueléticas y viscerales en los fetos facilita la detección de cambios relacionados con la administración de compuestos químicos. Entre los diversos métodos de laboratorio a los que se recurre para este fin, se encuentran dos de amplia aceptación y uso: la transparentación de tejidos y posterior tinción con rojo de alizarina para el examen esquelético (también denominada diafanización) y el tratamiento con solución de Bouin para la observación visceral (Hofmann et al., 2016).
La técnica de transparentación para evidenciar cartílago y esqueleto ha sido empleada desde los años 70. Esta consiste básicamente en la digestión de los músculos mediante tripsina u otros compuestos y la tinción del esqueleto usando rojo de alizarina sobre especímenes previamente fijados en formol (Cortés et al., 2009). Dicha técnica puede emplearse para estudiar los huesos en diferentes etapas del desarrollo, en busca de anormalidades, y es un requerimiento prácticamente obligatorio en estudios con ratas, ratones, conejos y cerdos miniatura (Reynaud y Jocteur-Monrozier, 2013).
La diafanización consta de las siguientes etapas: fijación inicial, impregnación, corrosión, transparentación y conservación final. La fijación tiene como objetivo frenar la descomposición de la muestra y evitar la retracción del tejido. La sustancia fijadora más usada es el formaldehido, aplicado mediante inyección intravascular, infiltración o inmersión. Luego de la impregnación con rojo de alizarina se realiza la corrosión de barrera superficial mediante una solución de hidróxido de potasio (KOH) al 2 % en agua, con el objetivo de eliminar toda la epidermis. Este proceso provoca de forma gradual la transparentación de los tejidos blandos, de modo que queda visible solamente el esqueleto teñido de rojo. Finalmente, la muestra se conserva inmersa en glicerina (Rivera et al., 2015).
Los estudios en los que se ha aplicado la tinción de fetos han resultado de gran utilidad para el análisis de anomalías esqueléticas causadas por agentes xenobióticos con actividad patógena. Además, esta técnica ha permitido la observación rápida y detallada del esqueleto sin necesidad de recurrir a tecnologías más costosas, como los rayos X. Asimismo, pueden resultar útiles para detectar patrones importantes en el establecimiento de relaciones filogenéticas, así como para estudios de anatomía comparada, ontogénica y evolutiva (Menegola et al., 2001; Schneider, 2013)
Las alteraciones esqueléticas más frecuentes y significativas se encuentran en el cráneo, la columna vertebral, las costillas, el esternón y las extremidades. Además, cuando los fetos se someten a tinción con rojo de alizarina, las alteraciones en los huesos pueden ser vistas en la forma de tres eventos: deficiencias en la homogeneidad, reducción en la densidad y reducción del área teñida (Quallio et al., 2010).
Es frecuente encontrar variaciones esqueléticas relacionadas con osificación retardada de huesos del cráneo (Fig. 2), hioides, vértebras y esternebras, lo cual se considera asociado a la adaptación del sistema óseo para facilitar la expulsión. Esta interpretación se encuentra respaldada por el hecho de que dichas variaciones son corregidas después del nacimiento, aunque de forma lenta (Solecki et al., 2013).
El análisis visceral de los fetos, por su parte, puede llevarse a cabo a través de diferentes métodos, entre ellos la microdisección, la micro-tomografía computarizada y el seccionamiento seriado posterior a la fijación en solución de Bouin. Este último, también denominado técnica modificada de Wilson, es uno de los más utilizados debido a su sencillez, eficiencia y bajo costo (Critchell, 2013; Leroy y Jocteur-Monrozier, 2013).
La solución de Bouin es un compuesto fijador utilizado en histología. Se compone de ácido pícrico, ácido acético y formaldehído en una solución acuosa. Su capacidad fijadora se basa en la acción del ácido pícrico, que provoca precipitación de moléculas, y del formaldehído, que forma entrecruzamientos entre las proteínas del tejido. El ácido acético en este fijador lisa los glóbulos rojos y disuelve pequeños depósitos de hierro y calcio en el tejido (Carson y Hladik, 2009).
Luego de procesar las muestras con la solución se procede a su seccionamiento serial para el examen de los tejidos blandos (Fig. 3). Critchell (2013) refiere que esta técnica ofrece como ventajas que no es destructiva (al contrario de otras como la microdisección visceral en fresco), la fijación es rápida y facilita el examen de estructuras internas complejas como la cabeza. No obstante, también presenta desventajas, puesto que consume mucho tiempo y depende de un elevado nivel de preparación por parte del personal.
Uno de los hallazgos más comunes cuando se aplica esta técnica es la ventriculomegalia fetal. Esta anomalía constituye una variación, y su prevalencia oscila entre 0,3 y 22 por cada 1 000 nacidos vivos (Aydin et al., 2013; Ferreira et al., 2014). Del mismo modo, resultan frecuentes malformaciones como la microftalmia, la palatosquisis y la hernia diafragmática (Critchell, 2013).
Interpretación de los resultados de los estudios
El modo en que se interpretan los resultados de estudios de este tipo puede variar en dependencia del producto que se evalúa, aunque existen puntos comunes. Por ejemplo, Gutiérrez et al. (2012) consideran que no existen efectos teratogénicos cuando ningún animal muere durante el tratamiento o manifiesta signos indicativos de toxicidad, no se modifica el consumo de alimentos ni la ganancia de peso corporal y no se aprecian diferencias estadísticamente significativas entre el grupo control y los animales tratados respecto al número de cuerpos lúteos, sitios de implantación, reabsorciones y fetos vivos. Asimismo, el examen de los fetos no debe revelar una proporción de defectos superior a la de los grupos controles, tanto en el examen externo como en el visceral y esquelético (Barrow y Reynaud, 2013).
Un aspecto de gran importancia durante la interpretación es la clasificación de los hallazgos. Por ejemplo, las malformaciones se definen como cambios permanentes que en su gran mayoría afectan la salud o la calidad de vida futura, mientras que las variaciones tienden a desaparecer con el tiempo y suelen ser benignas (Hofmann et al., 2016). Sin embargo, a veces resulta difícil establecer si un cambio es realmente permanente, dado que es infrecuente que se dé seguimiento al destino y evolución de las anomalías prenatales. Por otro lado, existen alteraciones que han sido confirmadas como permanentes (huesos parietales accesorios, separación de los huesos frontales), pero que igualmente pueden clasificarse como variaciones debido a la elevada incidencia espontánea que presentan y su carencia de efecto sobre el desarrollo postnatal (Cahoud et al., 2015).
Varios autores han esclarecido este aspecto a través de una armonización de términos y definiciones. Se refiere, por ejemplo, que las alteraciones estructurales de la columna vertebral más comúnmente observadas (vértebras ausentes, supernumerarias o fusionadas) son permanentes y por consiguiente se consideran malformaciones, mientras que la mayoría de las alteraciones en la osificación (que son observadas con mucha frecuencia en estudios toxicológicos) se clasifican como variaciones dado que se espera tenga lugar una osificación postnatal (Makris et al., 2009; Solecki et al., 2015; Hofmann et al., 2016).
Igualmente, ha sido demostrado que las costillas supernumerarias completas son estructuras permanentes y en consecuencia se consideran malformaciones, mientras que las rudimentarias tienden a la desaparición postnatal, y por tanto se clasifican como variaciones (Foulon et al., 2000). Respecto a las variaciones viscerales, probablemente la más común sea la ventriculomegalia fetal, cuya significación varía desde nula y completamente reversible, hasta grave con implicaciones de hidrocefalia (Kaiser Permanente, 2009; Aydin et al., 2013).
La identificación de la gravedad de las anomalías y la determinación de su significación mediante métodos estadísticos son de suma importancia en los ensayos de teratogénesis, pero no son los únicos elementos que deben tenerse en cuenta para formular un diagnóstico. Por ejemplo, la presentación de malformaciones adquiere mayor relevancia cuando se observa en fetos de varias camadas dentro de los grupos tratados. Esta consideración se adopta para evitar interpretaciones influenciadas por el “efecto camada”, que consiste en la tendencia de los fetos de una camada determinada a exhibir un fenotipo y sensibilidad semejantes entre sí, dado que son genéticamente similares y están expuestos a las mismas condiciones ambientales en el útero materno (Mylchreest y Harris, 2013). Por tanto, hallazgos similares en una única camada pueden ser considerados preocupaciones menores.
Asimismo, debe considerarse que ciertas anomalías, como las variaciones esqueléticas pueden alcanzar frecuencias muy elevadas en algunas poblaciones, sin que ello signifique que su aparición está sujeta a la acción de un teratógeno. Un ejemplo de esto lo constituye la osificación incompleta, que como se mencionó anteriormente es un hallazgo bastante común. Quallio et al. (2010) refieren que este defecto solo es relevante cuando se presenta en los huesos de la extremidad posterior (tarsos, metatarsos y falanges), o en las vértebras sacras, ya que no existe relación entre estos y la expulsión del feto. Solecki et al. (2001) añaden que la presencia de solamente un hueso pobremente calcificado en el esqueleto es insuficiente, y puede conducir a errores de interpretación cuando se quiere relacionar el fenómeno con la administración de una sustancia determinada.
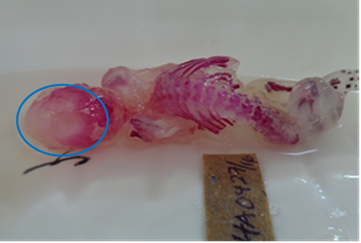
Figura 2 Feto de conejo teñido con rojo de alizarina, con pobre osificación de los huesos del cráneo. Cortesía del laboratorio de toxipatología, CIGB.
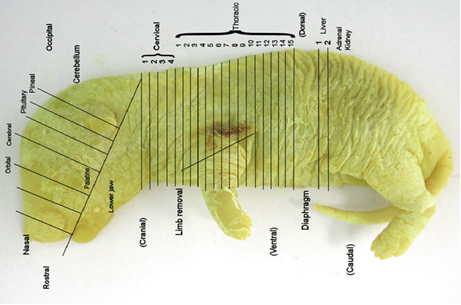 Fuente: Critchell (2013).
Fuente: Critchell (2013).Figura 3 Esquema para el seccionamiento serial de un feto de rata fijado en Bouin.
CONCLUSIONES
Los mecanismos generales para la producción de anomalías congénitas constituyen desviaciones del desarrollo embriofetal normal, siendo algunos de los más comunes los excesos o defectos de inducción, los fallos en el proceso de apoptosis y la ocurrencia de disrupciones vasculares. Para detectar la ocurrencia de anomalías congénitas en ensayos preclínicos, se requiere una observación detallada de los fenómenos y la habilidad de discernir entre los hallazgos que son significativos -y por tanto relacionados con la administración del producto evaluado- y los que constituyen variaciones comunes para el biomodelo utilizado.