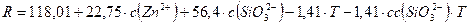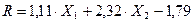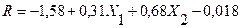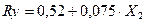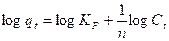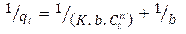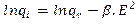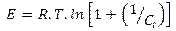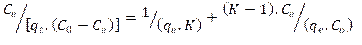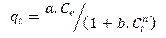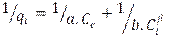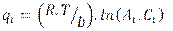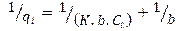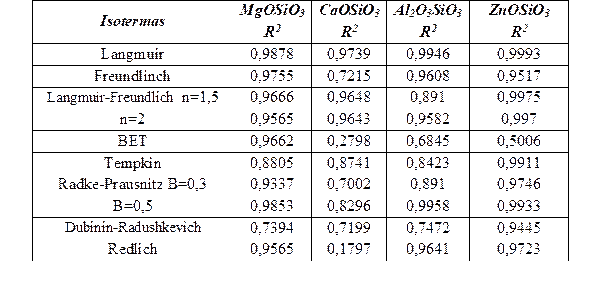INTRODUCCIÓN
Un sólido amorfo se caracteriza por la ausencia de un orden atómico de largo alcance. Un ejemplo de estos compuestos lo constituyen los silicatos sintéticos amorfos, cuya unidad estructural es SiO4 4- (Smart y Moore, 1995), los cuales pueden ser obtenidos a partir de disoluciones acuosas saturadas de composición apropiada en un dominio de temperaturas comprendido entre 298 K y 573 K. Su comportamiento estructuro-químico está determinado por la composición de las disoluciones y condiciones operatorias (Cotton y Wilkinson, 1966).
El mecanismo de formación del enrejado aniónico de los silicatos no estequiométricos depende de presión, temperatura, química del gel de síntesis y naturaleza de los cationes circundantes (orgánicos e inorgánicos) presentes en el medio fluido reaccionante.
Estos sólidos se caracterizan por su capacidad de adsorción, vinculada al desequilibrio de las fases en contacto y su desviación del estado de equilibrio dinámico, que depende de la superficie desarrollada del material adsorbente, de la concentración de las moléculas o iones a adsorber en disolución, de la energía de enlace, fuerza iónica del medio, temperatura y solutos competitivos, entre otros (West, 1998); (Kittel, 1965).
Estos materiales pueden ser usados para la eliminación de contaminantes, dentro de estos, metales pesados con apreciable índice de toxicidad como cobre (II) (Terrero, 1992), (Departamento de salud y servicios humanos de EE.UU, 2004) presentes en los residuales líquidos de muchos procesos industriales.
Hoy en día la tendencia es que todas las industrias tengan como resultado final productos biodegradables y en el peor de los casos inertes. Una de las problemáticas consiste en que el residuo no sea biodegradable y entonces se impone la necesidad de hacerlo inerte por diferentes métodos entre ellos está, incorporar el material adsorbente ya empleado a una matriz sólida de uso en la industria del cemento. Muchos países están centrando su atención en el empleo de materiales adsorbentes que por sus características puedan eliminar residuos de metales pesados de actividad toxicológica dañina (Ahluwalia y Goyal, 2007), (Xiaomin et al., 2008), (Gayosso y col., 2018). El uso de materiales que puedan servir de adsorbentes y ser utilizados en la industria presupone un ciclo cerrado en la actividad de saneamiento ambiental y un paso diversificador de tecnologías (Dias et al., 2007), (Sud et al., 2008), (Tofighy y Mohammadi, 2011), (Fu y Wang, 2011).
El objetivo de la presente investigación es determinar las isotermas correspondientes a la adsorción en el sistema heterogéneo de disoluciones acuosas de iones Cu (II) y silicatos amorfos de magnesio, calcio, aluminio y zinc.
MATERIALES Y METODOS
2.1. Síntesis de los silicatos amorfos
Para las síntesis de los silicatos de calcio, zinc, aluminio y magnesio se emplean como reactivos cloruro de zinc, cloruro de calcio, cloruro de aluminio y cloruro de magnesio puros para análisis y “metasilicato” de sodio de composición óxido de sodio 51%, dióxido de silicio 48% y agua 1%. En todos los casos se realiza un diseño factorial 23 tomando como variables las concentraciones de cloruros de los elementos declarados y “metasilicato” de sodio, así como la temperatura. Siendo X1 (concentración de cloruros), X2 (concentración de “metasilicato” de sodio) y X3 (temperaturas); las variables codificadas correspondientes al orden arriba expuesto.
Se hacen tres réplicas de cada experimento, controlando la temperatura de las disoluciones en un termostato. La formación de los silicatos amorfos transcurre en un periodo de tiempo que oscila entre los 3 y 4 segundos, medido a través de los cambios de conductancia que ocurre en el proceso a través del conductímetro modelo DDSJ-308 A, de procedencia China.
Las disoluciones se mezclan añadiendo los cloruros sobre el silicato de sodio. Posteriormente se añade hidróxido de potasio hasta pH=14, lo que garantiza que no precipite sílice y que en caso de formarse hidróxidos de los elementos metálicos estos se eliminen al formar hidroxocomplejos solubles en agua. A continuación se filtran y se lavan con agua destilada hasta que las aguas madres tengan pH=7. El producto obtenido se seca en una estufa MLW de fabricación Alemana a 100 0C durante 2 horas y se lleva a peso constante. Para las pesadas se uso una balanza digital Sartorius de fabricación Alemana de precisión 0,001 g. Después de secos los silicatos se muelen y utilizando un vibrador de tamices CISA RP-20 de fabricación Española se tamizan para obtener un tamaño de grano de 0,125 y 0,071 mm de diámetro. Se emplea el software “Desing Expert” para establecer las dependencias de las variables.
En la Tabla 1 se muestra la matriz de trabajo empleada en todas las síntesis, donde X1, X2 y X3 responden a las concentraciones de cloruros, "metasilicato" y temperatura, respectivamente.
Tabla 1 Matriz de trabajo para las síntesis
| Experimento | X 1 | X 2 | X 3 |
|---|---|---|---|
| 1 | + | + | - |
| 2 | - | + | - |
| 3 | + | - | - |
| 4 | - | - | - |
| 5 | + | + | + |
| 6 | - | + | + |
| 7 | + | - | + |
| 8 | - | - | + |
2.1.1. Silicato de zinc hidratado
La composición de la mezcla reaccionante queda definida a través de una serie de relaciones molares cada una de las cuales tendrá una influencia específica en la síntesis de los silicatos, esto se puede apreciar en la Tabla 2.
Tabla 2 Influencia específica de cada relación molar de las mezclas reaccionantes sobre la síntesis de los silicatos
| Relación molar | Efecto principal |
|---|---|
| SiO2/MnOm | Composición estructural |
| H2O/SiO2 | Velocidad, mecanismo de cristalización |
| OH-/SiO2 | Grado de oligomerización de los silicatos |
| M+/SiO2 | Estructura, distribución de cationes |
Es necesario tomar en cuenta además el modo de preparación de las mezclas reaccionantes, maduración, tipo y naturaleza del reactor, sembrado, temperatura de cristalización, presión, agitación y tiempo de reacción. En la Tabla 3 se muestran las variables empleadas para la síntesis del silicato de zinc hidratado.
Tabla 3 Variables empleadas para la síntesis del silicato de zinc hidratado
| Variables | U.M | Máximo | Mínimo |
|---|---|---|---|
| X1 C(ZnCl2) | mol/L | 0,9 | 0,5 |
| X2 C(Na2O.SiO2.nH2O) | mol/L | 1,2 | 0,8 |
| X3 T | K | 323 | 303 |
Decodificando las variables, el modelo adopta la forma mostrada en la ecuación 1:
En el intervalo estudiado el mayor rendimiento (85 %) se obtuvo con:
c(ZnCl2) = 0,9 mol/L, c(Na2SiO3..H2O) = 1,2 mol/L, T = 30oC
2.2.2. Silicato de magnesio hidratado
A continuación en la Tabla 4 se muestra la matriz de las variables utilizadas en la síntesis del silicato de magnesio hidratado.
Tabla 4 Variables usadas para la síntesis del silicato de magnesio hidratado
| Variables | U.M | Máximo | Mínimo |
|---|---|---|---|
| X1 c(MgCl2) | mol/L | 2,368 | 0,947 |
| X2 c(Na2O.SiO2.nH2O) | mol/L | 2,498 | 1,249 |
| X3 T | K | 323 | 303 |
El uso del software “Desing Expert” muestra como resultado la dependencia de las variables X1,c(MgCl2) y X2,c(Na2O.SiO2.nH2O) sobre el rendimiento de la reacción (92 %). Como ecuación final se tiene la mostrada en 2:
Como se puede apreciar en la ecuación anterior, dada las condiciones de trabajo, la temperatura [T], las interacciones temperatura-concentración de silicato T.c(SiO3 2-), interacción temperatura-concentración de cloruro de magnesio T.c(MgCl2) y temperatura concentración de silicato y cloruro de magnesio T.c(MgCl2).c(SiO3 2-) no son significativas.
2.2.3. Silicato de aluminio hidratado
Para la síntesis del Silicato de aluminio hidratado se toman como variables la temperatura y las concentraciones de cloruro de aluminio y silicato de sodio. Los niveles de trabajo son los mostrados en la Tabla 5.
Tabla 5 Niveles de trabajo utilizadas para la síntesis
| Variables | Máximo | Mínimo |
|---|---|---|
| X1 c(AlCl3) (mol/L) | 2,498 | 1,248 |
| X2 c(Na2 SiO3. H2O) (mol/L) | 9,463 | 4,995 |
| X3 T (oC) | 323 | 303 |
El uso del software “Desing Expert” muestra como resultado la dependencia de las variables X1 c(AlCl3) y X2 c(Na2O.SiO2.nH2O) sobre el rendimiento de la reacción (R) (92%) Como ecuación final se tiene la 3:
Se aprecia como a nivel de diseño experimental las interacciones entre las variables no se reflejan en el rendimiento de la síntesis.
2.2.4. Silicato de calcio amorfo hidratado
Para la síntesis del Silicato de calcio amorfo hidratado se realiza un diseño factorial 23 utilizando como variables las concentraciones de cloruro de calcio y "metasilicato" de sodio junto a la temperatura. Los niveles utilizados para el trabajo se muestran en la Tabla 6:
Tabla 6 Variables utilizadas para la síntesis
| Variables | U.M | Máximos | Mínimos |
|---|---|---|---|
| X1 c(CaCl2) | mol/L | 0,9 | 0,5 |
| X2 c(Na2O.SiO2.nH2O) | mol/L | 1,2 | 0,8 |
| X3 T | K | 323 | 303 |
Para determinar si existe dependencia entre los parámetros planteados para el diseño experimental de la síntesis del silicato de calcio amorfo hidratado, se utiliza el software “Desing Expert”, a través del cual se obtiene el resultado mostrado en la ecuación 4:
Como se puede apreciar para el silicato de calcio dada las condiciones de trabajo, la temperatura [T], las interacciones temperatura-concentración de silicato T[SiO3 2-], interacción temperatura-concentración de cloruro de calcio T[CaCl2] y temperatura concentración de silicato y cloruro de calcio T[CaCl2][SiO3 2-] no son significativas en el rendimiento de la síntesis (93 %).
2.3. Propiedades físicas
A los productos obtenidos (silicatos amorfos) se les realiza la determinación de una serie de parámetros físicos importantes en la caracterización de los sólidos, como son: el tamaño de grano, la densidad picnométrica, la densidad aparente, la densidad aparente por aprisionamiento o densidad granular, la porosidad, la esfericidad, la compresibilidad, la tortuosidad, la superficie específica y el calor de disociación, según metodología descrita por (Prieto y Lestayo, 2017 a).
2.4. Metodología para el estudio isotérmico de la adsorción
En el análisis isotérmico de adsorción de iones Cu (II) en los diferentes silicatos amorfos, se preparan cinco diluciones acuosas de diferente concentración de Cu (II) (0,102; 0,51; 0,27; 0,14 y 0,06 mg/L) determinadas por Espectroscopía de Adsorción Atómica (EAA).
Las disoluciones tienen un pH de 5,06 unidades, con agitación a 300 rpm en un agitador mecánico AGU-10 Bunsen a 25oC. La fracción de partículas de los silicatos amorfos es la que se encuentra entre 0,125 y 0,071 mm de diámetro.
Se toman 40 mL y se ponen en contacto durante 30 min (el cual se determina por el estudio cinético realizado a los efectos de esta investigación), con 0,2 g del silicato del metal correspondiente con la agitación propuesta a la temperatura de 25oC; luego se filtra, y se determina la concentración final por EAA. Finalmente se realiza la selección de los modelos termodinámicos.
2.4.1. Modelos termodinámicos de adsorciónEcuación 8:
Se realiza el análisis con los modelos de adsorción termodinámicos de Freundlich,Langmuir-Freundlich, Dubinin-Raduskevich, BET, Redlich, Radke-Prausnitz, Temkin, y Langmuir (Prieto y Lestayo, 2017 b), (Azizian, 2004), (Silva y Caroiro, 2015), (Aksu, 2000), (Prieto et al., 2020).
Donde:
qt: gramos de soluto adsorbidos por gramo de adsorbente en el tiempo (mg/g), Ct: concentración de equilibrio de la disolución (mg/L), n:Intensidad de la adsorción, se restringe a valores mayores que la unidad, KF: constante de isoterma de Freundlich (mg1-(1/n)L/mg -1).
Donde:
K: constante de adsorción((L/mg)n, n: constante cuyo valor varía (0,3; 0,5; 0,8).
Modelo de Dubinin-Radushkevich
donde:
E: Potencial de Polanyi (J/mol), qe: gramos de soluto adsorbidos por gramo de adsorbente en el equilibrio (mg/g), β: Coeficiente relativo a la energía de adsorción (mol2/(g.J2)).
Modelo de BET. (Brunauer, Emmett, Teller)
donde:
Co: Concentración inicial del soluto en solución (mg/L), Ce: Concentración al alcanzar el equilibrio en la solución (mg/L), qe: gramos de soluto adsorbidos por gramo de adsorbente en el equilibrio (mg/g), K: constante de equilibrio de BET relacionada con el calor de adsorción.
donde:
b: Constante de Redlich (L/mg)n, a: Constante de Redlich (L/g).
qt: miligramos de soluto adsorbidos por gramo de adsorbente en el tiempo (mg/g), Ce: Concentración del soluto en equilibrio (mg/L), Ct: Concentración del soluto en el tiempo (mg/L), a: Constante (L/g), b:Constante (L/g)ß, Ambas constantes están vinculadas a las interacciones al absorbato.
donde:
T: temperatura (K), R: constante 8,314 (Jmol/K), AT: constante de Tempkin (L/mg), BT:constante de Tempkin (L/g), b: constante (J mol g /mg), Ct: Concentración del soluto en el tiempo (mg/L).
donde:
K: Recíproco de la concentración a la que se alcanza la mitad de la saturación del adsorbente, qt: miligramos de soluto adsorbidos por gramo de adsorbente en el tiempo (mg/g), Ct: Concentración de soluto en solución en el tiempo (mg/L), b: masa de la monocapa (mg/g).
RESULTADOS Y DISCUSIÓN
En la Tabla 7 se muestran los resultados de la caracterización física de los productos obtenidos (silicatos amorfos). De manera general se puede apreciar que los diferentes silicatos obtenidos presentan una elevada porosidad, lo que da una medida de la elevada rugosidad y capilaridad del material. La compresibilidad demuestra el alto grado de compactación de los silicatos. Los valores de tortuosidad reflejan un alto grado de desorden de los canales y superficie del sólido.
Tabla 7 Parámetros físicos de los silicatos amorfos obtenidos
| Silicatos | MgOSiO 2 | CaO.SiO 2 | Al 2 O 3 .SiO 2 | ZnO.SiO 2 |
|---|---|---|---|---|
| Densidad aparente (g/cm3) | 0,21 | 0,35 | 0,20 | 0,35 |
| Densidad aparente por aprisionamiento (g/cm3) | 0,56 | 0,62 | 0,40 | 0,62 |
| Densidad picnométrica (g/ cm3) | 1,688 | 1,848 | 1,501 | 1,847 |
| Compresibilidad | 0,63 | 0,44 | 0,49 | 0,44 |
| Porosidad | 0,88 | 0,81 | 0,87 | 0,81 |
| Esfericidad | 0,42 | 0,44 | 0,42 | 0,44 |
| Superficie específica (m2/g) | 253 | 401 | 467,4 | 400,1 |
| Tortuosidad | 1,79 | 1,65 | 1,80 | 1,65 |
3.1. Estudio del equilibrio de adsorción de Cu (II)
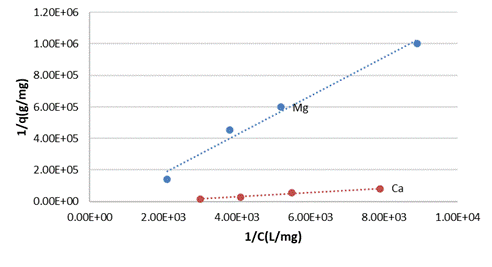
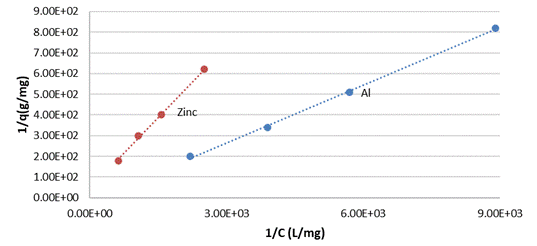
Los resultados de los ajustes de la adsorción de los iones Cu (II) desde disoluciones acuosas empleando los diferentes modelos termodinámicos para los diferentes silicatos amorfos se muestran en las tablas de la 7 a la 9. Como se aprecia en la Tabla 8 y de manera general, de los diferentes modelos termodinámicos asociados al proceso de adsorción de cobre (II) por los diferentes silicatos amorfos el modelo de Langmuir es el que mejor se ajusta con un mayor R2.
Un análisis detallado demuestra que la monocapa de iones Cu (II) es mayor para el silicato de zinc y de aluminio, pero además la constante de equilibrio de Langmuir para los sistemas silicatos de zinc y aluminio-soluciones de Cu (II) son los menores en comparación con los sistemas correspondientes al magnesio y calcio, ver (Fig. 1) y (Fig. 2).
A partir de un análisis de este modelo se determina la constante de equilibrio y la cobertura de la monocapa para cada silicato como se puede apreciar en la Tabla 9.
Tabla 9 Constantes de equilibrio y cobertura de la monocapa para los silicatos estudiados
| Silicatos | Constante de equilibrio(K) | Cobertura de la monocapa(b) |
|---|---|---|
| Silicato de magnesio | 0,37 | 8,09 |
| Silicato de calcio | 0,47 | 26,46 |
| Silicato de aluminio | 0,14 | 33,44 |
| Silicato de zinc | 0,019 | 166,67 |
A partir de la ecuación ΔG = - RT ln b se evalúa la variación de energía libre del proceso de adsorción, como se muestra en la Tabla 10:
Tabla 10 Estudio de la termodinámica del proceso de adsorción
| Silicatos | -ΔG (kJ/mol) |
|---|---|
| Silicato de magnesio | 5,18 |
| Silicato de calcio | 8,12 |
| Silicato de aluminio | 8,70 |
| Silicato de zinc | 12,68 |
Desde el punto de vista físico son semejantes los valores de densidad aparente, densidad aparente por aprisionamiento, densidad picnométrica, compresibilidad, porosidad y esfericidad. Los valores de superficie específica y tortuosidad muestran diferencias que deben influir en la capacidad de adsorción. Es interesante comparar estos resultados con el proceso de adsorción de soluciones de Cu (II) con ceniza de bagazo de caña de azúcar donde ΔG = -4,17 kJ/mol, lo que responde a una menor superficie específica del sólido, menor porosidad y tortuosidad (Prieto et al., 2009).
Todos los casos responden a una isoterma de Langmuir o sea cumplen una suposición de una superficie equipotencial, adsorción localizada. A partir de este modelo se determina la cobertura de la monocapa que es mayor en el silicato de zinc, para el cual se obtiene el mayor valor de variación de energía libre de Langmuir. Es destacable que la adsorción no responde a una distribución logarítmica de los sitios de adsorción y por ello no responden los datos a un modelo de Freundlich. La formación de multicapas está descartado dado los valores de los coeficientes de determinación correspondientes al modelo BET.
Es significativo que la adsorción en microporos no es considerado como fenómeno a tomar en cuenta, dado el modelo de Dubinin-Radushkevich. Los valores bajos de R2 para el modelo de Radke-Prausnitz permiten descartar la adsorción en superficies heterogéneas y descartar la retención de más de una capa de iones adsorbidos. El análisis de la isoterma de Tempkin, donde no son despreciables las interacciones indirectas entre moléculas de adsorbato y hay un decrecimiento de las moléculas en forma lineal. Este modelo puede considerarse para el silicato de zinc hidratado.
Dada la inadecuación para ser utilizada en el análisis del fenómeno analizado descarta las interacciones indirectas entre los iones del adsorbato, así como el decrecimiento de los iones en forma lineal. La isoterma de Redlich que responde a un híbrido del modelo de Lagmuir y Freundlich es descartable dada la no adecuación de una distribución de los sitios de adsorción preconizados por el modelo de Freundlich.
Es interesante como la "afinidad química" de los iones Cu (II) y Zn (II) dada la disponibilidad de los orbitales d correspondientes al tercer período de la Tabla Periódica, permiten una interacción mayor en el proceso de adsorción.
CONCLUSIONES.
Los rendimientos alcanzados en la obtención de los silicatos amorfos de acuerdo a las variables utilizadas como concentraciones de silicato de sodio y sales de los iones objetos de estudio y la temperatura son adecuadas donde el punto de vista del campo de la síntesis inorgánica.
La adsorción de iones Cu2+ con los cuatro silicatos amorfos obtenidos se ajusta al modelo de Langmuir favorecido termodinámicamente para el silicato de Zn con mayor cobertura de monocapa y ΔG = - 12,68 kJ/mol.