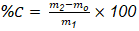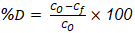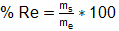INTRODUCCIÓN
Camarón es el nombre común de diferentes crustáceos decápodos pertenecientes a la familia de los peneidos (Penaeidae), entre los cuales se encuentra el camarón blanco del Pacífico (Litopenaeus vannamei). Esta especie se destaca por ser una de las más usadas para el cultivo a nivel mundial, ya que se considera como la más resistente a cambios medioambientales (Laffita, 2015).
Cuba se ha dedicado al cultivo de esta especie de camarón importada, debido a las potencialidades que posee por su mayor poder de conversión del alimento y crecimiento. La producción camaronera en su mayoría se destina a la exportación, a mercados de Canadá, Asia, el Caribe y América del Sur. Los camarones que no cumplen con las normas requeridas para este fin (fundamentalmente la talla comercial) son enviados a la Empresa Prodal perteneciente al Ministerio de la Industria Alimentaria, donde se extrae la parte comestible (músculo) que actualmente constituye la única parte del camarón aprovechada, y se destina al turismo y la gastronomía nacional. El exoesqueleto y la cabeza son considerados desperdicios y se venden en ocasiones a cooperativas porcinas (Laffita, 2015).
Estos desechos presentan una rica composición química: proteínas (40 %), minerales (35 %), quitina (14 % al 30 %) y pigmentos carotenoides principalmente astaxantina. Además, son una fuente rica de sabores y enzimas (Haddar et al., 2011; Sowmya et al., 2011), glicosaminoglicanos sulfatados (Cao et al., 2009; Cahú et al., 2012) y aminoácidos tales como: metionina, arginina, fenilalanina, valina e histidina (Belandria, 2014).
La quitina es un biopolímero que forma parte de la estructura de soporte de numerosos organismos vivos, tales como artrópodos (crustáceos e insectos), moluscos y hongos (Barra y col., 2012). Se plantea que el contenido de quitina en residuos de crustáceos (camarón) varía entre 14 % - 35 % (Polo, 2016). Este biopolímero está formado por unidades de 2-acetamida-2-deoxy-β-D-glucosa unidas por enlaces β-(1-4). Se obtiene fácilmente por un tratamiento químico o biológico de residuos de crustáceos con el fin de remover los pigmentos, las sales, como el carbonato de calcio y las proteínas que se encuentran asociadas a ella (Alas, 2007).
El quitosano es el principal derivado de la quitina y estos dos biopolímeros presentan muchas aplicaciones en diversas ramas de la economía: tecnología de los alimentos, ciencia de los materiales, microbiología, agricultura, tratamiento de aguas residuales como coagulante, sistemas de administración de fármacos, ingeniería de tejidos, bionanotecnología (Khoushab y Yamabhai, 2010); (Cadeza, 2014), membranas funcionales y floculación, entre otros (López y Correa, 2012).
La obtención de la quitina por vía química es la más empleada en la industria debido a su rapidez y bajo costo, aunque presenta como desventajas la generación de desechos corrosivos y la dificultad para recuperar proteínas y pigmentos (Barriga, 2016). Este método requiere de tres etapas básicas:
Despigmentación: Para la separación de los pigmentos lipídicos (carotenoides).
Desmineralización: Para eliminar la materia inorgánica.
Desproteinización: Para la separación de las proteínas.
El objetivo del presente trabajo está dirigido a la evaluación del tratamiento químico de los residuos de camarón Litopenaeus vannamei para la obtención de quitina.
MATERIALES Y MÉTODOS
Las materias primas empleadas para esta investigación fueron el exoesqueleto y cefalotórax (cabeza) de camarón de la especie Litopenaeus vannamei, que fueron proporcionadas por la Empresa Prodal, ubicada en el municipio Regla, provincia La Habana, Cuba. En la Figura 1 se muestran las etapas para la obtención de quitina.
Antes de someter la materia prima a este proceso, la misma fue acondicionada, mediante el lavado con agua y separación de la carne que pudiera quedar adherida a la misma. Posteriormente, fue secada al sol durante 24 horas y se procedió a su molienda en un molino de bolas hasta el tamaño de partículas adecuado para la extracción, que osciló entre 150 y 300 microgramos (Colina y col., 2014).
Finalmente, la materia prima fue almacenada en recipientes plásticos secos hasta su posterior uso. Debido a las diferencias apreciables de tamaños tras la molienda, se realizó el proceso de tamizado en un tamiz de laboratorio durante una hora, partiendo de 50 gramos de cabeza y 100 gramos de exoesqueleto molido. Posteriormente, fueron pesadas las cantidades correspondientes a los diferentes tamices para determinar el diámetro superficial volumétrico (Dvs) mediante la Ecuación 1:
donde:
Δxi: fracción másica de la muestra acumulada hasta el tamiz i; dpi: diámetro del tamiz que retiene la fracción considerada (mm) y Dvs: diámetro superficial volumétrico (mm).
La caracterización química de los residuos estudiados se realizó en el Centro de Investigaciones Pesqueras (CIP) perteneciente al Ministerio de la Industria Alimentaria (MINAL). Allí se determinó el contenido de humedad, proteínas, cenizas, grasas y fósforo total. El contenido de pigmento inicial en los residuos fue determinado mediante dos métodos: extracción con metanol en Soxhlet y extracción con etanol en baño ultrasónico (Herrera y col., 2011); (Palacio, 2017).
Para el tratamiento químico de los residuos de camarón inicialmente se estudiaron las etapas de desmineralización y despigmentación. Se estableció un diseño experimental 23, cuyas características se muestran en la Tabla 1. Todas las corridas fueron realizadas de forma aleatoria con réplicas en todos los puntos experimentales, empleando para ello la herramienta computacional Statgraphics Centurion XV.
Una vez determinadas las mejores condiciones para estas dos etapas, fueron replicadas para disponer de una cantidad de muestra suficiente para la etapa de desproteinización.
Para la extracción del pigmento fueron empleados dos métodos, uno con una solución de etanol al 90 % y el otro con ozono. Para la despigmentación con la solución alcohólica se montaron cuatro muestras (dos de cabeza y dos de exoesqueleto) con 5 gramos cada una, empleándose una relación 1:10 p/v, en agitación constante a 180 min-1 durante seis horas. Transcurrido el tiempo previsto fueron filtradas al vacío y el filtrado obtenido antes de adicionar el agua destilada (para estabilizar pH) se empleó para la determinación del contenido de pigmento extraído.
Tabla 1 Características del diseño de experimentos
| Tipo de residuo | (-1) cabezas | Cenizas (%) Despigmentación (%) |
| (+1) exoesqueleto | ||
| Concentración HCl | (-1) 1 mol/L | |
| (+1) 5 mol/L | ||
| Método de despigmentación | (-1) ozono | |
| (+1) etanol |
La despigmentación con ozono se llevó a cabo en el laboratorio de Medio Ambiente del Centro Nacional de Investigaciones Científicas (CNIC) según Curbelo y col., (2018). Para determinar el porcentaje de despigmentación se empleó la expresión (Ecuación 2):
donde:
Despig (%): porcentaje de despigmentación de la muestra (%); %pigm. e : porcentaje de pigmento extraído (%); %pigm. o : porcentaje de pigmento inicial (%).
De la materia prima despigmentada (tanto con etanol como con ozono) fueron tomados 10 gramos de cada residuo. En ocho erlenmeyers fueron colocaron 5 gramos de cada residuo, se adicionó la solución de HCl en concentraciones de 1 mol/L y 5 mol/L, con una relación sólido-solvente de 1:11 p/v, determinada previamente para garantizar un buen mezclado entre las fases.
Los erlenmeyers se colocaron en una zaranda durante tres horas a una temperatura de 28°C y velocidad de agitación constante de 200 min-1. Transcurrido el tiempo necesario el material desmineralizado fue filtrado al vacío y lavado con agua destilada, para finalmente secarlos a temperatura ambiente durante 24 horas.
El porcentaje de cenizas se realizó por el método gravimétrico, a partir del residuo obtenido tras la incineración de aproximadamente un gramo de cada muestra en crisoles previamente tarados, en una mufla a 600 °C durante cuatro horas, hasta obtener cenizas blancas o grisáceas. Los crisoles se enfriaron en una desecadora y se pesaron en la balanza analítica hasta masa constante, luego se calculó el porcentaje de cenizas utilizando la Ecuación 3:
donde:
%C: porcentaje de cenizas; m2: masa del crisol con las cenizas (g); m1: masa de la muestra (g); mo: masa del crisol vacío (g).
Una vez calculado el contenido de ceniza se determinó el porcentaje de desmineralización para cada una de las muestras empleando la expresión (Ecuación 4):
donde:
D: porcentaje de desmineralización (%); Co: porcentaje de cenizas inicial (%);
Cf: porcentaje de ceniza final (%).
En la etapa de desproteinización, al residuo sólido desmineralizado se le añadió una solución alcalina de NaOH (1 mol/L), en una relación sólido-solvente de 1:10 p/v, porque con ella se garantizó un buen mezclado entre las dos fases. Fueron colocadas cuatro muestras en una zaranda termostatada con velocidad de agitación constante de 200 min-1 a una temperatura de 50 °C durante seis horas. Transcurrido el tiempo correspondiente, las muestras fueron filtradas, lavadas con agua para estabilizar el pH y secadas bajo las mismas condiciones descritas en la etapa anterior, obteniéndose una fase sólida (quitina) y una solución acuosa de proteínas. Para determinar la presencia de proteína en esta solución se empleó la técnica Punto-Mancha (también llamada por su denominación en inglés, Dot Blot). Esta representa una simplificación de los métodos Northern blot, Southern blot o Western blot (De la Fuente y col., 2007).
Para determinar cuantitativamente la eficacia de la etapa de desproteinización se calculó la concentración de nitrógeno y proteínas a las muestras desproteinizadas por el Método Kjetdhal (Martínez y Fernández, 2012).
Para calcular el rendimiento en cada etapa se tuvo en cuenta la masa a la entrada y a la salida de cada una de estas. Por otra parte, para determinar el rendimiento del proceso de obtención de quitina se tuvo en cuenta la masa de materia prima empleada y la masa de quitina obtenida. Ambos rendimientos se calcularon una vez determinadas las mejores condiciones de desmineralización y despigmentación. Las ecuaciones 5 y 6 corresponden a las expresiones empleadas para determinar cada uno de estos rendimientos (Ecuación 5).
donde: % Re: Rendimiento de cada etapa (%); me: masa a la entrada de cada etapa (g); ms: masa a la salida de cada etapa (g). (Ecuación 6)
donde: % Rq: Rendimiento de obtención de quitina (%); mq: masa de quitina obtenida (g); mpm: masa inicial de materia prima empleada (g).
RESULTADOS Y DISCUSIÓN
3.1 Caracterización de la materia prima para la obtención de quitina
En la Tabla 2 se muestra la composición química de los residuos de camarón Litopenaeus vannamei y se comparan con lo reportado por Ortiz (2013). Según se observa los residuos de camarón presentan una cantidad apreciable de materia orgánica e inorgánica, indicada por el contenido de proteínas y cenizas respectivamente. Estos valores son reportados por diferentes autores, así el porcentaje de cenizas y proteína presente en la cabeza se encuentra en los intervalos reportados por Mármol y col., (2013), Polo (2016) entre 30 % y 50 %, y es inferior al valor reportado por Ortiz (2013) de 22, 6%.
El porcentaje de proteína que se obtuvo para el exoesqueleto es similar al reportado por Ortiz (2013) de 40,6 % y Abadía (2010) entre 20 % y 40 %, y difiere en mayor medida del valor obtenido por Luna (2012) de 36,2 %.
Tabla 2 Caracterización de los residuos de camarón
|
|
||||
|---|---|---|---|---|
| Humedad (%) | 10,78 ± 0,25 | 9,38 ± 0,22 | 0,00 | 10,00 |
| Cenizas (%) | 36,11 ± 1,55 | 27,10 ± 1,43 | 22,60 | 30,00 |
| Proteína (%) | 30,68 ± 1,20 | 41,23 ± 1,50 | 58,20 | 40,60 |
| Grasa (%) | 0,21 ± 0,02 | 0,57 ± 0,03 | ND | ND |
| Fósforo total (%P2O5) mg P2O5/100 g | 3,23 ± 0,05 | 3,37 ± 0,04 | 1,68 | 1,57 |
ND. No determinado
El porcentaje de grasa obtenido para la cabeza en este estudio es inferior a los logrados por Cruz y col.,(2000) de 8,2 %, Carranco (2003) de 4,63 % y Morillo y col., (2006) de 10,48 %. Para el exoesqueleto, el porcentaje de grasa es menor que el conseguido por Morillo y col., (2006) de 0,71 %, pero se encuentran en el intervalo reportado por Abadía (2010) de 0 a 14 %.
El porcentaje de fósforo obtenido para cada tipo de residuo es superior al reportado por Ortiz (2013) de 1,68 % y 1,57 % y Morillo y col., (2006) de 1,24 % y 2,74 % para la cabeza y el exoesqueleto respectivamente. Las diferencias existentes entre los resultados obtenidos en esta investigación y los reportados en la literatura, se pueden atribuir a la diferencia de especie, edad, ciclo reproductivo, zonas de cría o captura, estado fisiológico, alimentación, y sexo.
En la Tabla 3 se muestra la concentración de pigmento inicial obtenido por cada uno de los métodos empleados. Este parámetro resultó muy importante para la evaluación de la etapa de despigmentación.
Como se puede observar los porcentajes de pigmentos obtenidos mediante la extracción con Soxhlet son inferiores a los obtenidos con el baño ultrasónico. Por tal motivo, se tomaron los resultados de este último método, ya que la coloración rojo-naranja de los extractos se correspondió con el color inicial de los residuos, fundamentalmente el exoesqueleto. Estos resultados se encuentran en el intervalo 1-14 %, establecido por Luna (2012) y (Nieto y Orellana, 2011).
Los resultados del análisis granulométrico permitieron mediante la Ecuación (1) determinar la distribución de tamaño y el diámetro superficial volumétrico de los residuos estudiados. En ambos casos los datos cumplen con una distribución normal, encontrándose el 61,7 % de las partículas entre los tamices de 0,315 - 0,180 mm para la cabeza, y entre los tamices 0,355 - 0,180 mm para el exoesqueleto. A partir de la información obtenida del análisis de tamizado (no presentada) y mediante la Ecuación 1 se calculó el diámetro superficial volumétrico para cada residuo, los mismos fueron de 0,213 mm y 0,263 mm para cabeza y exoesqueleto respectivamente. Estos valores son inferiores a los obtenidos por Amador y col., (2016) de 0,3 mm y (Hernández y Torres, 2015) de 0,397 mm. Por otro lado, son ligeramente superiores a los logrados por Encarnación (2015) y Barriga (2016) de 0,250 mm, pero se encuentran por debajo del valor límite recomendado por Colina y col., (2014), quienes plantearon que el tamaño de partícula tiene efecto en los procesos de despigmentación, desproteinización y desmineralización. Tamaños superiores a este a nivel industrial, afectan la eficiencia en estos procesos, requiriendo mayor cantidad de decolorante, álcali o ácido.
3.2 Resultados del diseño experimental
En la Tabla 4 se muestra el porcentaje de despigmentación, de cenizas y desmineralización, calculados mediante la Ecuación 2, Ecuación 3 y Ecuación 4 respectivamente, para cada una de las corridas experimentales Se especifican las condiciones de los factores en estudio (tipo de residuo + método de despigmentación + concentración HCl).
Tabla 4 Características y resultados del diseño experimental
| 1 | cab + etanol + 1 mol/L | 0,13 | 2,12 | 94,13 |
| 2 | cab + etanol + 5 mol/L | 11,83 | 1,99 | 94,49 |
| 3 | cab + O3 + 1 mol/L | 9,59 | 1,47 | 95,93 |
| 4 | cab + O3 + 5 mol/L | 9,59 | 1,26 | 96,51 |
| 5 | exo + etanol + 1 mol/L | 21,03 | 0,32 | 98,82 |
| 6 | exo + etanol + 5 mol/L | 24,13 | 0,46 | 98,30 |
| 7 | exo + O3 + 1 mol/L | 79,51 | 0,40 | 98,52 |
| 8 | exo + O3 + 5 mol/L | 79,51 | 0,25 | 99,08 |
cab (cabeza); exo (exoesqueleto); O3 (ozono)
Como se observa el porcentaje de despigmentación fue superior para el exoesqueleto cuando se utilizó el ozono como agente decolorante. Es importante destacar el bajo contenido de cenizas, lo que demuestra que se logró el objetivo de esta etapa de manera satisfactoria, ya que todos los porcentajes de desmineralización son superiores a 94 % y se repite que este proceso es más efectivo cuando se utiliza ozono como agente decolorante.
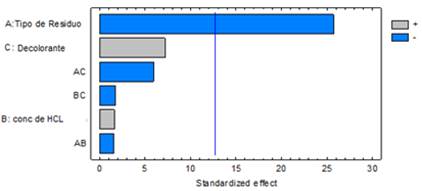
En la Figura 2 se muestra el diagrama de Pareto para el porcentaje de despigmentación, donde resultaron tener influencia significativa con un 95 % de confianza el tipo de residuo y el método de despigmentación, así como sus interacciones, obteniéndose los mejores resultados con el exoesqueleto y el uso del ozono.
También se observa que la concentración de HCl tiene un Pvalue = 0,056 y su interacción con el agente decolorante (Pvalue = 0,05), por lo que se considera que también tienen una influencia sobre el porcentaje de despigmentación, no tan marcada como el resto de los factores.
El porcentaje de despigmentación obtenido para el residuo cabeza es inferior al obtenido para el exoesqueleto. Esto puede deberse a que en el exoesqueleto hay mayor cantidad de pigmento y por lo tanto, es mayor la cantidad que se extrae, o sea, que la diferencia entre el pigmento inicial y el final es mayor que en la cabeza.
En la Figura 3 se representa el diagrama de Pareto para el contenido de cenizas, relacionado directamente con el porcentaje de desmineralización. El tipo de residuo es el factor que influye significativamente con un 95 % de confianza; los mejores resultados se obtienen para el exoesqueleto.
Los porcentajes de cenizas obtenidos en esta investigación son inferiores al valor reportado por Amador y col., (2016) de 2,86 %. Por otra parte, los porcentajes de desmineralización son superiores al valor obtenido por Amador y col., (2016) de 93,39 %. Las diferencias entre los contenidos de cenizas y porcentajes de desmineralización obtenidos en esta investigación y los informados por otras fuentes son atribuidas principalmente, a las condiciones establecidas para la etapa de desmineralización (pH, tiempo, concentración del ácido y temperatura) y el tipo de residuo en cuestión.
Tanto en el análisis realizado al porcentaje de despigmentación y al porcentaje de cenizas se demostró que el tipo de residuo que más favorecía a estas variables fue el exoesqueleto decolorado con ozono, por lo que todas las etapas que comprende la obtención de quitina se realizaron bajo estas condiciones y una concentración de HCl de 5 mol/L. Se realizaron dos corridas para verificar los resultados, obteniéndose un porcentaje de desmineralización de 98,935 ± 0,007, considerado satisfactorio.
3.3 Etapa de desproteinización
Los resultados de dos muestras obtenidas bajo las mejores condiciones en las etapas precedentes fueron:
Nitrógeno Total (%): 5,670 ± 0,098 Proteínas (%): 35,440 ± 0,022
Desproteinización (%): 14,045 ± 1,506
En la Tabla 5 se presentan los valores reportados por algunos autores con relación al contenido de nitrógeno total en exoesqueletos de camarón desproteinizados. Las diferencias entre los porcentajes de nitrógeno y desproteinización obtenidos en esta investigación respecto a los reportados por otros autores, están dadas principalmente por las condiciones establecidas para esta etapa (tiempo, concentración del álcali y temperatura), ya que en todos ellos se trabajó con concentración de NaOH más altas y alrededor de los 100 °C.
Tabla 5 Comportamiento del nitrógeno total de exoesqueleto de camarón desproteinizado
|
|
|
|
|
|---|---|---|---|
|
|
2,35 ± 0,01 | 6,58 ± 0,05 | 18,20 ± 0,15 |
Evidentemente, la temperatura utilizada en este trabajo (50°C) influyó significativamente en el bajo porcentaje de desproteinización obtenido, y por lo tanto, esto le confiere a la quitina obtenida un mayor contenido de impurezas (proteínas), por lo que se recomienda para trabajos futuros desarrollar esta etapa a temperaturas cercanas a 100 °C. No obstante, para verificar lo logrado se determinó cualitativamente mediante la técnica Dot Blot la presencia de proteínas en el filtrado, representadas por las manchas rojas más intensas (Figura 4).
3.4 Rendimientos por etapas
Los rendimientos se calcularon una vez determinadas las mejores condiciones para la etapa de despigmentación y desmineralización. Se analizarán por separado cada una de las etapas.
3.4.1. Rendimiento para la etapa de despigmentación
Se empleó una masa de exoesqueleto de 50 gramos, una vez que esta etapa concluyó se tuvo que la masa de exoesqueleto fue de 49,1035 gramos, por lo que el rendimiento de esta etapa fue de 98,2 %. Como se puede apreciar este es elevado, lo que puede estar causado por la pequeña concentración de pigmentos presentes en estos residuos, o sea, que la masa que estos representan del total es pequeña.
3.4.2. Rendimiento de la etapa de desmineralización
En la Tabla 6 se muestran los valores de rendimiento obtenidos tras realizar la desmineralización del exoesqueleto de camarón. Ozuna y col., (2014) tras la desmineralización obtuvieron un valor de rendimiento de un 49,6 %, el cual es similar al obtenido. Es importante destacar que en ese trabajo se empleó como materia prima exoesqueleto de camarón de la misma especie que se analiza en esta investigación, el cual fue desmineralizado con ácido clorhídrico a 2,1 mol/L por un tiempo tres horas a 37 ºC.
3.4.3. Rendimiento de la etapa de desproteinización
Los valores de rendimiento para esta etapa se muestran en la Tabla 7. Se aclara que la masa inicial se corresponde con la final de la etapa anterior. El rendimiento promedio de esta etapa es superior al logrado por Cadeza (2014) de 41 %, lo cual puede estar propiciado por el contenido de impurezas presentes en la quitina, fundamentalmente de proteína.
CONCLUSIONES
Las diferencias fundamentales en la composición química de los residuos de camarón estudiados se encuentran en el contenido de cenizas, proteínas y pigmentos, lo que influye en las etapas de obtención de quitina, resultando que las condiciones de operación en las etapas de despigmentación y desmineralización permitieron seleccionar al exoesqueleto para la obtención de quitina.
La temperatura en la etapa de desproteinización no garantizó la obtención de quitina con una elevada pureza.
El rendimiento total para la obtención de quitina a partir del exoesqueleto de camarón fue de 28,4 %.