Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Química
versão On-line ISSN 2224-5421
Rev Cub Quim vol.27 no.2 Santiago de Cuba maio.-ago. 2015
ARTICULOS
Validación de un método analítico para la determinación del contenido de monobromado en el Dermofural por Cromatografía Líquida de Alta Eficacia (CLAE), fase inversa
Reverse phase High Performance Liquid Chromatogray (HPLC) determination of a monobrominated impurity in Dermofural. Method Validation
MSc. Yaidel A. Quiñones-García, MSc. Amalia M. Calvo-Alonso, Lic. Isabel M. Caraballoso-Noa, Lic. Heidy L. Alonso-Rodríguez
Centro de Bioactivos Químicos, Universidad Central "Marta Abreu" de Las Villas, Villa Clara, yaidelq@uclv.edu.cu, amaliac@uclv.edu.cu, isabelm@uclv.edu.cu, halonso@uclv.edu.cu
RESUMEN
El Dermofural es un ungüento tópico cuyo ingrediente farmacéutico activo es la furvina (2-bromo-5-(2-bromo-2-nitrovinil)-furano), el cual exhibe acción antibacteriana y antifúngica, el mismo se encuentra acompañado de una impureza conocida como monobromado (2-bromo-5-(2-nitrovinil)-furano), cuyo contenido se incluye dentro de las especificaciones de calidad del medicamento. Este trabajo pretende validar una técnica por cromatografía líquida de alta eficacia, fase inversa, para cuantificar esta impureza en el Dermofural. El estudio de validación se desarrolló según lo establecido por el Centro para el Control Estatal de la Calidad de los Medicamentos. Se evaluaron los parámetros: adecuación del sistema, especificidad, linealidad, precisión, veracidad, intervalo, límites de detección y cuantificación. El método analítico estudiado resultó ser específico, lineal, preciso y exacto, con límites de detección y cuantificación de 0,1 mg/L y 0,09 mg/L, respectivamente, por tanto se puede utilizar en el control de la calidad del Dermofural y para sus estudios de estabilidad.
Palabras clave: dermofural, furvina, validación.
ABSTRACT
Dermofural is a topical ointment based on the active pharmaceutical ingredient furvina (2-bromo-5-(2-bromo-2-nitrovinyl) furan), which exhibit antibacterial and antifungal action. This product contains a known monobrominated impurity (2-bromo-5-(2-nitrovinyl) furan) which has to be determined among the quality specifications for the end product. This paper describes the validation of a Reverse Phase High Performance Liquid Chromatography method to quantify this impurity in Dermofural samples. The validation study was carried out as established by the "Centro para el Control Estatal de la Calidad de los Medicamentos". System suitability, specificity, linearity, precision, accuracy, range and detection and quantification limits were evaluated. The analytical method demonstrated to be specific, linear, accurate and precise, with limits of detection and quantification of 0,1 mg/L and 0,09 mg/L, respectively, therefore it can be used in quality control and stability studies of Dermofural.
Keywords: dermofural, furvina, validation.
INTRODUCCIÓN
El Dermofural es un ungüento tópico incluido en el cuadro básico de medicamentos de Cuba desde el año 2007; su ingrediente farmacéutico activo es la furvina, también conocido como G-1 (2-bromo-5-(2-bromo-2-nitrovinil)-furano), el cual se produce en el Centro de Bioactivos Químicos de la Universidad Central de Las Villas y exhibe acción antibacteriana y antifúngica. Debido al proceso de obtención por síntesis química, la Furvina se encuentra acompañada de una impureza conocida como monobromado, MBr (2-bromo-5-(2-nitrovinil)-furano), es decir, es una impureza de origen sintético y por tanto, puede presentarse también en el producto terminado Dermofural, por lo que se incluye dentro de las especificaciones de calidad del medicamento el contenido de la misma, con un límite menor o igual al 1 %.
El objetivo de este trabajo es validar una técnica por cromatografía líquida de alta eficacia, CLAE (HPLC por sus siglas en inglés), fase inversa, para determinar el contenido de esta impureza en el Dermofural.
MATERIALES Y MÉTODOS
Equipos, materiales y reactivos
El equipamiento utilizado para desarrollar la técnica, así como la cristalería empleada estaban debidamente calibrados y/o validados, por la Oficina Territorial de Normalización (OTN) e instituciones correspondientes. Los reactivos utilizados también poseían la calidad requerida.
Equipos
- Cromatógrafo líquido de alta eficacia con detector de longitud de onda variable, HPLC Agilent 1100 series
- Balanza analítica DENVER Instrumens
- Baño ultrasónico SONOREX RK52
Materiales
- Matraces de 10 mL y de 50 mL
- Micropipeta de 20 µL -200 µL
- Pipeta graduada de 5 mL
- Microjeringuilla de 100 µL
- Filtros Ministart RC 4 de 0,45 µm
- Embudo de cristal pequeño
- Beacker 75 mL
Reactivos
- Acetonitrilo HPLC, gradient grade, Panreac
- Excipiente (petrolato líquido pesado: petrolato sólido blanco, 1:4), Quimefa
- Monobromado material de referencia (lote 12 MBr-2, 99,64 % de pureza)
- G-1 material de referencia (lote 12-3-2, 99,87 % de pureza)
- Dermofural, LOTE 13001
Método empleado
Este método para la cuantificación de monobromado en lotes de Dermofural se basa en la separación por HPLC del G-1 de su impureza, utilizando para ello una columna RP-18, mediante detector UV-VIS de longitud de onda variable. Se empleó el método del patrón externo. Para los cálculos y el análisis estadísticos se utilizaron los programas Statgraphics Plus for Windows 4.1, Professional Version, 1999 y Microsoft® Office Excel 2010.
Parámetros operacionales del HPLC
- Fase Móvil: acetonitrilo HPLC
- Flujo de la fase móvil: 0,7 mL/min
- Longitud de Onda: 360 nm
- Columna Daisogel C-18 de 250 mm de longitud x 4,6 mm de diámetro
Preparación de la disolución de muestra de referencia
Se pesó con exactitud alrededor de 0,01 g de MBr, material de referencia, en un matraz de 50 mL con ayuda de un embudo de cristal; se disolvió el sólido y se enrasó en acetonitrilo (200 mg/L). De esta disolución se tomó una alícuota de 75 µL y se enrasó con acetonitrilo en un matraz de 10 mL (1,5 mg/L).
Preparación de la disolución de ensayo
Se pesó con exactitud en un beaker, alrededor de 1 g de Dermofural, se añadieron 4 mL de acetonitrilo y se colocó en baño ultrasónico por espacio de 15 min, luego se trasvasó el sobrenadante a un matraz de 10 mL; se añadieron nuevamente 4 mL de acetonitrilo y se repitió el procedimiento. Finalmente se enrasó con acetonitrilo (150 mg/L de G-1 y 1,5 mg/L de MBr, teóricamente, de acuerdo con el límite de la especificación, menor o igual a 1,00 %).
Cálculos
Se empleó la fórmula dada por la ecuación (1) para calcular del porcentaje del MBr:
Parámetros de validación[3-6]
a) Pruebas de adecuación del sistema:
- Repetibilidad de los tiempos de retención (< 1 %): Se preparó una disolución de MBr de 1,5 mg/L, y se hicieron 6 inyecciones. Se calculó la media, la desviación estándar y el coeficiente de variación (CV).
- Eficacia de la columna o número de platos teóricos (> 5 000): Se preparó una disolución de MBr de 1,5 mg/L; se hicieron 6 inyecciones. Se calculó el número de platos teóricos a través de la fórmula expresada mediante la ecuación (2).
- Resolución entre el pico de G-1 y el de MBr (>= 1,5): Se preparó una disolución de MBr y G-1 de 1,5 mg/L de cada analito; se hicieron 5 inyecciones. Se calculó la resolución entre los picos correspondientes a ambos analitos a través de la fórmula expresada en la ecuación (3):
- Simetría del pico de monobromado (entre 0,8 y 1,5): Se preparó una disolución de MBr de 1,5 mg/L, se hicieron 3 inyecciones. El dato del factor de simetría es brindado por el software utilizado.
b) Especificidad
Se registraron los siguientes cromatogramas en las condiciones especificadas
- Fase móvil
- Disolución del excipiente
- Disolución de material de referencia MBr 1,5 mg/L recién preparada
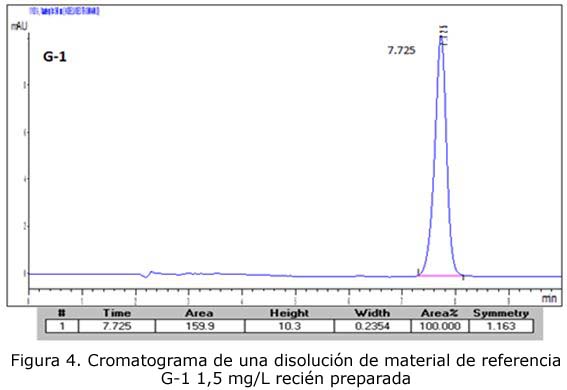
- Disolución de material de referencia G-1 1,5 mg/L recién preparada
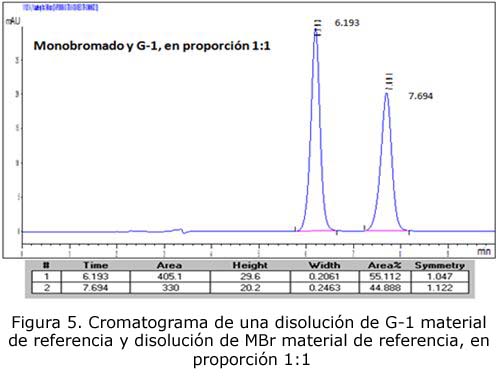
- Disolución de G-1 material de referencia y disolución de MBr material de referencia, en proporción 1:1
- Disolución de la muestra de ensayo
- Disolución de la muestra de ensayo enriquecida con MBr al 1 % según nivel de especificación (1,5 mg/L)
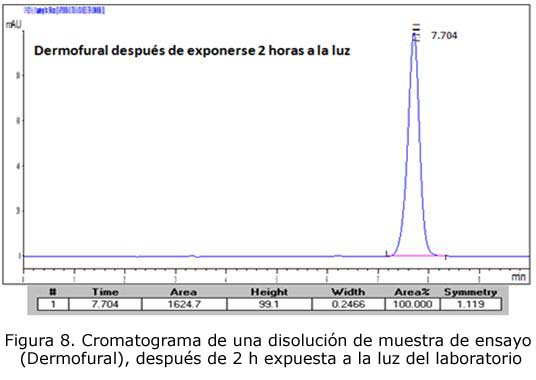
- Disolución de la muestra de ensayo, después de 2 h expuesta a la luz del laboratorio
En todos los casos se observó si existía algún pico adicional no suficientemente resuelto del pico correspondiente al MBr.
c) Linealidad
Se realizó una curva de calibración en el intervalo de concentraciones comprendido entre 0,7 mg/L y 2,3 mg/L, con valores intermedios de 1,1 mg/L, 1,5 mg/L y 1,9 mg/L. El análisis se realizó por triplicado.
d) Precisión
Repetibilidad instrumental: Se pesó con exactitud aproximadamente 1 g de excipiente, se le añadió 1,5 mg/L de MBr, se homogenizó y se procedió según la muestra de ensayo. Se hicieron 6 inyecciones de manera consecutiva. Se calculó la media de la respuestas (Xm), la desviación estándar (S) y el coeficiente de variación (CV <= 1 %).
Repetibilidad del método: Se pesó con exactitud aproximadamente 1 g de excipiente, se le añadió 1,5 mg/L de MBr, se homogenizó y se procedió según la muestra de ensayo. Se hicieron 6 réplicas. Se calculó la media de las respuestas (Xm), la desviación estándar (S) y el coeficiente de variación (CV <= 2 %).
- Se realizó un análisis de varianza multifactorial para analizar la influencia de los factores concentración y día en la variabilidad de los resultados, para ello se utilizó un estimador que es el lnR2 (donde R son los residuales), con un nivel de confianza de 95 %.
e) Exactitud (veracidad)
Se pesó con exactitud aproximadamente 1 g de excipiente, se le añadió MBr, se homogeneizó y se procedió según la muestra de ensayo. Se utilizaron tres concentraciones diferentes de MBr (inferior, media y superior del intervalo especificado). El análisis se realizó por triplicado. Se realizó una prueba t-student para determinar si el valor medio hallado y el valor considerado verdadero no difieren significativamente para un a = 0,05. También se calculó el porcentaje de recobrado y con ello se obtuvo un análisis de varianza unifactorial para analizar la influencia de la concentración.
f) Intervalo
Se realizaron tres réplicas de excipiente con 0,7 mg/L, 1,5 mg/L y 2,3 mg/L de MBr, siguiendo el mismo diseño del estudio de la exactitud y se comprobó en ellas los criterios de exactitud, precisión y linealidad, como se ha descrito en cada acápite.
g) Límite de detección y cuantificación
Los límites de detección y de cuantificación, respectivamente, se determinaron mediante el diseño de relación señal-ruido, para lo cual se procedió al análisis repetido del excipiente. Una vez obtenido el cromatograma, se delimitó dentro de la línea base un periodo de tiempo veinte veces la anchura en la base del pico de MBr. Para el cálculo se procedió según la ecuación (4):
Pruebas de adecuación del sistema
La repetibilidad de los tiempos de retención presenta un coeficiente de variación de 0,31 %, menor que el 1 %. El número de platos teóricos de la columna utilizada es de 14 527, mucho mayor que 5 000. El factor de resolución entre el pico de G-1 y MBr es 6,6, mucho mayor que 1,5. La simetría del pico de MBr es de 1,05, se encuentra en el intervalo entre 0,8 y 1,5; por tanto, el sistema cromatográfico a emplear es adecuado para su utilización en este método de ensayo.
Especificidad
A continuación se exponen los cromatogramas registrados durante el estudio de la especificidad (figuras 1-8).
En todos los casos se observa que no hay ningún pico cromatográfico adicional no suficientemente resuelto del pico correspondiente al MBr, por lo que se concluye que el método en las condiciones estudiadas es específico.
Linealidad
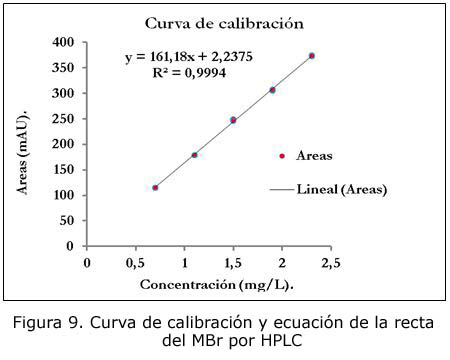
Los valores experimentales que corresponden a la curva de calibración, así como los parámetros para evaluar la calidad de la regresión se muestran en la tabla 1 y en la figura 9.
TABLA 1. VALORES EXPERIMENTALES OBTENIDOS PARA LA
CURVA DE CALIBRACIÓN DE MBR
| Conc. (mg/L) | Área 1 | Área 2 | Área 3 |
| 0,7 | 115,00 | 114,75 | 114,85 |
| 1,1 | 178,95 | 178,50 | 178,20 |
| 1,5 | 246,85 | 249,25 | 245,65 |
| 1,9 | 305,13 | 304,65 | 307,30 |
| 2,3 | 373,10 | 375,10 | 372,75 |
Del análisis de la regresión y la linealidad se obtiene que:
- El coeficiente de correlación es de 0,999 7 con un coeficiente de determinación igual a 0,999 4, por lo que existe una correlación positiva entre la concentración y el área determinada superior al 99,9 %.
- El CVf = 0,96 %, por tanto, se cumple que CVf <= 5 %, lo que significa que existe linealidad en los datos obtenidos.
- La pendiente (b) es de 161,18 y la varianza de la pendiente (Sb2) es de 1,199 7, por lo que el método posee una buena sensibilidad.
- La desviación estándar de la pendiente (Sb) es de 1,1 y la desviación estándar relativa (Sb rel. %) es igual a 0,68 %.
- Los límites de confianza para ttab = 2,16, con n-2 grados de libertad y a = 0,05, se encuentran entre 158,81 y 163,55.
- Para determinar el grado de significación, la texp = 147,16, de esta manera se acepta H1: b ≠ 0, por lo que existe regresión, la probabilidad de que b ≠ 0 es superior al 95 %.
Del análisis de la proporcionalidad se obtiene que:
- Los límites de confianza de a para ttab = 2,16 (n-2; a = 0,05), se encuentran entre -1,56 y 6,03, por tanto, incluyen al 0 y cumplen la condición de proporcionalidad.
- Para determinar el grado de significación, la texp = 1,27, de esta manera se acepta H0, la recta pasa por el eje de coordenadas y se puede obviar el valor de a en la ecuación de regresión.
Los parámetros calculados para evaluar la calidad de la regresión cumplen con los criterios de aceptación correspondientes, lo que indica que la técnica es lineal en el intervalo de concentraciones estudiado.
Precisión
La variabilidad de la respuesta, expresada como coeficiente de variación, es menor del 1 %, con una adecuada correspondencia entre las respuestas obtenidas para las inyecciones repetidas (tabla 2).
TABLA 2. RESULTADOS DE LA REPETIBILIDAD INSTRUMENTAL
| Inyecciones | Áreas | Parámetros estadísticos |
| 1 | 252,8 | Xm = 253,97 S = 1,04 CV = 0,41 % |
| 2 | 254,0 | |
| 3 | 254,3 | |
| 4 | 254,4 | |
| 5 | 252,8 | |
| 6 | 255,5 |
Dicho resultado demostró que con este procedimiento es posible minimizar los errores potenciales asociados a la inyección manual de las muestras, y con ello conseguir la precisión instrumental requerida. En consecuencia, para todas las determinaciones realizadas en este trabajo, se sigue el procedimiento de inyectar cada muestra por duplicado y utilizar para los cálculos el valor medio de la respuesta para ambas inyecciones.
TABLA 3. RESULTADOS DE LA REPETIBILIDAD DEL MÉTODO
| Réplicas | Áreas | Parámetros estadísticos |
| 1 | 251,2 | Xm = 250,30 S = 2,30 CV % = 0,92 % |
| 2 | 249,1 | |
| 3 | 249,4 | |
| 4 | 246,8 | |
| 5 | 252,8 | |
| 6 | 252,5 |
En todos los casos, tanto en los diferentes días, como a las diferentes concentraciones, se obtienen valores de coeficiente de variación menores de 2 % y el CV total de la precisión intermedia es para cada concentración inferior al doble del CV de la repetibilidad del método (tabla 4).
TABLA 4. RESULTADOS DE LA PRECISIÓN INTERMEDIA
| Día 1 | Conc. (mg/L) | 0,7 | 1,5 | 2,3 |
| Áreas | 113,6 | 246,8 | 373,3 | |
| 116,4 | 246,9 | 372,9 | ||
| Parámetros estadísticos | Xm = 115,00 S = 1,98 CV = 1,72 % | Xm = 246,85 S = 0,07 CV = 0,03 % | Xm = 373,10 S = 0,28 CV = 0,08 % | |
| Día 2 | Áreas | 115,7 | 249,4 | 372,4 |
| 113,8 | 249,1 | 377,8 | ||
| Parámetros estadísticos | Xm = 114,75 S = 1,34 CV = 1,17 % | Xm = 249,25 S = 0,21 CV = 0,09 % | Xm = 375,1 S = 3,28 CV = 1,02 % | |
| Día 3 | Áreas | 113,7 | 244,7 | 377,1 |
| 116 | 246,6 | 368,4 | ||
| Parámetros estadísticos | Xm = 114,85 S = 1,63 CV = 1,42 % | Xm = 245,65 S = 1,34 CV = 0,55 % | Xm = 372,75 S = 6,15 CV = 1,65 % | |
| Total por concentración | Xm = 114,87 S = 1,30 CV = 1,13 % | Xm = 247,25 S = 1,75 CV = 0,71 % | Xm = 373,65 S = 3,43 CV = 0,92 % | |
Los resultados del análisis de varianza multifactorial para analizar la influencia de los factores concentración y día en la variabilidad de los resultados se presentan en la tabla 5.
TABLA 5. PRECISIÓN INTERMEDIA. RESULTADO DEL ANÁLISIS DE VARIANZA DEL LNR2
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrado medio | Razón F | Significación de F |
| Efectos principales |
|
|
|
|
|
| A: Día | 36,464 5 | 2 | 18,232 3 | 3,41 | 0,079 1 |
| B: Conc | 19,970 2 | 2 | 9,985 1 | 1,87 | 0,209 9 |
| Interacciones |
|
|
|
|
|
| AB | 29,907 7 | 4 | 7,476 92 | 1,40 | 0,309 8 |
| Errores o residuales | 48,154 9 | 9 | 5,350 54 |
|
|
| Suma total de errores | 134,497 | 17 |
|
|
|
Como los valores de p son mayores que 0,05, no existe influencia de los factores día y concentración en la variabilidad de la respuesta (área) en el método de ensayo.
Teniendo en cuenta los resultados obtenidos para la repetibilidad y precisión intermedia se concluye que este método de ensayo es preciso en las condiciones estudiadas.
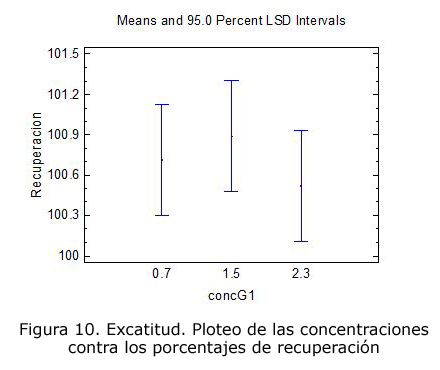
Exactitud
En los tres niveles de concentración se obtuvieron porcentajes de recuperación entre 98 % y 102 % (criterio aceptado para métodos cromatográficos) y en los tres casos la texp es menor que la ttab para n-1 grados de libertad y p = 0,05, lo cual significa que los valores obtenidos a las tres concentraciones no son estadísticamente diferentes de los valores teóricos (tabla 6).
TABLA 6. RESULTADOS DE LA EXACTITUD A TRES NIVELES DE CONCENTRACIÓN
| Concentraciones | 0,7 mg/L | 1,5 mg/L | 2,3 mg/L |
| Áreasobtenidas | 115,5 | 246,0 | 375,9 |
| 116,4 | 247,5 | 374,7 | |
| 115,7 | 245,0 | 374,0 | |
| Conc.calculada (mg/L) | 0,703 | 1,512 | 2,318 |
| 0,708 | 1,522 | 2,311 | |
| 0,704 | 1,506 | 2,307 | |
| Conc.media calculada | 0,704 98 | 1,513 40 | 2,311 88 |
| S | 0,002 93 | 0,007 81 | 0,005 96 |
| CV % | 0,415 90 | 0,515 85 | 0,257 87 |
| ttab | 4,303 | ||
| texp | 2,94 | 2,97 | 3,45 |
| % recuperación | 100,39 | 100,82 | 100,80 |
| 101,18 | 101,44 | 100,47 | |
| 100,56 | 100,41 | 100,28 | |
Los resultados del análisis de varianza realizado se encuentran en la tabla 7 y en la figura 10.
TABLA 7. EXACTITUD. ANÁLISIS DE VARIANZA
| Fuente | Suma de | Grados de | Cuadrado | Razón F | Significación |
| Entre grupos | 0,209 156 | 2 | 0,104 578 | 0,61 | 0,572 0 |
| Dentro de grupos | 1,022 07 | 6 | 0,170 344 |
|
|
| Suma total de errores | 1,231 22 | 8 |
|
|
|
Como el valor de p es mayor que 0,05, no existe influencia del factor concentración en los valores de porcentajes de recuperación.
Intervalo
Se escogió el intervalo de 0,7 mg/L a 2,3 mg/L, ya que para determinaciones d e impurezas se debe incluir el 120 % de la especificación (1 % en el caso del MBr en el Dermofural). Se realizaron tres réplicas de excipiente con 0,7 mg/L, 1,5 mg/L y 2,3 mg/L de MBr y se comprobaron los criterios de exactitud, precisión y linealidad como se ha descrito en cada acápite correspondiente. En la figura 11 y en la tabla 8 se muestran la curva de calibración y el análisis estadístico realizado para precisión y exactitud, respectivamente.
TABLA 8. INTERVALO. ANÁLISIS ESTADÍSTICO PARA PRECISIÓN Y EXACTITUD
| Conc. (mg/L) | 0,7 | 1,5 | 2,3 |
| Áreas | 115,0 | 245,65 | 375,1 |
| 114,75 | 249,25 | 372,75 | |
| 115,85 | 246,85 | 373,1 | |
| Conc.calculada (mg/L) | 0,695 | 1,502 | 2,303 |
| 0,693 | 1,525 | 2,288 | |
| 0,700 | 1,510 | 2,290 | |
| Conc.media calculada | 0,695 89 | 1,512 33 | 2,293 83 |
| S | 0,003 57 | 0,011 33 | 0,007 84 |
| CV % | 0,512 31 | 0,749 39 | 0,341 74 |
| ttab | 4,303 | ||
| texp | 2,00 | 1,88 | 1,36 |
| % recuperación | 99,24 | 100,16 | 100,12 |
| 99,02 | 101,65 | 99,49 | |
| 99,10 | 100,66 | 99,58 | |
Como se observa, existe un coeficiente de determinación igual a 0,999, lo cual indica que se establece una correlación positiva entre la concentración y el área determinada superior al 99,9 %. Para las tres concentraciones, los CV son menores de 1 %, indicativo de la precisión de los resultados. Los porcentajes de recuperación se encuentran cercanos al 100 % y en los tres casos la texp es menor que la ttab para n-1 grados de libertad y p = 0,05, lo cual significa que los valores obtenidos a las tres concentraciones no son estadísticamente diferentes de los valores teóricos. Por lo que se cumple en cada uno de los niveles seleccionados con los criterios de linealidad, precisión y exactitud.
Determinación del límite de detección y cuantificación
Los límites de detección y de cuantificación para la determinación de MBr por HPLC se determinaron mediante análisis repetidos del excipiente, y son expresados por las ecuaciones (5) y (6), respectivamente:
Límite de detección: 0,01 mg/L 
Límite de cuantificación: 0,04 mg/L 
Por lo que se puede cuantificar la impureza MBr en el Dermofural cuando se encuentre por encima de un 0,03 %.
CONCLUSIONES
El método de ensayo para la determinación del contenido de monobromado en el Dermofural por cromatografía líquida de alta eficacia, fase inversa, utilizado para el control de la calidad del Dermofural y para su estudio de estabilidad, resultó ser específico, lineal en el intervalo de concentraciones de 0,7 mg/L a 2,3 mg/L, preciso y exacto, con un límite de detección de 0,1 mg/L y de cuantificación de 0,09 mg/L.
REFERENCIAS BIBLIOGRÁFICAS
1. CENTRO PARA EL CONTROL ESTATAL DE LA CALIDAD DE LOS MEDICAMENTOS, Validación de Métodos analíticos, Regulación No. 41-2007, La Habana, MINSAP, 2007.
2. AGUIRRE ORTEGA, L., et al., Validación de métodos analíticos, España, Ed. A. E. F. Industria, 2001.
3. INTERNATIONAL CONFERENCE ON HARMONISATION (ICH), Guideline on Validation of Analytical Procedures: Definitions and Terminology Availability, ICH Harmonised Tripartite Guideline, VIII, Federal Register, FDA, USA, 1995, 60(40), 11260.
4. International Conference on Harmonisation (ICH) of Technical Requirements for the Registration of Pharmaceuticals for Human Use, Validation of analytical procedures: Text and Methodology, Q2(R1), Geneva, ICH, 2005.
5. OFICINA NACIONAL DE NORMALIZACIÓN, Guía para la validación de métodos de ensayos químicos para alimentos, NC TS 368, La Habana, 2010.
6. ZUNICA-RAMAJO, L. R.; ROMER, R., "Un modelo para el estudio de efectos sobre la dispersión en ausencia de replicaciones", Estadística española, 1998, 116, 55–74.
Recibido: 5/09/2014
Aceptado: 03/12/2014
MSc. Yaidel A. Quiñones-García, Centro de Bioactivos Químicos, Universidad Central "Marta Abreu" de Las Villas, Villa Clara, yaidelq@uclv.edu.cu