My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Química
On-line version ISSN 2224-5421
Rev Cub Quim vol.29 no.3 Santiago de Cuba Sept.-Dec. 2017
ARTICULOS
Actividad antibacteriana de fracciones obtenidas de las hojas de Cassia uniflora frente a Staphylococcus aureus resistente a la meticilina
Antibacterial activity of fractions obtained from Cassia uniflora leaves against methicillin-resistant Staphylococcus aureus
MSc. José Angel Morales LeónI, Dr. C. Quirino Arias CedeñoI, Dr. C. Eugenio Torres RodríguezI, Dr. C. Alejandro Alarcón ZayasII, MSc. Orlando R. Sariego TamayIII
ICentro de Estudios de Química Aplicada. Universidad de Granma, Cuba, jmorales@udg.co.cu
IIDepartamento de Química. Universidad de Granma. Cuba
IIIDepartamento de Ingeniería Forestal. Universidad de Granma. Cuba
RESUMEN
En este trabajo se determina la actividad antibacteriana frente a Staphylococcus aureus resistente a la meticilina y la composición fitoquímica de fracciones bioactivas, obtenidas a partir de las hojas de Cassia uniflora. Se prepararon 8 fracciones mediante cromatografía de columna, a partir del extracto clorofórmico de las hojas que fueron sometidas a determinaciones de la actividad antibacteriana por el método de Bauer-Kirby y de la composición fitoquímica mediante tamizaje fitoquímico, cromatografía de capa delgada y espectroscopias UV e IR. Dos fracciones presentaron actividad antibacteriana frente a Staphylococcus aureus resistente a la meticilina. Los metabolitos secundarios asociados a la actividad biológica pudieran ser flavonoides y cumarinas. Los espectros UV e IR y la comparación del espectro IR de la fracción más activa con una base de datos con más de 100 000 compuestos, sugieren que el componente activo puede ser una cumarina, específicamente una aminocumarina.
Palabras clave: actividad antibacteriana, Staphylococcus aureus, meticilina, Cassia uniflora, metabolitos secundarios.
ABSTRACT
In this work the antibacterial activity against Staphylococcus aureus resistant to methicillin was determined and the phytochemical composition of bioactive fractions was obtained from Cassia uniflora leaves. Eight fractions were prepared by column chromatography from the chloroform extract of the leaves, which were subjected to determinations of the antibacterial activity by the Bauer-Kirby method and the phytochemical composition by phytochemical screening, thin layer chromatography and UV and IR spectroscopies. Two fractions showed antibacterial activity against Staphylococcus aureus resistant to methicillin. Secondary metabolites associated with biological activity could be flavonoids and coumarins. UV and IR spectra and comparison of the IR spectrum of the most active fraction with a database with more than 100,000 compounds suggest that the active component may be a coumarin, specifically an aminocoumarin.
Keywords: antibacterial activity, Staphylococcus aureus, methicillin, Cassia uniflora, secondary metabolites.
INTRODUCCIÓN
Estudios de bioactividad realizados a extractos de las hojas de Cassia uniflora, demostraron actividades analgésica, antinflamatoria y antiartrítica asociadas a determinados componentes fitoquímicos [1]. Otros evidenciaron que la propiedad invasiva y dominante de esta planta está ligada a componentes aleloquímicos de las hojas con actividad fitotóxica, capaz de inhibir la germinación de semillas y el crecimiento de plantones de otras especies y con la actividad larvicida frente a Aedes aegypti [2, 3].
En las hojas de C. uniflora se han encontrado terpenoides, esteroides, flavonoides, aceites esenciales amargos y purgantes, antocianidinas, fenoles, taninos, compuestos, quinonas y cumarinas [4]. Algunos de estos metabolitos secundarios están relacionados con la actividad antibacteriana de varias plantas [5].
Roig [6] informó que C. uniflora ha sido usada de forma empírica en el tratamiento de erupciones cutáneas que pueden ser de origen bacteriano. El impétigo es una de estas alteraciones y una de sus causas más importantes es la infección provocada por Staphylococcus aureus resistente a la meticilina [7].
MATERIALES Y MÉTODOS
Material vegetal
Las hojas de plantas adultas de C. uniflora fueron seleccionadas y procesadas según NRSP 309 [8]. Con posterioridad se desinfectaron mediante una limpieza con agua potable y remojo en una disolución de hipoclorito de sodio al 2 % [4]. Luego, las hojas se secaron y fue obtenido un polvo a partir de ellas.
Extracto y fracciones
10 g del polvo de las hojas se introdujeron en un balón de 250 mL cubierto con papel y se adicionaron 50 mL de cloroformo, se tapó y agitó en zaranda a 60 rpm durante 24 h. El extracto preparado se dejó reposar durante 2 h (T= 4-8 °C) y después se filtró a presión reducida. El filtrado obtenido se concentró hasta sequedad en un evaporador rotatorio y fue usado en cromatografía de capa delgada (CCD), con el fin de fijar una proporción adecuada de solventes para la separación de los componentes fitoquímicos del extracto. La CCD sirvió como cromatografía preparativa. Una alícuota del extracto se depositó en la placa y se realizó la corrida utilizando una mezcla tolueno-acetato de etilo 3:1 (v/v) como fase móvil. La separación de los componentes se observó bajo luz visible (vis.) y UV ( λ =365 nm).
Las fracciones fueron obtenidas mediante cromatografía de columna (CC), empleando como fase estacionaria gel de sílice. Las fases móviles se prepararon teniendo en cuenta los resultados en la cromatografía preparativa, usando 3 mezclas tolueno-acetato de etilo (v/v) para conformar un gradiente de polaridad creciente (3:1, 1:1, 1:3). 10 mL del extracto clorofórmico seco redisuelto en tolueno-acetato de etilo 3:1 (v/v) se vertió por las paredes de la columna. Por cada componente del gradiente de polaridad se eluyeron dos volúmenes de columna. La colección de las fracciones se realizó considerando la resolución del cromatograma obtenido en CCD. Las fracciones colectadas fueron monitoreadas mediante CCD.
Ensayos antibacterianos
La actividad antibacteriana fue determinada por el método de Bauer-Kirby [9]. Se utilizó una cepa salvaje de S. aureus aislada en el Laboratorio de Microbiología del Hospital Provincial Clínico Quirúrgico "Celia Sánchez" de Manzanillo, Cuba.
Las fracciones fueron evaporadas hasta sequedad y redisueltas en dimetilsulfóxido (DMSO). La concentración final en los discos fue de 2,5 mg/disco.
Se aplicó un tratamiento con 3 réplicas, utilizando como control negativo DMSO, y como controles positivos los antibióticos comerciales meticilina y ciprofloxacino. La meticilina se usó para determinar la resistencia de la cepa de S. aureus. La variable medida fue diámetro del halo de inhibición (DI) (mm) y los resultados se informaron como el promedio del diámetro de los halos de inhibición.
Composición fitoquímica
Teniendo en cuenta datos reportados [4] fue aplicado un conjunto de métodos específicos estandarizados de tamizaje fitoquímico [10], para la determinación de los grupos de metabolitos secundarios presentes en las fracciones activas contra S. aureus. Los resultados obtenidos fueron corroborados mediante espectroscopias UV e IR. Los espectrogramas UV fueron procesados a través del software UV2100 Aplication (Rayleigh, China) y se interpretaron utilizando una base de datos en línea [11]. La interpretación del espectro IR se realizó empleando tablas de correlación [12] y fue confirmada mediante comparaciones con una base de datos con espectros IR de más de 100 000 compuestos [13].
RESULTADOS Y DISCUSIÓN
En la tabla 1 están reflejados los valores de R f y los colores de las fracciones de elusión obtenidas en CC. El monitoreo mediante CCD permitió unir los volúmenes de elución colectados con R f similares para formar las fracciones finales.
TABLA 1. Rf Y COLORES DE LAS FRACCIONES DE ELUSIÓN OBTENIDAS
| Fracciones | Rf | Colores | ||
| Líquido (vis.) | CCD | |||
| vis. | UV (λ=365 nm) | |||
| F1 | 0,971 0 | Amarillo | Amarillo | Blanco |
| F2 | 0,862 0 | Verde oscuro | Verde | Marrón |
| F3 | 0,836 3 | Verde | Verde-azul | Rosado intenso |
| F4 | 0,763 6 | Marrón | Verde claro | Anaranjado |
| 0,600 0 | Amarillo claro | Amarillo | ||
| 0,518 1 | Blanco-amarillo | Azul claro | ||
| 0,472 7 | Amarillo | Rosado | ||
| F5 | 0,518 1 | Verde-amarillo | Verde limón | Azul |
| F6 | 0,526 7 | Anaranjado intenso | Amarillo | Rosado azulado |
| F7 | 0,423 1 | Anaranjado | Rosado claro | Marrón |
| 0,399 7 | Carmelita claro | Rojo-marrón | ||
| F8 | 0,362 3 | Anaranjado claro | Amarillo | Rosado |
| 0,352 6 | Amarillo claro | Rosado | ||
Los diferentes colores observados en vis. y 365 nm demuestran la existencia de varias sustancias. La CCD mostró que F1 y F5 pudieran estar formadas por un componente (figura 1). El resto de las fracciones constituyen mezclas.
Los resultados de la actividad antibacteriana mostraron que S. aureus desarrolló resistencia frente al control meticilina, mientras que el antibiótico ciprofloxacino y 2 fracciones de elusión presentaron actividad (tabla 2).
TABLA 2. ACTIVIDADANTIBACTERIANA DE LAS FRACCIONES DE ELUSIÓN FRENTE A S. aureus
| Fracciones | Concentración (µg/disco) | DI (mm) |
| F1 | 2,5 | - |
| F2 | 2,5 | - |
| F3 | 2,5 | - |
| F4 | 2,5 | 10,6± 0,6 |
| F5 | 2,5 | 16,6± 0,6 |
| F6 | 2,5 | - |
| F7 | 2,5 | - |
| F8 | 2,5 | - |
| Ciprofloxacino | 5 | 18± 0,6 |
| Meticilina | 30 | - |
(-): No presentó actividad.
La meticilina es un antibiótico ß-lactámico. La resistencia de S. aureus frente a este antibiótico está asociada a la adquisición de un gen no nativo que codifica una proteína de unión a penicilina (PBP2a) con una afinidad menor por ß-lactamas. Esta resistencia permite la biosíntesis de la pared celular, el blanco de ß-lactamas, para continuar incluso en presencia de concentraciones inhibidoras típicas de antibiótico [14].
Según los datos obtenidos el componente activo se encuentra en F4 y F5. Los resultados de la actividad antibacteriana sugieren una mayor concentración en F5, demostrando la existencia de dosis-dependencia. Por tanto, F4 puede ser considerado como F5 contaminado.
Es interesante la relación de los DI de los productos activos con las concentraciones utilizadas. La concentración del antibiótico es 2 veces superior a la de las fracciones, sin embargo, la diferencia entre los DI del ciprofloxacino y la fracción más activa no es relevante, demostrando la potencia del producto natural frente a S. aureus. Este es un resultado alentador, pues no son frecuentes DI de extractos de plantas similares a los de antibióticos [15].
El tamizaje fitoquímico de las fracciones antibacterianas sugiere que los componentes activos de las hojas pueden ser flavonoides y cumarinas, con mayor incidencia en estas últimas pues en F5 no se encontraron flavonoides (tabla 3).
TABLA 3. TAMIZAJE FITOQUÍMICO DE LAS FRACCIONES ANTIBACTERIANAS
| Metabolitos | F4 | F5 |
| Cumarinas | ++ | ++ |
| Fenoles y/o taninos | - | - |
| Quinonas | - | - |
| Flavonoides | + | - |
(-): ausente, (+): presente; (++): abundante
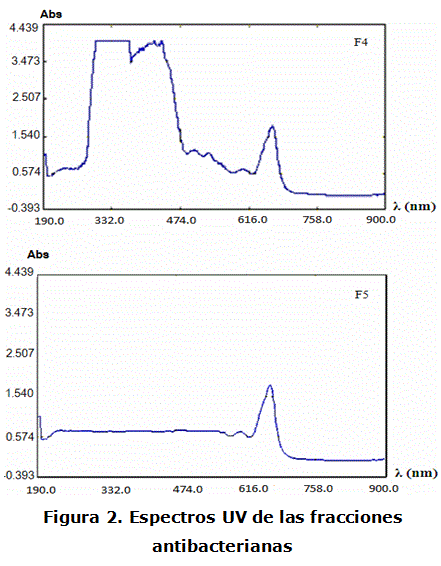
F4 y F5 fueron sometidas a ensayos espectroscópicos en UV. Los espectros obtenidos aparecen en la figura 2.
En el espectro UV de F4 aparecen 13 máximos de absorción con distintos valores de absorbancia (tabla 4), por tanto, puede ser una mezcla de varios compuestos. Están delimitadas 2 áreas de absorción, una entre 196 y 422 nm con 4 picos principales que se encuentran dentro de la zona de absorción de los flavonoides [16]; y la otra entre 522 y 850 nm, con un pico de absorción intenso a 666 nm, visible también en el espectro de F5. Considerando el resultado del tamizaje fitoquímico, esta señal pudiera corresponder a una cumarina muy conjugada pues presenta un corrimiento batocrómico que puede estar relacionado con efectos combinados de dobles enlaces adicionales, sustituyentes como el –NH2, efectos del solvente y condensación [17-19].
TABLA 4. MÁXIMOS DE ABSORCIÓN Y VALORES DE ABSORBANCIA
REGISTRADOS EN LOS ESPECTROS UV DE F4 Y F5
| Picos | λ (nm) | Absorbancia |
| 1 | 900,00 | 0,045 5 |
| 2 | 666,00 | 1,802 9 |
| 3 | 604,00 | 0,691 6 |
| 4 | 534,00 | 1,114 1 |
| 5 | 504,00 | 1,1855 |
| 6 | 436,00 | 4,0000 |
| 7 | 422,00 | 3,975 5 |
| 8 | 392,00 | 3,803 9 |
| 9 | 302,00 | 4,000 0 |
| 10 | 260,00 | 0,730 7 |
| 11 | 250,00 | 0,727 4 |
| 12 | 234,00 | 0,730 2 |
| 13 | 196,00 | 1,060 2 |
Fuente: Espectrogramas UV de F4 y F5.
En la figura 3 aparece el espectro IR obtenido para F5, indicando las bandas de absorción (v, cm-1).
F5: IR (KBr) (vmáx, cm-1) 3 630 (OH) ancha, 3 080 (-CH=) (aromáticos), 1 715 (C=O) (aromático), 1 185 (C-O-C), 1 720-1 950, 750 (Ar) tonos armónicos.
La existencia de bandas superpuestas a 3 080 y 1 715 cm-1 pueden ser consecuencia de la presencia de varios grupos C=O; los tonos armónicos (1 720-1 950 y 750 cm-1) son característicos de anillos aromáticos polisustituidos. La banda ancha (OH) es propia de los grupos involucrados en puentes de hidrógeno intramoleculares. El doblete de Ferming en 3 000-2 900 cm-1 revela la presencia del grupo –NH2 como sustituyente en anillos aromáticos, por lo que pudiera tratarse de una aminocumarina (tabla 5). Estos datos y la aparición de la banda C-O-C ayudan a confirmar que F5 contiene los elementos principales de la estructura base de las cumarinas.
Tabla 5. BANDAS DE ABSORCIÓN EN EL ESPECTRO IR DE F5 (v, cm-1) ASIGNADAS
A GRUPOS FUNCIONALES
| Grupo funcional | OH | -CH= | -NH2 |
|
C=O | C-O-C | -N(CH3)n |
| n (cm-1) | 3 630 | 3 080 | 3 000-2 900 | 1 720-1 950, 750 | 1 715 | 1 185 | 1 210 |
El espectro IR de F5 se introdujo en una base de datos con más de 100 000 compuestos, para realizar una comparación basada en los valores de la distancia euclidiana y ratificar la asignación de las señales a los grupos funcionales. Las mayores aproximaciones se obtuvieron en 4 casos (figura 4).
Las aproximaciones obtenidas sugieren la presencia de la agrupación C-O-C=O en la estructura de F5 (figuras 4a y 4b), así como de grupos nitrogenados probablemente contenidos en la agrupación -N(CH3)n, con n=1, 2 (figuras 4c y figura 4d).
Los datos IR revelan que F5 presenta los grupos funcionales característicos del esqueleto 2 H -1-benzopiran-2-ona, concordando con estudios realizados que refieren que muchas cumarinas naturales y sintéticas, incluidas las aminocumarinas, contienen grupos OH, libres o combinados [20-22]. Es probable que las señales registradas en la huella dactilar de la molécula (por debajo de los 1 500 cm-1) pertenezcan a anillos aromáticos condensados, fenoles prenilados, unidades isoprenoides sustituyentes o grupos glicosídicos unidos al anillo cumarínico.
Los espectros UV e IR obtenidos confirman los resultados del tamizaje fitoquímico y permiten prever que el componente antibacteriano detectado en las hojas de C. uniflora sea una cumarina, específicamente una aminocumarina. Los resultados de actividad antibacteriana del componente activo coinciden con otros en los que se ha demostrado la actividad de las cumarinas y sus derivados frente a S. aureus [23], donde se destacan las aminocumarinas novobiocina, clorobiocina y coumermicina A1 por su potente efecto inhibidor sobre la girasa bacteriana [24].
CONCLUSIONES
Fueron obtenidas 8 fracciones de elusión a partir de un extracto clorofórmico de las hojas de C. uniflora. De ellas, 2 resultaron activas frente a una cepa de S. aureus resistente a la meticilina. Los metabolitos secundarios asociados a la actividad biológica pudieran ser flavonoides y cumarinas, con mayor relevancia para estas últimas. Los datos espectroscópicos UV e IR conllevan a considerar que el componente activo pueda ser una cumarina, específicamente una aminocumarina.
AGRADECIMIENTOS
Ofrecemos nuestro agradecimiento al Servicio Alemán de Intercambio Académico (DAAD) por el apoyo técnico-material brindado en la realización de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. CHAUDHARI, S. S.; CHAUDHARI, S. R.; CHAVAN, M. J. "Analgesic, anti-inflammatory and anti-arthritic activity of Cassia uniflora Mill". Asian Pac J Trop Biomed. 2012, 2(1), S181-6.
2. GHAYAL, N.; PADHYE, A.; DHUMAL, K. "Larvicidal activity of invasive weeds Cassia uniflora and Synedrella nodiflora". Int J Pharma Bio Sci. 2010, 1(3), 1-10. ISSN 0975-6299.
3. VITONDE, S.; THENGANE, R. J.; GHOLE, V. S. "Allelopathic effects of Cassia tora and Cassia uniflora on Parthenium hysterophorous L". J Med Plants Res. 2014, 8(4), 194-196. ISSN 1996-0875.
4. MORALES LEÓN, J. A.; FONSECA GARCÍA, A.; ALMEIDA SAAVEDRA, M.; MORALES TORRES, G.; TORRES RODRÍGUEZ, E. "Tamizaje fitoquímico de Cassia uniflora Mill". Rev Cub Plant Med. 2011, 16(4), 331-336. ISSN 1028-4796.
5. COMPEAN, K. L.; YNALVEZ, R. A. "Antimicrobial Activity of Plant Secondary Metabolites: A Review". Res J Med Plant. 2014, 8(5), 204-213. ISSN 1819-3455.
6. ROIG MESA, J. T. Diccionario botánico de nombres vulgares cubanos. 4ta ed. La Habana: Editorial Científico-Técnica. 2014. ISBN 959-05-0712-3.
7. LADHANI, S.; JOANNOU, C. L.; LOCHRIE, D. P.; EVANS, R. W.; POSTON, S. M. "Clinical, microbial, and biochemical aspects of the exfoliative toxins causing staphylococcal scalded-skin syndrome". Clinical microbiology reviews. 1999, 12(2), 224–242.
8. MINISTERIO DE SALUD PÚBLICA. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana: MINSAP, 1992.
9. BAUER, A. W.; KIRBY, W. M. M.; SHERRIS, J. C.; TURCK, M. "Antibiotic susceptibility testing by a standardized single disk method". Amer Clin Pathol. 1966, 45, 493-6.
10. THANGARAJ, P. "Extraction of Bioactive Compounds". En: Pharmacological Assays of Plant-Based Natural Products . Switzerland: Springer International Publishing; 2016. vol. 71, p. 188. ISBN 978-3-319-26810-1.
11. NATIONAL INSTITUTE OF STANDARDS AND TECNOLOGY. Libro del Web de Química del NIST [en línea]. [Consulta: 14 octubre 2016]. Disponible en: http://webbook.nist.gov/chemistry/
12. UNIVERSITY OF CALIFORNIA. Infrared Spectroscopy Absorption Table - Chemistry LibreTexts [en línea]. [Consulta: 15 octubre 2016]. Disponible en: https://chem.libretexts.org/Reference/Reference_Tables/Spectroscopic_Parameters/Infrared_Spectroscopy_Absorption_Table
13. NATIONAL INSTITUTE OF ADVANCED INDUSTRIAL SCIENCE AND TECHNOLOGY. AIST: Spectral Database for Organic Compounds, SDBS [en línea]. [Consulta: 15 octubre 2016]. Disponible en: http://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi
14. PEACOCK, S. J.; PATERSON, G. K. "Mechanisms of Methicillin Resistance in Staphylococcus aureus". Annual Review of Biochemistry. 2015, 84(1), 577-601. ISSN 0066-4154, 1545-4509.
15. GYAWALI, R.; IBRAHIM, S. A. "Natural products as antimicrobial agents". Food Control. 2014, 46, 412-429. ISSN 0956-7135.
16. SISA, M.; BONNET, S. L.; FERREIRA, D.; VAN DER WESTHUIZEN, J. H. "Photochemistry of Flavonoids". Molecules. 2010, 15(8), 5196-5245. ISSN 1420-3049.
17. YAMAJI, M.; HAKODA, Y.; OKAMOTO, H.; TANI, F. "Photochemical synthesis and photophysical properties of coumarins bearing extended polyaromatic rings studied by emission and transient absorption measurements". Photochem. Photobiol. Sci. 2017, 16(4), 555-563.
18. LIU, X.; COLE, J. M.; LOW, K. S. "Solvent Effects on the UV–vis Absorption and Emission of Optoelectronic Coumarins: a Comparison of Three Empirical Solvatochromic Models". The Journal of Physical Chemistry C . 2013, 117(28), 14731–14741. ISSN 1932-7447, 1932-7455.
19. DONOVALOVÁ, J. et al. " Spectral Properties of Substituted Coumarins in Solution and Polymer Matrices". Molecules. 2012, 17(12), 3259–3276. ISSN 1420-3049.
20. DAVIS, R. A.; VULLO, D.; MARESCA, A.; SUPURAN, C. T.; POULSEN, S. A. "Natural product coumarins that inhibit human carbonic anhydrases". Bioorganic Med Chem. 2013, 21(6), 1539-1543.
21. MOSTAFAVI, H.; NAJJAR, R.; MASKANI, E. "Synthesis and characterization of novel 7-hydroxycoumarin derivatives". Chemistry of Natural Compounds. 2013, 49(3), 423-425.
22. FYLAKTAKIDOU, K. C.; HADJIPAVLOU LITINA, D. J.; LITINAS, K. E.; NICOLAIDES, D. N. "Natural and synthetic coumarin derivatives with anti-inflammatory/antioxidant activities". Current pharmaceutical design. 2004, 10(30), 3813-3833.
23. HOTI, R.; VEHAPI, I.; MULLIQI OSMANI, G.; ISMAILI, H.; VEPRIM, T. "Synthesis of Some New Heteroarylamino-3-Nitro-2H-[1]-Benzopyran-2-ones and their Antibacterial Activity". American Scientific Research Journal for Engineering, Technology, and Sciences. 2016, 22(1), 1-9.
24. HEIDE, L. "New aminocoumarin antibiotics as gyrase inhibitors". International Journal of Medical Microbiology. 2014, 304(1), 31-36. ISSN 14384221.
Recibido: 22/11/2016
Aceptado: 11/03/2017
MSc. José Angel Morales León, Centro de Estudios de Química Aplicada. Universidad de Granma, Cuba, jmorales@udg.co.cu