My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Tecnología Química
On-line version ISSN 2224-6185
RTQ vol.34 no.1 Santiago de Cuba Jan.-Apr. 2014
ARTÍCULO ORIGINAL
Formulación de la vacuna heberpenta-L en un sistema de procesamiento aséptico automático
Formulation of the Heberpenta-L Vaccine in an Automatic Aseptic Processing System
Ing. José Carlos Fraga-GómezI, Dr. Orestes Mayo-AbadII
I:Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba. jose.fraga@biocen.cu
II:Facultad de Ingeniería Química, Instituto Superior Politécnico "José Antonio Echeverría", La Habana, Cuba. omayo@quimica.cujae.edu.cu
RESUMEN
El presente trabajo describe las operaciones realizadas con la finalidad de dedicar el sistema de procesamiento aséptico Steridose, ubicado en la Planta de Productos Parenterales 2 del Centro Nacional de Biopreparados a la formulación de la vacuna polivalente Heberpenta-L. Este proyecto tiene como objetivo aumentar la capacidad de producción ante la creciente demanda de dicho producto. Steridose es un sistema inicialmente diseñado y dedicado a la formulación de la vacuna Antihepatitis B recombinante desde su puesta en marcha en 1999. El cambio de dedicación de este sistema requirió de la validación de las operaciones y los procesos en sus nuevas funciones. Se diseñó el proceso de formulación de forma tal que se realizara todas las adiciones de soluciones y principios activos asépticamente y reduciendo al mínimo el tiempo de exposición del producto en cada paso del procedimiento. El alcance del trabajo se aplica hasta la producción de los tres primeros lotes, los cuales fueron formulados con todos los requerimientos de aseguramiento de calidad establecidos, lo cual queda en evidencia con los resultados conformes de cada uno de los graneles formulados. Esto demuestra también la capacitación del personal y la potencialidad de la planta para afrontar esta producción.
Palabras clave: formulación, principios activos, Heberpenta-L, validación, procesamiento aséptico.
ABSTRACT
The present work describes the operations carried out in order to dedicate the automatic aseptic processing system Steridose, installed in the Parenteral Products Plant 2 at the National Bioproducts center, to formulate the polyvalent Heberpenta-L vaccine. This project objective is to increase the production capacity as a result of the rising demand of such product. Steridose is a system initially designed and dedicated to the formulation of the Anti hepatitis B recombinant vaccine since its start up in 1999. The dedication change of this system required the operations and processes validation in the new functions. The formulation process was designed in such a way that all the solutions and active principles additions were to be performed aseptically and that the exposure time of the product in each step of the procedure was to be reduced to a minimum. El scope of this work applies up to the production of the first three batches, which were formulated complying with all the established quality assurance requirements, made evident by the results obtained on everyone of the formulated bulks. This also demonstrated the personnel's qualification and the potential of the plant to deal with this production.
Keywords: formulation, active principle, Heberpenta-L, validation, aseptic processing.
INTRODUCCIÓN
La vacuna pentavalente Heberpenta-L es una vacuna combinada que contiene las anatoxinas diftérica y tetánica (TD y TT), además de una suspensión de células enteras de Bordetella pertussis, (las cuales han sido previamente inactivadas para minimizar su toxicidad y retener su potencia), el antígeno de superficie del virus de la hepatitis B recombinante purificado (Hb), oligosacáridos sintéticos que representan fragmentos del polisacárido capsular natural de la bacteria Haemophilus influenzae tipo b conjugados a la proteína portadora anatoxina tetánica (Hib-TT). La producción de Heberpenta-L se introdujo en el BioCen en el año 2007 y su introducción tuvo como objetivo desplazar a la vacuna pentavalente conocida como 4 + 1, la cual contenía los mismos principios activos con la diferencia de tener el antígeno del Haemophilus influenzae tipo b en un vial independiente. En ese año se formularon tres lotes de 20 L para la fase de desarrollo de este producto. Entre el 2007 y el 2008 se formularon 7 lotes, todos en botellones, teniendo un tamaño de lote limitado a 20 L.
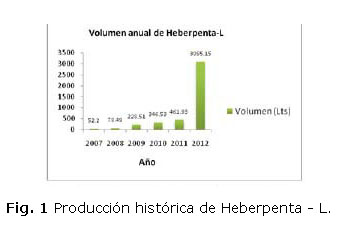
No fue hasta el año 2012 cuando su producción tuvo un aumento considerable de 3 095 L, formulando en 23 graneles, utilizando como sistema de formulación bolsas plásticas agitadas con tamaño de lote máximo de 200 L [1]. Este proyecto tiene como objetivo aumentar la capacidad de producción ante la creciente demanda de dicho producto (ver figura 1).
MATERIALES Y MÉTODOS
Descripción del sistema
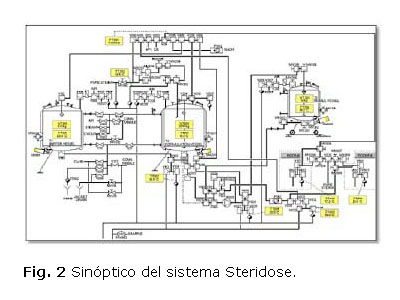
El sistema de procesamiento aséptico "APV Steridose" se diseñó, construyó y calificó para la formulación de la vacuna Antihepatitis B recombinante y está constituido fundamentalmente por tres tanques agitados, dos estacionarios y un móvil, de 200, 300 y 150 L de capacidad respectivamente. El sistema incluye un conjunto de válvulas, bombas, tuberías y otros elementos conectados entre sí, construidos acorde a los requerimientos de un sistema de procesamiento aséptico, que facilitan la realización de las diferentes operaciones que se llevan a cabo para formular la vacuna. Por otra parte, posee un lazo de circulación de la vacuna encargado de enviar el producto por una tubería hacia las líneas de llenado [2].
La interacción entre el operario y el sistema de formulación se realiza desde una computadora que trabaja en ambiente Windows, la misma muestra como pantalla principal un esquema sinóptico del sistema, en el cual se observa el estado de los componentes del mismo según el color: verde en funcionamiento o abierta, amarillo apagado o cerrada, dependiendo de si es una bomba, agitador o válvula. El sistema realiza todas las operaciones de limpieza y esterilización de forma completamente automáticas, teniendo en cuenta que son las operaciones críticas dentro del procesamiento aséptico. Resultan un total de 11 modos automáticos de operación, en los que se incluyen la limpieza y esterilización en el lugar (CIP/SIP) de los tanques y la esterilización de soluciones preparadas (ver figura 2).
Diseño del proceso de formulación
El proceso de formulación de la Heberpenta-L es complejo, en el mismo intervienen diez soluciones y la adsorción de cinco antígenos, tiene una duración de solamente diecinueve horas durante las adsorciones de los principios activos. Dada las características del proceso, constituyó un reto llevar esta formulación a un sistema el cual fue diseñado para un proceso más corto y mucho menos complejo.
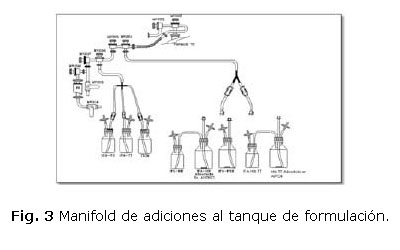
El sistema consta de un manifold para la adición de dos soluciones al tanque de formulación (T2), el mismo está diseñado para poder conectar los sifones a los frascos en un ambiente grado A y luego ensamblarlo al sistema. Con la introducción de la Heberpenta-L es necesario realizar seis adiciones al tanque de formulación. Estas operaciones se hicieron posibles utilizando sifones de adiciones múltiples y conexiones rápidas (CPC). Se establecieron tres adiciones en cada válvula del manifold, una de adiciones cortas para las soluciones de menor volumen y otra de adiciones largas para transferir, desde un ambiente grado A, las soluciones de mayor volumen que pudieran tener una mayor merma durante la transferencia (ver figura 3).
El proceso de formulación en el sistema Steridose se puede dividir en tres etapas: la primera etapa de limpieza y esterilización del sistema, la segunda de preparación de las soluciones en los tanques y por último la formulación, muestreo y en caso de ser necesario la distribución del granel a otros contenedores (bolsas plásticas desechables o botellones).
A continuación se describe en detalle cada uno de los pasos en el proceso:
-
Limpieza (CIP) de los tanques T1 y T2.
-
Conexión del sistema de distribución en la conexión sanitaria.
-
Esterilización (SIP) de los tanques T1 y T2.
-
Prueba de hermeticidad del sistema.
-
Preparación de la suspensión de fosfato de aluminio en T2.
-
Preparación de la suspensión de hidróxido de aluminio en T2.
-
Preparación de la solución tampón de fosfatos en T1.
-
Preparación de la solución tiomersal.
-
Conexión y esterilización de los sistemas de adición múltiples a T2.
-
Distribución de la suspensión de hidróxido de aluminio para la adsorción del antígeno Hb.
-
Adsorción de los antígenos TD y TD en hidróxido de aluminio.
-
Adsorción del antígeno Hb en hidróxido de aluminio.
-
Adición del antígeno Hb adsorbido a T2.
-
Adsorción la suspensión de células enteras de Bordetella pertussis (BP) en hidróxido de aluminio.
-
Adsorción del antígeno Hib-TT en fosfato de aluminio.
-
Adición de la solución de tiomersal y del tampón fosfato.
-
Homogeneización y muestreo.
-
Distribución del granel a bolsas o botellones (opcional en dependencia del destino del producto)
Requerimientos de validación
Como parte de la calificación de desempeño del sistema Steridose, se requiere la calificación de cada ciclo automático que realiza el sistema, en este caso, particularmente los que intervienen en el proceso de formulación de la Heberpenta-L. Los tanques que se utilizan en este proceso son T1 y T2. Por tanto, los modos automáticos que intervienen son los CIP/SIP y esterilización de las soluciones en ambos tanques. Los ciclos automáticos del tanque T1 no sufren ningún cambio en las condiciones de trabajo debido a que la solución tampón utilizada en la formulación es la misma que se utilizaba en la producción para la cual estaba dedicado anteriormente el sistema. Por tanto, las validaciones realizadas a estos ciclos mantienen su vigencia con la nueva producción.
En el caso del tanque de formulación (T2) hay que tener en cuenta la composición del nuevo producto, que en este caso contiene una concentración mayor de aluminio y contiene cuatro antígenos nuevos además del antígeno Hb presente en la antigua producción. Por este motivo, es necesario demostrar la eficacia de la limpieza para la nueva producción. La validación de la limpieza, a diferencia de la validación de los ciclos de esterilización hay que realizarla de manera concurrente, por lo que se hace imposible tener validado este ciclo antes de su nuevo propósito.
Otra validación que se hace necesaria es la calificación del desempeño del sistema para la nueva producción, la misma se realiza simulando el proceso de formulación. Esta es necesaria debido a que la nueva producción es más compleja, intervienen más soluciones y se realizan más conexiones y operaciones críticas y por tanto, no se puede considerar la calificación anterior como "peor caso".
Lotes de consistencia
Con todos los requerimientos de aseguramiento de la calidad cumplidos se decide la formulación de los lotes de consistencia. Estos lotes deben ser al menos tres para poder tener solidez estadística de sus resultados. Por otra parte, producir una cantidad de lotes mayor de la establecida tiene el inconveniente de que estos lotes no se podrán comercializar hasta tanto no lo autorice la entidad regulatoria pertinente. Por esa misma razón el tamaño de lote debe ser el mínimo permitido por el sistema. Es importante señalar que la dedicación del sistema es irreversible, es decir, una vez que se formule el primer lote de Heberpenta-L en Steridose, no se podrá realizar más la antigua producción a la cual estaba dedico el mismo.
RESULTADOS Y DISCUSIÓN
Resultado de la validación de la limpieza del tanque T2
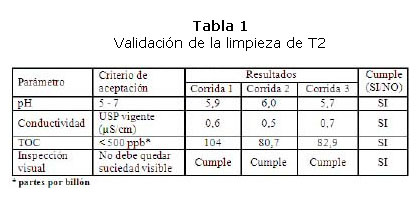
Para la validación de la limpieza del tanque T2 se tomaron muestras del último enjuague realizado después de la formulación de tres lotes. Los resultados de los ensayos se muestran a continuación en la tabla 1 [3]:
Como se puede apreciar, los resultados cumplen con los límites de especificación, quedando demostrado que el procedimiento de limpieza del tanque es adecuado y garantiza la correcta operación de su proceso aséptico. Estos valores son similares a los resultados obtenidos en las validaciones anteriores por lo que la composición del nuevo producto no afecta la calidad.
Los valores obtenidos de conductividad demuestran la ausencia total de restos de las suspensiones de hidróxido y fosfato de aluminio, que en este caso son las más difíciles de arrastrar por la propiedad de adherirse a las paredes del tanque. En este sentido, cabe señalar que los ciclos de limpieza deben ejecutarse inmediatamente después de vaciarse el tanque para facilitar el arrastre durante la limpieza de los residuos del producto.
Resultados de la simulación del proceso con medio de cultivo
Los primeros lotes de simulación de la formulación de la Heberpenta-L en el sistema de procesamiento aséptico se ejecutaron en el año 2009. Al realizarse esta operación por primera vez, fue necesario repetirla tres veces, los resultados de todas las muestras tomadas y de los residuos de los frascos utilizados en ese momento cumplieron con todos los requerimientos establecidos. En los años siguientes se realizó una sola corrida para la revalidación (on going) de la formulación, de igual manera, todos los resultados fueron satisfactorios.
A continuación se muestran los resultados de las pruebas de esterilidad realizadas a todas las muestras tomadas durante la simulación con el medio de cultivo, luego de cumplir con el período de incubación. En la tabla 2 se muestra los resultados de la prueba de retención y en la tabla 3 los resultados de los residuos de los frascos utilizados en la simulación [4].
Tabla2
Verificación de esterilidad de la prueba de retención
| Retención horas | Esterilidad en muestras de granel |
|---|---|
| Retención horas | |
| 12 | Conforme |
| 36 | Conforme |
| 60 | Conforme |
| 84 | Conforme |
| 108 | Conforme |
| 120 | Conforme |
Tabla 3
Verificación de esterilidad de los residuos de la simulación
| Código de la muestra | Identificación de los códigos | Verificación de la esterilidad |
|---|---|---|
| MCF(23/01/13)-TD | Residuo de la simulación del IFA* de TD | Retención horas |
| MCF(23/01/13)-TT | Residuo de la simulación del IFA de TT | Conforme |
| MCF(23/01/13)-P(1) | Residuo de la simulación del IFA de P (frasco 1) | Conforme |
| MCF(23/01/13)-P(2) | Residuo de la simulación del IFA de P (frasco 2) | Conforme |
| MCF(23/01/13)-P(3) | Residuo de la simulación del IFA de P (frasco 3) | Conforme |
| MCF(23/01/13)-P(4) | Residuo de la simulación del IFA de P (frasco 4) | Conforme |
| MCF(23/01/13)-G | Residuo de la simulación del IFA de HB adsorbido | Conforme |
| MCF(23/01/13)-HB | Residuo de la simulación del IFA de HB | Conforme |
| MCF(23/01/13)-Hib | Residuo de la simulación de Hib adsorbido | Conforme |
| MCF(23/01/13)-Tio | Residuo de la simulación del Tiomersal | Conforme |
El resultado conforme de todos los residuos y muestras incubadas demuestran la fiabilidad del procesamiento aséptico durante el proceso de formulación. Se obtuvo un resultado idéntico durante la primera simulación y en las ediciones posteriores.
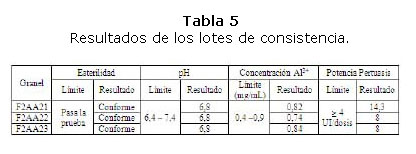
Resultado de los lotes de consistencia
Los lotes de consistencia se formularon entre el 12 y el 19 de noviembre del 2012. El tamaño de lote definido para estos graneles fue de 100 litros. En la tabla 4 se muestra una información general de estos lotes.
Tabla 4
Descripción general de los lotes de consistencia
| Lote | Fecha de formulación | Volumen Real (L) |
|---|---|---|
| F2AA21 | 12/11/2012 | 99.5 |
| F2AA22 | 16/11/2012 | 99.1 |
| F2AA23 | 19/11/2012 | 99.7 |
Los tres lotes cumplieron satisfactoriamente con todos los requisitos de calidad descritos en la especificación del producto. Seguidamente en la tabla 5 se muestran los resultados de los parámetros más importantes, dado por la vulnerabilidad de la calidad del granel por el cambio del sistema de formulación [5-8].
Análisis económico
El impacto económico de este trabajo tiene dos aristas, la primera relacionada con la disminución de los costos asociados al aumento del tamaño de lote y la segunda asociada al aumento de la capacidad de producción, necesaria para poder enfrentar la creciente demanda de este producto.
Descripción de los costos
Existen una serie de costos asociados al trabajo que no varían con la dedicación del sistema a la producción de la Heberpenta-L, los mismos se relacionan a continuación:
1. Costos de ensayos de la validación de la limpieza a T2: La validación de la limpieza de los tanques se realiza con idéntico procedimiento, con frecuencia anual, independientemente a la producción para la cual esté dedicada el sistema.
2. Simulación del proceso: La cantidad de caldo triptona soya utilizada para la simulación de la formulación es igual a la utilizada en la simulación de la producción para la cual estaba dedicada el sistema anteriormente.
3. Materias primas utilizadas en la producción de los lotes de consistencia: La cantidad de materia prima depende solo del volumen de producción.
Evidentemente los costos afectados son los fijos por lote, es decir los que no dependen del volumen del granel. A continuación se enumeran los principales:
1. Insumos relacionados con la preparación del sistema: Agua para inyección (aproximadamente 400 litros por ciclo de limpieza), vapor industrial, vapor limpio.
2. Insumos relacionados con la preparación de materiales: NaOH, HCl, agua para inyección, vapor limpio, electricidad.
3. Ensayos de laboratorios.
El costo de mayor peso es el costo de los ensayos de laboratorio, aunque no se pudieron contabilizar, se relacionan a continuación:
1. Esterilidad
2. Características Organolépticas
3. Contenido de tiomersal
4. Contenido de ión aluminio
5. Contenido de formaldehido
6. pH
7. Potencia de anatoxina diftérica
8. Potencia de anatoxina tetánica
9. Potencia de B. Pertussis
10. Toxicidad específica de la anatoxina tetánica y diftérica.
11. Toxicidad específica de la B. Pertussis.
Como se puede observar son once los ensayos que se realizan al granel para su liberación. De estos, algunos se realizan en el mismo centro, otros en el CIGB1 y la potencia de Pertussis se realiza por duplicado, en el centro y en Argentina.
Todos estos costos, como se explicó anteriormente son fijos por lote de granel, pero para tener una mejor visualización de su importancia se puede ejemplificar tomando como referencia la producción del 2012. En el 2012 se produjeron 3 095 litros de Heberpenta-L, para lo cual fue necesario formular 23 lotes [1]. Formulando con un tamaño de 300 L, para producir el mismo volumen son necesario solo once lotes, reduciendo aproximadamente en un 52 % los costos descritos.
Aumento de la capacidad de producción
Para analizar el aumento de la capacidad de producción es importante señalar que la planta trabaja por campaña, es decir, su producción no es dedicada a la producción de Heberpenta-L, también se producen otros parenterales de alta demanda tales como la vacuna antihepatitis B recombinante, PEG-Heberón, Hebervital, Heberitro, entre otros. Por tanto, el aumento de la capacidad de la planta para la producción de Heberpenta-L tiene además, la importancia de afectar lo menos posible el tiempo de producción de las otros productos, cuyas demandas compiten con el tiempo disponible para la producción de la vacuna Heberpenta-L.
El aumento de la capacidad es de un 50 %, teniendo en cuenta que el tamaño de lote utilizando las bolsas plásticas agitadas era de 200 litros y el actual es de 300 L. De esta manera, formulando 23 lotes (la misma cantidad del 2012 y teniendo en cuenta que el tiempo de formulación de un lote es igual independientemente de su volumen) con un rendimiento en el proceso de 99,6 %, igual al del pasado año, pueden formularse 6 871 L de esta vacuna en igual período. Esto se traduce en aumento de 3 776 L, lo que equivale a más de cinco millones de dosis.
CONCLUSIONES
1. Los resultados de las validaciones de limpieza y la simulación del proceso, garantizan la fiabilidad del procesamiento aséptico durante la producción.
2. Los resultados de los primeros lotes fabricados en el sistema evidencian la consistencia del proceso, dejando el sistema listo para poder cumplir los planes productivos.
3. El sistema se encuentra listo para poder afrontar la creciente demanda de la Heberpenta-L.
BIBLIOGRAFÍA
1. FRAGA GÓMEZ, José Carlos. Reporte anual de producción. Informe inédito. Biocen 2012.
2. FRAGA GÓMEZ, José Carlos. "Incremento del estándar de calidad para la formulación de la vacuna Quimi-Hib". Biocen, 2004.
3. SIMIL RODRIGUEZ, María Teresa. Reporte de Validación del procedimiento de limpieza automático del sistema de formulación STERIDOSE. Biocen, 2013.
4. SIMIL RODRIGUEZ, María Teresa. Reporte de revalidación de la simulación de la formulación de la vacuna Pentavalente y del aseguramiento de la esterilidad en el tiempo en el sistema de formulación Steridose. Informe inédito. Biocen, 2013.
5. MOREDA DíAZ, Caridad. Reporte de liberación del lote F3AA21. Informe inédito. Biocen, 2012.
6. MOREDA DíAZ, Caridad. Reporte de liberación del lote F3AA22. Informe inédito. Biocen, 2012.
7. MOREDA DíAZ, Caridad. Reporte de liberación del lote F3AA23. Informe inédito. Biocen, 2012.
Recibido: Enero del 2014
Aprobado: Abril del 2014
Ing. José Carlos Fraga-Gómez. Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba. jose.fraga@biocen.cu