Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.38 no.3 Santiago de Cuba set.-dic. 2018
ARTICULO ORIGINAL
Pruebas preliminares a escala piloto para la obtención de hidróxido de níquel para baterías recargables
Preliminary tests at pilot scale for obtaining of nickel hydroxide for rechargeable batteries
MSc. Deisy Cisneros-Sánchez, Ing. Elvira Leyva-Navarro, MSc. Neicis Capote-Flores,
Centro de Investigaciones del Níquel (CEDINIQ), Cuba dcisneros@cil.moa.minem.cu
Resumen
Se realizaron pruebas a escala piloto, con el objetivo de proponer una alternativa tecnológica para la producción de hidróxido de níquel que pueda utilizarse en la fabricación de baterías recargables. Se realizó la precipitación química a partir de una solución de sulfato de níquel, que contiene cobalto y manganeso, mediante un proceso en batch o intermitente, con el empleo de hidróxidos de amonio y sodio, bajo condiciones controladas de temperatura, pH, tiempo de reacción, concentraciones de reactivos y flujo de los hidróxidos correspondientes. Se determinaron los principales indicadores técnicos del proceso: índices de consumo de la materia prima y materiales fundamentales, así como las eficiencias de precipitación de metales y del lavado. Se caracterizó químicamente el hidróxido de níquel, logrando contenidos promedio de níquel y sodio, iguales a 53,8 % y 2,5 %, respectivamente. El producto obtenido cumple con la densidad de compactación requerida para las baterías recargables. La eficiencia de precipitación promedio de níquel y cobalto fue igual a 99,8 %, mientras que para el manganeso fue 94,9 %. El proceso de lavado solo garantizó la disminución del 74 % del sodio contenido en el hidróxido obtenido.
Palabras Clave : hidróxido de níquel, precipitación química, amonio, sodio
Abstract
Pi lot plant scale tests, were carried out with the objective of proposing a technological alternative to obtain a nickel hydroxide solution, which can be used for rechargeable batteries production.
Chemical precipitation was developed using nickel sulphate solution in either batch or intermittent process. Nickel sulphate solution contains cobalt and manganese. Ammonium and sodium hydroxides, controlling temperature, pH, reaction time, reagent concentrations and sodium hydroxide flow conditions, were used too.
The main technical process indicators were determined: raw material and bulk consumption indices, as well as metals and washing precipitation efficiencies.
Nickel hydroxide resulting solution was chemically characterized, obtaining average nickel and sodium contents, equal to 53,8 % and 2,5 %, respectively. Nickel and cobalt average precipitation efficiency was equal to 99,8 %, while for manganese it was 94,9 %.
The washing process just guaranteed the 74 % reduction of sodium contained in the hydroxide obtained reduction.
Key words: nickel hydroxide, chemical precipitation, ammonium, sodium
INTRODUCCION
La sociedad moderna emplea cada vez más, sistemas de almacenamiento de energía para realizar disímiles actividades de la vida cotidiana. Se desarrollan baterías, condensadores, supercondensadores, celdas de combustible, que son dispositivos utilizados para la generación y acumulación de la energía eléctrica necesaria en computadoras, teléfonos, fuentes de energía renovables y vehículos, entre otros.
En el caso de las baterías recargables, uno de los materiales más empleados en su producción es el hidróxido de níquel, con el cual, por lo general se fabrica , el electrodo positivo. La capacidad de una batería o acumulador se define por la capacidad del electrodo de hidróxido de níquel. Su costo representa entre el 65 y el 70% del costo total del acumulador [ 1 ] .
Las vías para la producción del hidróxido de níquel son diversas [ 2 ] : precipitación química, electroquímica, síntesis sol-gel, envejecimiento químico, síntesis hidrotermal y solvotermal, síntesis asistida por microondas o ultrasonido. Estas pueden aplicarse de manera independiente o combinada, siendo las dos primeras las más empleadas.
Tomando como base la vía de obtención propuesta en los trabajos referidos anteriormente, en el Centro de Investigaciones del Níquel, se realizaron estudios a escala de laboratorio, empleando soluciones de sulfato de níquel, que además contienen cobalto y manganeso, determinando las condiciones de proceso en las cuales se obtuvieron las mayores eficiencias de precipitación de níquel [ 15 ] .
El presente trabajo tiene como objetivo, evaluar a escala piloto el proceso de precipitación de hidróxido de níquel, por vía química, utilizando hidróxido de amonio y sodio, para determinar de manera preliminar, los principales indicadores técnicos para la elaboración de una tarea técnica que posibilite el escalado del proceso a nivel industrial.
MATERIALES Y MÉTODOS
Las corridas experimentales se desarrollaron a escala piloto, en una instalación con capacidad para obtener entre 20 y 30 kg de hidróxido de níquel en cada corrida.
La instalación experimental empleada estuvo compuesta por los siguientes equipos y accesorios:
• Reactor de 80 L de capacidad de trabajo, provisto de agitador y camisa para el calentamiento
• Medidor de pH. HANNA Calibration Check Portable pH Meter.
• Medidor de temperatura. Rango de 0 -100 o C
• Bombas peristálticas para suministro de soluciones hidróxidos de amonio y sodio. MC-PROCESS ISMATEC. Tipo: 915 A. Flujo variable.
• Filtro prensa. Área: 1,6 m 2
• Bomba centrífuga. Capacidad: 0,42 m 3 /h
• Recipientes para el almacenaje de soluciones
Para determinar la composición química de las materias primas, materiales y productos sólidos y líquidos obtenidos en el proceso, se empleó la técnica espectrofotometría de absorción atómica.
La materia prima utilizada fue la solución de sulfatos, obtenida a partir de la lixiviación del sulfuro de níquel, que contiene en menor cuantía cobalto y manganeso.
La tabla 1 muestra la composición promedio de la solución de sulfatos, alimentada al proceso, en gramos por litro:
Tabla 1. Composición promedio de la solución de sulfatos, alimentada al proceso de obtención de hidróxidos (g/L)
| Ni | Co | Mn |
| 120,7 | 2,0 | 1,6 |
El volumen inicial de solución empleado en cada prueba fue igual a 30 L
Otros materiales empleados, fueron los siguientes:
- Solución de hidróxido de amonio, grado técnico, de concentración de amoníaco igual a 249 g/L
- Solución de hidróxido de sodio, grado técnico, de concentración igual a 240 g/L
Metodología
Para la evaluación a escala piloto se concibió la realización de 4 pruebas, en batch , bajo las mejores condiciones determinadas en los niveles de experimentación de laboratorio [ 15 ] , que fueron las siguientes:
| • Temperatura: | 70 | o C |
| • pH: | 13 | unidades |
| • tiempo de retención: | 1 | h |
La cantidad de hidróxido de amonio, se suministró de modo tal que se pudiera garantizar una relación molar promedio NH 3 /Ni 2+ igual a 0,5.
Se evaluaron dos flujos de hidróxido de sodio (0,5 y 1,0 L/min) para confirmar el rango adecuado de este parámetro.
El procedimiento general para la realización de las pruebas fue el siguiente:
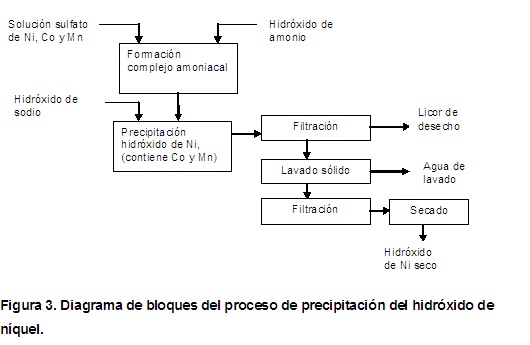
Se alimentó al reactor, la solución inicial de sulfato de níquel, que contiene cobalto y manganeso, se calentó hasta 70 ºC , se adicionó lentamente la cantidad prefijada de hidróxido de amonio, se agitó por espacio de 5 minutos, se midió el pH y se inició la adición del hidróxido de sodio con el flujo especificado hasta el pH de trabajo, igual a 13. Una vez alcanzado ese valor de pH, se mantuvo la agitación mecánica durante 1 hora. Posteriormente, la pulpa de hidróxidos formada en el reactor, se bombeó a través de la bomba centrífuga hasta el filtro prensa, en el cual se obtuvo, por un lado, el licor de desecho y por otro, la torta de sólidos, conteniendo al hidróxido de níquel o producto de interés. La torta de sólidos fue lavada con agua a 70 o C en el reactor y luego se bombeó a presión para el filtro. Finalmente la torta se extrajo del filtro y se secó en estufa a la temperatura de 60 o C.
Se tomaron muestras del licor final y del sólido para realizarle análisis químicos, fundamentalmente de Ni, Co, Mn, Na.
En la figura 3, se muestra un diagrama de bloques que contiene las operaciones y el orden de ejecución de las mismas.
Al concluir las pruebas, se determinó la composición química del hidróxido de níquel obtenido, en por ciento, así como la concentración de la solución residual resultante del proceso. También se determinaron las densidades de partícula, de compactación y la porosidad, mediante las normas ISO 18753:2004(F) e ISO 17172:2014 , respectivamente. Se calcularon los siguientes indicadores técnicos del proceso: eficiencia de precipitación de metales, índices de consumo de las materias primas y materiales fundamentales, así como la eficiencia del lavado, tal y como se describe a continuación.
La eficiencia de precipitación de níquel cobalto y manganeso, se obtuvo, mediante la siguiente expresión:
Precp Mi = (%Mi sólido. Msól) / (Vlinic*Clinic) (1)
Donde:
PrecpMi: Eficiencia de precipitación del metal i, %
%Misólido: Contenido de metal i en el sólido, % (en masa)
Msólido: Masa de sólido seco obtenido, g
Vlinic: Volumen de licor inicial, L
Clinic: Concentración de metal i en el licor inicial, g/L
Se determinó la eficiencia del proceso de lavado, por la relación entre el contenido de sodio promedio en la muestra sin lavar y en la muestra lavada. El índice de consumo de agua de lavado en litros por kilogramo de hidróxido de níquel, se determinó a partir de la relación entre el volumen de agua utilizada para este proceso y la cantidad de hidróxido de níquel seco obtenido.
RESULTADOS
Comportamiento de los principales parámetros de operación, características del proceso y los productos
En la tabla 2, se muestra el comportamiento de los diferentes parámetros medidos durante las pruebas. En todos los casos, se cumplió con los valores pre-fijados de temperatura y tiempo de reacción, iguales a 70 o C y una hora, respectivamente, que fueron las condiciones bajo las cuales se obtuvieron las mayores eficiencias de precipitación de metales de las pruebas de laboratorio [ 15 ] . El tiempo que duró la adición de solución de hidróxido de sodio hasta alcanzar el pH de trabajo, osciló entre 1 hora y 15 minutos y 1 hora y 30 minutos. Para efectuar el lavado, se emplearon 100 litros de agua en cada prueba.
En la tabla 3, se muestra la composición química de los metales involucrados en el proceso, tanto en la solución acuosa como en el hidróxido resultante de la precipitación, para las condiciones que se indican en la tabla 2. Los resultados de los análisis de densidades de partícula, compactación y porosidad se muestran en la tabla 4. Se evaluó la eficiencia de precipitación de Ni, Co, Mn, en %, (tabla 5).
En la tabla 6, se reflejan los resultados de la composición química del hidróxido de níquel obtenido a escala piloto, después de haber sido lavado en el laboratorio, utilizando agua a 70 o C en 4 etapas.
Tabla 2. Comportamiento de los principales parámetros de operación
| Prueba | pH inicial, unidades | Volumen NH 4 OH, L | Flujo de NaOH, L/min | Volumen NaOH, L | Volumen licor inicial, L | Densidad de pulpa final, kg/m 3 | Densidad de licor final, kg/ m 3 | pH de licor final, unidades | Masa de sólido final húmedo, kg | Masa de sólido final seco, kg |
| 1 | 5,04 | 7,5 | 1,0 | 26 | 30 | 1230 | 1160 | 13,00 | 20,2 | 6,3 |
| 2 | 5,04 | 10,0 | 1,0 | 26 | 30 | 1280 | 1150 | 12,81 | 20,2 | 5,9 |
| 3 | 4,53 | 6,7 | 0,5 | 28 | 30 | 1300 | 1100 | 13,01 | 23,9 | 7,3 |
| 4 | 4,53 | 6,7 | 0,5 | 27 | 30 | 1270 | 1080 | 12,93 | 23,9 | 7,7 |
Tabla 3. Contenido de metales, en las soluciones acuosas y los sólidos resultantes de la precipitación de hidróxido de níquel
| Prueba | Concentración en solución acuosa, g/L | Concentración en sólido, % | |||||||
| No | Ni | Co | Mn | Na | Ni | Co | Mn | Na | H 2 O |
| 1 | 0,026 | 0,002 | 0,0012 | 48,52 | 55,10 | 0,891 | 0,851 | 2,87 | 68,7 |
| 2 | 0,026 | 0,002 | 0,0020 | 52,37 | 55,62 | 0,949 | 0,780 | 0,23 | 70,5 |
| 3 | 0,012 | 0,002 | 0,0018 | 48,20 | 53,76 | 0,864 | 0,528 | 1,62 | 69,4 |
| 4 | 0,045 | 0,007 | 0,0020 | 50,28 | 50,92 | 0,799 | 0,463 | 2,91 | 67,8 |
| Promedio | 0,027 | 0,003 | 0,0020 | 49,84 | 53,85 | 0,876 | 0,656 | 2,47 | 69,1 |
Tabla 4. Valores de densidades de partícula, de compactación y porosidad
|
Muestra | Densidad de partícula | Presión optima de prensado | Densidad de prensado
| Porosidad
|
| N o | kg/m 3 | MPa | kg/m 3 | % |
| 1 | 3 389,8 | 9,70 | 2 160, 0 | 36,21 |
| 2 | 3 314,9 | 9,66 | 2 200, 0 | 33,59 |
| 3 | 3 332,5 | 12,42 | 2 290,0 | 31,12 |
| 4 | 3 477,4 | 12,00 | 2 100,0 | 39,70 |
La eficiencia de precipitación del níquel, el cobalto y el manganeso, se comportó como sigue:
Tabla 5. Eficiencia de precipitación de los metales de interés, en porciento
| Prueba | Ni | Co | Mn |
| 1 | 99,43 | 99,40 | 94,19 |
| 2 | 99,99 | 99,98 | 90,93 |
| 3 | 100,00 | 100,00 | 100,00 |
| 4 | 99,85 | 100,00 | 94,33 |
| Promedio | 99,82 | 99,84 | 94,86 |
Tabla 6. Composición química, en porciento, de muestras de hidróxido de níquel obtenido a escala piloto, lavadas en varias etapas en el laboratorio
| Muestra | Ni | Co | Mn | Na | NH 3 |
| 1 | 56,88 | 1,02 | 0,84 | 0,067 | 0,0045 |
| 2 | 56,46 | 1,04 | 0,87 | 0,079 | 0,0043 |
| 3 | 57,20 | 0,92 | 0,60 | 0,092 | 0,0072 |
| 4 | 58,24 | 0,89 | 0,44 | 0,051 | 0,0043 |
Tomando como referencia los resultados obtenidos anteriormente y la metodología descrita en el acápite de Materiales y Métodos, se calcularon los principales indicadores técnicos del proceso, los cuales se muestran a continuación:
Consumo promedio de materia prima y materiales, por cada kilogramo de hidróxido de níquel seco
| 1,40 | kg |
| 0,28 | kg |
| 0,94 | kg |
| 14,7 | L |
Eficiencia promedio de precipitación de metales y del proceso de lavado
| 99,82 | % |
| 99,84 | % |
| 94,86 | % |
| 74,40 | % |
DISCUSIÓN DE LOS RESULTADOS
En las pruebas realizadas, se cumplieron los valores planificados para los diferentes parámetros de operación, tales como: temperatura, pH, tiempo de reacción y flujo de hidróxido de sodio. Se lograron altas eficiencias de precipitación de los metales de interés, cercanas al 100% para níquel y cobalto, confirmando los resultados obtenidos en [ 15 ] , que ratifican que la utilización pH más altos, favorece la eficiencia de precipitación de estos metales. El manganeso tuvo un comportamiento irregular en la prueba 3, con el 100% de eficiencia de precipitación, valor que no concuerda con los niveles de precipitación alcanzados en las restantes pruebas. No se observaron diferencias significativas en las eficiencias de precipitación de los metales, con la variación del flujo de hidróxido de sodio, por lo que puede trabajarse dentro del rango de los dos niveles escogidos. (0,5 a 1,0 L/min).
Se obtuvieron consumos de hidróxido de sodio y agua, relativamente altos. Según lo estudiado por [ 3 ] , la cantidad de hidróxido de sodio a emplear, se pudiera reducir realizando el proceso precipitación de manera continua, propiciando el uso de la cantidad indispensable de este reactivo, para lograr la reacción con el complejo amoniacal de níquel formado, con la consiguiente disminución de la concentración de sodio en hidróxido precipitado.
Los valores de densidades de partícula, estuvieron entre 3300 y 3500 kg/m 3 , los cuales fueron ligeramente inferiores al rango entre 3700 y 3900 kg/m 3, reportado por [ 4 ] , para hidróxido de níquel, obtenido a partir de la reacción de una solución de nitrato de este metal con soluciones de hidróxido de amonio, en presencia y ausencia de ultrasonido.
La densidad de compactación, alcanzada en todas las pruebas fue superior a 2100 kg/m 3 , similar, a la reportada por [ 3 , 14 ] la capacidad de la celda, en cuanto a la cantidad de energía producida por peso del electrodo.
Los resultados obtenidos, aunque son preliminares, son la base de una de propuesta de alternativa tecnológica para la producción de hidróxido de níquel que pueda utilizarse en la fabricación de baterías recargables, a partir de soluciones de sulfato de níquel que contienen cobalto y manganeso, y constituyen una referencia para estimar el posible comportamiento y características de la ejecución de este proceso a escala industrial.
CONCLUSIONES
Se determinaron de manera preliminar los principales indicadores técnicos del proceso de precipitación de hidróxido de níquel, mediante la precipitación química a partir de una solución de sulfato de níquel, que contiene además cobalto y manganeso, obteniendo los índices de consumo de sulfato de níquel, hidróxido de amonio e hidróxido de sodio, que constituyen los reactivos fundamentales. La eficiencia de precipitación promedio de níquel y cobalto fue igual a 99,8%, mientras que para el manganeso fue 94,9 %. El proceso de lavado solo garantizó la disminución del 74% del sodio contenido en el hidróxido obtenido. Los consumos de hidróxido de sodio y agua, fueron relativamente altos con valores de 0,94 kg y 14,7 L por kilogramo de hidróxido de níquel seco. Se caracterizó el hidróxido obtenido, logrando contenidos promedio de níquel y sodio en este, iguales a 53,8% y 2,5%, respectivamente, con densidades de partícula y de compactación en el rango apropiado para las baterías recargables. Los resultados obtenidos constituyen la base de una propuesta de alternativa tecnológica para la producción de hidróxido de níquel, que pueda ser empleado en la fabricación de baterías.
BIBLIOGRAFÍA
2. HALL, David. S, et al, "Nickel hydroxides and related materials: a review of their structures,synthesis and properties" . Proceeding rspa.royal society publishing.org, 2014: pág. 65. Volumen 471. doi: 10.1098/rspa.2014.0792
3. SHIN, DON.Y. Proceso para la producción de hidróxido de níquel. Estados Unidos. Patente US 5,498,403. 12-3-1996
4. CABAÑAS POLO, Sandra., Síntesis asistida por ultrasonido de nanoestructuras de compuestos de níquel , in Instituto de Cerámica y Vidrio Consejo Superior de Investigaciones Científicas (CSIC) . 2012, Universidad Autónoma de Madrid. Facultad de Ciencias: Madrid. pág. 216.
5. WAKAO, Shinjiro, et al . Process for producing nickel hydroxide. Estados Unidos. Patente US 5,861,131. 19-1-1999
7. OLBRICH, Armin, et al, Method for producing nickel hydroxides. Estados Unidos. Patente US 6,752,918. 22-6-2004
9. BECKER, M. D, et al. Estudio del desprendimiento de oxígeno en electrodos de hidróxido de níquel en celdas prototipo NiMHx , Cuarto Congreso Nacional- Tercer Congreso Iberoamericano Hidrógeno y Fuentes sustentables de Energía. La Plata. Argentina. HYFUSEN 2011.
10. ALBRECHT, Sven, et al. Mixed metal hydroxides comprising amorphous aluminum hydroxide, and their preparation and use . Estados Unidos. Patente US 7,998,582. 16-8-2011.
11. ORTÍZ M.G, Efecto del contenido de cobalto en el desempeño de hidróxido de níquel , Cuarto Congreso Nacional- Tercer Congreso Iberoamericano Hidrógeno y Fuentes sustentables de Energía. HYFUSEN. La Plata. Argentina. 2011.
12. FIERRO Cristian, et al. Nickel Hydroxide electrode material with improved microstructure and method for making the same. Estados Unidos. Patente US 7,294,434. 13-11-2007
13. RAVI KUMAR. C. R, et al. " Influence of zinc additive and pH on the electrochemical activities of ß-nickel hydroxide materials and its applications in secondary batteries". Journal of Energy Storage . Volumen 9. págs. 12-24. 2017
14. KRYNITZ Ulrich, et al. Process for the production of pure nickel hydroxide and its use . Estados Unidos. Patente US 5,391,265. 21-2-1995
Recibido: Marzo 2018
Aprobado:Julio 2018
MSc. Deisy Cisneros-Sánchez. Centro de Investigaciones del Níquel