Introducción
En la actualidad la utilización de las microalgas dentro de la biotecnología ha sido muy variada, en dependencia del objetivo final del proceso. Sus aplicaciones comerciales son tan diversas en sectores como el alimentario, energético, farmacéutico, sanitario y medioambiental. La utilización de estas radica principalmente en la obtención de bioproductos para la nutrición humana y animal, y en la obtención de sustancias de interés químico-farmacéutico. La biotecnología de las microalgas consta de dos fases: producción controlada de la biomasa algal y aprovechamiento de dicha biomasa.1
El Laboratorio de Anticuerpos y Biomodelos Experimentales (LABEX) se encarga de producir y comercializar anticuerpos conjugados con una calidad y costo competitivos; factibles de ser exportados, que permitan financiar su propia introducción y uso en el Sistema Nacional de Salud. La institución es uno de los centros de la región oriental que desarrolla y trabaja la biotecnología algal.
Algunos materiales necesarios para la obtención de estos anticuerpos son importados, lo que encarece el proceso con la creciente demanda de estos. Se hace imprescindible la búsqueda de nuevas fuentes de recursos, que permitan disponer de materia prima para la obtención de estos reactivos con tecnología cubana y de forma rentable.
Por ello se implementa un sistema de cultivo similar a fotobiorreactores de columna de burbujeo para la obtención de biomasa microalgal, de la que luego se extraerá y purificará el fluorocromo empleado para conjugar los anticuerpos. Se evalúa el crecimiento de Porphyridium cruentum en este tipo de biorreactor, a través de sus parámetros cinéticos y de productividad; así como la modelación matemática de su crecimiento.
Fundamentación teórica
La microalga marina Porphyridium cruentum es una Rhodophyta de interés creciente debido a, entre otras cosas, que es fuente valiosa de ficobiliproteínas (ficoeritrinas, ficocianinas y aloficocianinas); las que son utilizadas como marcadores en una gran variedad de diagnósticos e investigaciones que involucran marcadores celulares, análisis de células e inmunoensayos.2
La β-ficoeritrina ha mostrado ser particularmente útil y la más valiosa de las ficoeritrinas debido a su gran coeficiente de absorción y las excelentes propiedades de fluorescencia. 3 Su elevado coeficiente de extinción molar le confiere un intenso color rosa brillante, muy apropiado para su empleo como colorante natural; mientras, que su alto rendimiento cuántico de fluorescencia permite su detección con mayor sensibilidad que otros fluorocromos convencionales. Todo ello lo convierte en un valioso candidato como biosensor y marcador fluorescente.2,3
La microalga Porphyridium cruentum ha demostrado ser eficiente en la producción de β-ficoeritrina, ya que se ha encontrado que esta especie produce grandes cantidades de esta proteína.4
El biorreactor puede considerarse como el corazón de todo proceso biotecnológico, ya que es donde se lleva a cabo la transformación de la materia prima (P. cruentum) al producto de interés (β-ficoeritrina). Su operación deberá garantizar la maximización de dicha transformación, por lo que su funcionamiento es de vital importancia en la rentabilidad del bioproceso.
Investigaciones a escala de laboratorio se han realizado en LABEX sobre el proceso de cultivo de esta microalga: Se ha estudiado el crecimiento de P. cruentum bajo determinadas condiciones con diferentes medios de cultivo, velocidades de agitación y empleando agentes aceleradores del crecimiento como la zeolita y el campo magnético.5,6 Otros autores trabajaron la cinética de crecimiento de la microalga a una mayor escala utilizando módulos de bolsas desechables de 10 L. Pero en estos módulos el proceso de cultivo presentó algunos inconvenientes principalmente con la agitación, la alimentación al sistema del aire enriquecido con CO2 y con la adherencia de las células a las paredes de las bolsas desechables, imposibilitando el apropiado crecimiento celular.7
Las columnas de burbujeo son reactores de contenedor cilíndrico vertical transparente cuya altura es más del doble de su diámetro. Normalmente se introduce aire burbujeándolo por la parte inferior que tiene como función el mezclado del líquido y la transferencia de masa de CO2 y la remoción de O2. Sus principales ventajas son el bajo costo, área superficial mayor en relación al volumen, el mezclado relativamente homogéneo y eficiente liberación de O2.8 Una de las limitaciones, en comparación con los sistemas abiertos, es la disminución del área de iluminación sobre la extensión del fotobiorreactor.9
La cinética de crecimiento se refiere a la velocidad con que ocurren las transformaciones como producto del proceso de cultivo y esta se obtiene determinando experimentalmente la concentración de cada componente deseado en diferentes tiempos. Se pueden representar esquemáticamente las fases de crecimiento celular, en un tipo de operación tipo discontinuo (batch), graficando la concentración o biomasa en función del tiempo de cultivo.5
El crecimiento de las células, además de ser un proceso exquisito y complejo, obedece a las leyes de conservación de la masa. Se emplean átomos de C, H, O, N y otros elementos en el proceso metabólico de la célula, pero las cantidades de cada uno de estos elementos incorporadas al material celular son iguales a las cantidades de los mismos transferidas del entorno. Para describir el crecimiento celular y la actividad metabólica se puede utilizar la vía clásica de una simple reacción química a partir de la fórmula elemental del material celular seco.10
La modelación matemática de procesos biológicos es un instrumento que permite describir y verificar los procesos cinéticos que intervienen en el cultivo intensivo de microalgas en fotobiorreactores; permite predecir el comportamiento de estos procesos. Es aplicable al diseño, evaluación y control de procesos.11
Un modelo apropiado de crecimiento debe suministrar información sobre parámetros que pueden ser interpretados biológicamente. Al aplicar varios modelos de ajuste a una misma base de datos, es necesario decidir cuál de todos es el que mejor ajusta y pueda ser empleado para pronosticar resultados en los sistemas de producción. Siempre es preferible trabajar con modelos que tengan menos variables, porque además de ser más sencillos, son más estables y presentan menos sesgo.12
Métodos utilizados y condiciones experimentales
Microorganismo empleado: Se utilizaron cepas de la microalga roja Porphyridium cruentum del Laboratorio de Anticuerpos y Biomodelos Experimentales (LABEX).
Medio de cultivo: se trabajó con el medio Walne que ha asegurado, en trabajos realizados, un buen crecimiento celular. 3,7 Para su preparación, cada una de las siguientes soluciones se agrega en un litro de agua de mar previamente filtrada: se añade 1,0 mL de la solución de nutrientes, a la cual se le agrega 1,0 mL de solución de metales traza; 0,10 mL de la solución de vitaminas.13
Cultivo celular en fotobiorreactor: se llevaron a cabo en equipos tipo fotobiorreactor de columna de burbujeo, de 10 L de capacidad cada uno. Se utilizaron 3 biorreactores del mismo modelo con un banco de iluminación compuesto de lámparas de 40 W (GEDEME, Suecia) dispuesto de forma lateral al módulo de cultivo. Los cultivos fueron sometidos a temperatura de 20 a 24 ºC, bajo luz artificial de 1 200 a 1 500 lux. Agitación por burbujeo con un flujo de aire de 0,23 g·s-1. Los valores de pH y salinidad se ajustaron a 7,5 y 35 % respectivamente. El cultivo se realizó durante 15 días.
Concentración celular:
X: concentración celular, células·mL-1
n: número de cuadrantes contados
Ci: cantidad de células contadas en el cuadrante i
Fc: factor constante de la cámara (104)
Determinación de biomasa: la biomasa se calculó por el método gravimétrico en balanza analítica (Sartorius, BS 121S, Alemania). (14 Diariamente se centrifugaron 25 mL de muestra del cultivo celular a 3 500 rpm. La temperatura en la estufa (DHG-9146A, electrotérmica, China) fue de 105 ºC hasta lograr un peso constante. Se determinó la biomasa en (g células·L-1) relacionando los gramos de células con el volumen del cultivo celular procesado.
Estequiometria del crecimiento celular: la metodología empleada para la estequiometría es la reportada para la reacción de crecimiento de las algas.10
α: coeficiente estequiométrico del CO2
β: coeficiente estequiométrico del 
γ: coeficiente estequiométrico del 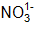
δ: coeficiente estequiométrico del H2O
ε: coeficiente estequiométrico del O2
Los coeficientes estequiométricos de la ecuación se calculan por un balance elemental.15
Parámetros derivados de la ecuación estequiométrica: teniendo en cuenta la estequiometría de la ecuación, se pueden definir factores asociados a la producción de la biomasa: factor de rendimiento o rendimiento celular, consumo específico de CO2 y coeficiente fotosintético teóricos.
El factor de rendimiento del crecimiento celular (Yx/s) según la estequiometría se determina como:
Yx/s: factor de rendimiento del crecimiento celular, gramos de biomasa por gramos de sustrato
yx/s: C-moles de biomasa formados por C-mol de sustrato consumido
(S: fracción en masa de carbono en el sustrato
(X: fracción en masa de carbono en la biomasa
El consumo específico de CO2:
(X: fracción en masa de carbono en la biomasa
El coeficiente fotosintético (CF) se determina según los coeficientes de O2 y CO2 en la ecuación:
CF: coeficiente fotosintético
ε: coeficiente estequiométrico del O2
α: coeficiente estequiométrico del CO2
Determinación de parámetros cinéticos
Velocidad específica de crecimiento
µ: velocidad específica de crecimiento del cultivo en la fase de crecimiento exponencial, d-1
Xvf: concentración celular en el último punto de la curva en la fase de crecimiento exponencial, células·mL-1
Xvo: concentración celular en el primer punto de la curva en la fase de crecimiento exponencial, células·mL-1
tf: tiempo transcurrido entre la concentración inicial y final, d
to: tiempo transcurrido en el primer punto de fase de crecimiento exponencial, d.
Tiempo de duplicación exponencial
td: tiempo de duplicación, d
µ: velocidad específica de crecimiento del cultivo en la fase de crecimiento exponencial, d-1
Número de generaciones
Ng: número de generaciones
tt: tiempo de duración del cultivo, d
td: tiempo de duplicación, d
Productividad de biomasa: Para evaluar el desempeño del proceso se determinó la productividad por:
PX: productividad en biomasa, g·L-1·d-1
Xm: concentración biomasa final, g·L-1
Xo: concentración biomasa inicial, g·L-1
tf: tiempo transcurrido entre la concentración inicial y final, d
Selección del modelo matemático: Se empleó el software OriginPro 9.0 (OriginLab) Inc. (2014) para seleccionar el modelo matemático de mejor ajuste de los datos del crecimiento celular, se buscaron los modelos de mayor aplicación y de menor complejidad. Los modelos matemáticos aplicados para la estimación del crecimiento celular de Porphyridium cruentum son los de Gompertz (ecuación 10) y el modelo Logístico (ecuación 11). Una vez estimados los parámetros que aparecen en el modelo, se realizaron pruebas para determinar la bondad del ajuste realizado.
donde:
bh: biomasa húmeda producida, g·L-1
t: tiempo de cultivo, d
a: valor asintótico cuando el tiempo crece indefinidamente (aproximadamente equivalente a la concentración final de microorganismos)
k: tangente en el punto de inflexión de la curva de crecimiento, equivalente a la velocidad específica de crecimiento máximo del microorganismo μm, d-1
xc: tiempo en que se alcanza el punto de inflexión o de máxima velocidad de crecimiento, d.
Resultados y discusión
Crecimiento de Porphyridium cruentum en fotobiorreactor tipo columna de burbujeo
En la curva de crecimiento del cultivo bajo las condiciones especificadas, figura 1, se identifican las diferentes fases del crecimiento. Se aprecia que la fase de latencia tiene poca duración, al igual que la fase de aceleración, solo dos días; al quinto día comienza la fase de crecimiento exponencial, que dura 7 días. Al día 12 ocurre la fase de desaceleración durante dos días, comenzando la fase estacionaria. Se alcanzó una concentración de 4,25·106 cél·mL-1 al final del cultivo.

Fig. 1 Curva de crecimiento para concentración celular. Fase I: Fase de latencia; Fase II: Fase aceleración; Fase III: Fase exponencial; Fase IV: Fase desaceleración; Fase V: Fase estacionaria
Resultados similares se lograron para Porphyridium cruentum en condiciones de radiación solar difusa con 20 L de medio de cultivo Vonshak durante 14 días, con fase de latencia de 3 días y fase exponencial entre el 4to y el 10mo día; este comportamiento se atribuye en gran medida a las variaciones de la intensidad luminosa y temperatura a que están sometidos en condiciones de radiación solar difusa.16
Concentraciones menores para P. cruentum en 400 L de medio f/2 y fertilizantes agrícolas (39,5 y 35,6·105 cél·mL-1) se alcanzaron con fase exponencial de 3 días y velocidades de crecimiento tres veces mayores que las del presente trabajo.17
En la tabla 1 se presentan los parámetros cinéticos del presente estudio y los resultados obtenidos con módulos de bolsas, utilizando bolsas desechables de 10 L de medio de cultivo durante 12 días, sin agitación ni alimentación constante de aire 7: velocidad específica de crecimiento máxima (µm); tiempo de duplicación (td); número de generaciones (Ng) y la duración de las diferentes fases.
Tabla 1 Parámetros cinéticos del crecimiento de P. cruentum para el presente estudio celular y para los reportados en módulos de bolsas desechables (7)*

En el cultivo en bolsas desechables, la fase exponencial duró menos días con una mayor velocidad específica máxima; sin embargo, en el presente estudio (columna de burbujeo) se obtuvo mayor biomasa húmeda con un incremento del 27 %.
Para P. cruentum se alcanzan valores de 0,77 y 0,74 d-1 y, tiempos de duplicación de 0,9 y 0,94 d en medio f/2 y fertilizantes agrícolas respectivamente utilizando columnas de fibra de vidrio a 1000 µE·m-2·s-1.17
Los resultados alcanzados en la presente investigación (0,29 divisiones por día con irradiancia entre 16,2 y 20,25 µE·m-2·s-1) se corresponden con los reportados para especies del género Porphyridium según la irradiancia incidente.17 El crecimiento es proporcional a la intensidad luminosa que se alcanza la zona de saturación, donde el crecimiento celular disminuye.18
Se ha obtenido en fotobiorreactor airlift con 7 L de medio de cultivo, una velocidad de crecimiento máxima de 0,298 d-1 para cultivo de Spirulina Plantensis19; valor muy similar al de la presente investigación.
Para maximizar la producción de biomasa se deben seleccionar cepas de rápido crecimiento, con velocidades específicas máximas no inferiores a 0,8 d-1.20) Aunque se plantea que la velocidad a la que crecen las microalgas depende, principalmente, de su capacidad de utilizar la luz incidente y de la disponibilidad de nutrientes.21
Desarrollo de estequiometria del crecimiento de Porphyridium cruentum
La fórmula química general del alga utilizada en el presente estudio (C106H263O110N16P) es reportada y utilizada por diferentes autores.1,10 La fórmula química expresada en función de un átomo-gramo de carbono es 
Al resolver el sistema de ecuaciones que conforman los coeficientes estequiométricos y sustituir, la ecuación queda de la siguiente manera:
De esa forma resulta la estequiometría del crecimiento de biomasa de P. cruentum en medio de cultivo Walne, considerando solo la generación de biomasa y la obtención de oxígeno gaseoso, producto de la fotosíntesis.
Parámetros derivados de la ecuación estequiométrica
Para determinar el factor teórico de rendimiento del crecimiento celular (Yx/s), utilizando la ecuación 3, se considera como sustrato la fuente de carbono, el CO2:
El consumo específico de CO2 queda determinado por:
La microalga, durante el crecimiento, puede fijar 1,23 g CO2·g biomasa-1. Este resultado es menor que el reportado por la literatura (1,83 g CO2·g biomasa-1) 10,22 al considerarse que la biomasa microalgal, en general, contiene 50 % de carbono por peso seco. Según la fórmula química empleada en este trabajo, la fracción en masa de carbono en biomasa es 0,336, o sea, 33,6 % en vez de 50 %. Aunque los resultados fueran más precisos si se utilizara una fórmula química más ajustada de biomasa de P. cruentum bajo las condiciones de cultivo utilizadas. El consumo de CO2 no sólo está determinado por la especie de microalga, sino también, por la concentración de CO2 disponible, temperatura, configuración del reactor, medio de cultivo e intensidad de luz.22
Coeficiente fotosintético (CF):
Este valor de coeficiente fotosintético es similar a los obtenidos de la ecuación estequiométrica para otras microalgas: de 1,30 a 1,39 mol O2 · (mol CO2)-1.23,24
Durante la fotosíntesis se libera 1 mol de O2 por mol de CO2 consumido, este valor varía de acuerdo con la intensidad de la luz. También hay que tener en cuenta que la estequiometria cambia según la fórmula química utilizada para la microalga, lo que está en dependencia de la especie cultivada y de las condiciones de cultivo 25, y según la fuente de carbono, nitrógeno y fósforo empleada.24
Productividad de Porphyridium cruentum : En las condiciones explicadas anteriormente, se obtuvo una productividad de 0,32 g·L-1·d-1 de biomasa húmeda, con un máximo de productividad al día 12.
La productividad de biomasa en base seca obtenida es de 0,092 g·L-1·d-1, lo que clasifica al sistema de baja productividad volumétrica. El sistema es de baja densidad celular al obtenerse una densidad de 1,47 g·L-1 en base seca.
Se pueden obtener productividades para Porphyridium cruentum entre 0,36 y 1,5 g·L-1·d-1 (26 y, para esta especie, una productividad de 1,5 g·L-1·d-1 y concentraciones máximas de 3 g·L-1 en fotobiorreactor tubular de 200 L. (22 Siendo mucho menor la productividad alcanzada en esta investigación.
La productividad obtenida es menor respecto a las reportadas para fotobiorreactores de columna de burbujeo: productividad de 0,46 ± 0,01 g·L-1·d-1 para Synechocystis sp. en escala piloto, bajo condiciones de cultivo semicontinuo con 11 L de medio de cultivo Mann and Myers y 1807 µE·m-2·s-1 de intensidad exterior. 27) Este autor también menciona, que en el cultivo de Isochrysis galbana en una columna de burbujeo de 5 L se alcanza una productividad de 0,36 g·L-1·d-1.
Aunque cada especie y subespecie de microalga presenta sus características propias respecto a condiciones óptimas de crecimiento, así como productividades máximas alcanzadas en diferentes configuraciones de sistema de cultivo.22
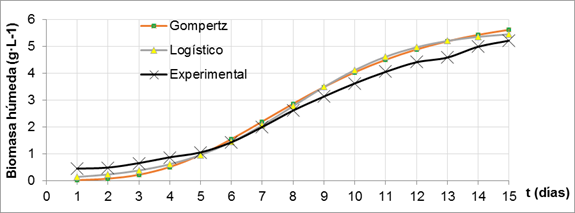
Modelación matemática del crecimiento celular de Porphyridium cruentum: De los dos modelos evaluados para describir el crecimiento de Porphyridium cruentum en fotobiorreactor tipo columna de burbujeo, el modelo Logístico resultó ser el más adecuado para la descripción de los datos, lo que se muestra en la figura 2 con el ajuste de los modelos; además el Logístico es el de menor valor de la suma de cuadrados de los residuos (SCR) y del criterio de información de Akaike (AIC) y el mayor valor del coeficiente R2, tabla 2.
De los parámetros biológicos que se muestran en la tabla 3 se obtiene la ecuación ajustada del modelo Logístico (ecuación 12). En la tabla 3 también se muestran los valores de biomasa final y tiempo en que se alcanza la velocidad específica de crecimiento máxima según la curva de crecimiento para biomasa húmeda obtenida experimentalmente por método gráfico. No existen diferencias estadísticamente significativas para los valores de la biomasa final y el tiempo en que se alcanza la máxima velocidad espeífica de crecimiento obtenidos por el modelo Logístico y los experimentales.
Como puede observarse, existen diferencias entre los valores de velocidad específica máxima de crecimiento obtenida por los dos métodos. Algunos autores reportan valores mayores de velocidad específica máxima del crecimiento de Listeria monocytogenes CECT 4031 cuando se emplean los modelos Logístico (0,22 h−1) y Richards (0,32 h−1) comparados con los determinados por el método gráfico (0,15 h−1).28) Este efecto se explica en función de la naturaleza sigmoidal del modelo. Existe una correlación entre la duración de la fase de latencia dada por el modelo y los valores específicos de la velocidad máxima de crecimiento. Como se observa en la figura 2, los modelos Logístico y de Gompertz reducen su fase de latencia con respecto a los datos experimentales, por lo que pueden esperarse valores superiores de la velocidad máxima de crecimiento.
La función de Gompertz ha sido la curva sigmoidal más ampliamente utilizada en microbiología predictiva debido a su simplicidad y efectividad.29) Aunque en un cultivo en discontinuo, la curva de crecimiento de microorganismos más frecuente es de tipo logístico.30
Tanto el modelo Logístico como el Gompertz tienen puntos de inflexión que están siempre en una proporción fija de su población asintótica. Pero en el modelo Logístico la curva de crecimiento es simétrica alrededor del punto de máxima tasa de crecimiento.31,32
Estas características del modelo Logístico hacen que sea el que mejor ajusta el crecimiento de Porphyridium cruentum bajo las condiciones empleadas en esta investigación, además de su simplicidad y sus posibilidades de interpretación biológica.
Conclusiones
Se obtienen parámetros cinéticos con velocidad específica de crecimiento máxima de 0,29 d-1 y tiempo de duplicación de 2,37 d. Los parámetros derivados de la estequiometría resultaron similares al reportado por la literatura excepto el consumo específico de CO2 que fue menor que el consumo normal. El sistema evaluado es de baja productividad volumétrica con un valor de 0,092 g·L-1·d-1 y baja densidad celular de 1,47 g·L-1.
El modelo matemático Logístico describe mejor el crecimiento de Porphyridium cruentum bajo las condiciones empleadas en la investigación.