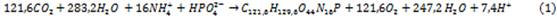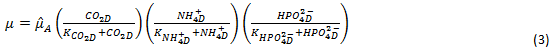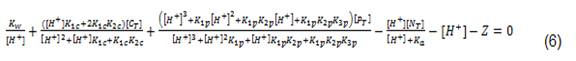Las microalgas constituyen un eficiente sistema fotosintético capaz de convertir la radiación solar en energía química acumulada en la biomasa con una eficiencia comparable a las plantas de mayor rendimiento, tales como sorgo, caña de azúcar, hierba de elefante y maíz a lo cual se suma que la biomasa es utilizable y contiene entre un 40 y un 50% de proteínas, sin contar contenido en vitaminas, grasas y otros biofactores que actúan de forma favorable sobre la salud del hombre. 1,2
•En la última década ha tomado auge el cultivo de microalgas ya que la biomasa puede ser utilizada en la producción de medicamentos, antisépticos, suplementos proteico-vitamínicos, fertilizantes y biocombustibles como hidrógeno, etanol y biodiesel, así como para remediación del medio ambiente contribuyendo a la mitigación del CO2 en la atmósfera y al tratamiento de aguas residuales. (3
•La presencia natural del alga en lagunas de residuales orgánicos municipales, industriales y pecuarios condujo primero a los sistemas de lagunas de oxidación y posteriormente al concepto de Estanques de Algas de Alta Tasa de Crecimiento (HRAP), desarrollado por W. J. Oswald y su grupo en la universidad de Berkeley.2 Este es un sistema que resulta muy económico, pues adiciona al beneficio de la producción de microalgas la depuración del residual, con lo que compensa la inversión inicial y ha sido modelado con resultados satisfactorios. 6,7
•El sistema que se presenta en este trabajo (Sistema de cultivo de algas y bacterias en Fotobiorreactores de Capa Fina) trabaja con concentraciones de algas y bacterias 10 veces superiores, por lo que se reduce el tiempo de residencia a un día y el consumo de energía en la cosecha. (1
•En el Centro de Investigaciones de Energía Solar en Santiago de Cuba, en las décadas de 1980 y 1990, se realizan los primeros trabajos que permiten desarrollar el sistema de cultivo de algas y bacterias en Fotobiorreactores de Capa Fina, , con la cooperación de la Academia de Ciencia Checa, las experiencias a escala piloto se llevaron a cabo en Fotobiorreactores de Capa Fina con áreas de 2 m2, 100 m2 y 500 m2 respectivamente (figura 1), por último se realizó una experiencia a gran escala en un Fotobiorreactor de 3500 m2,construido en el cebadero porcino El Brujo en Santiago de Cuba. 4
•

Fig.1 Fotobiorreactor de capa fina de 500 m2. Centro de Investigaciones de Energía Solar. Santiago de Cuba
Los datos experimentales obtenidos en este fotobiorreactor de 3500 m2 son utilizados en este trabajo como base comparativa. El equipo está compuesto por dos áreas de 1750 m2, con 2 % de pendiente longitudinal, separadas entre sí por un pasillo; la diferencia entre ambas áreas radica en que sus pendientes son inversas y forman dos vertientes consecutivas. La superficie del fotobiorreactor es lo más lisa posible y su pendiente transversal es nula; dicha superficie se encuentra dividida a lo largo por muretes que forman canales de un metro de ancho.
•El líquido es bombeado desde un tanque situado por debajo del nivel inferior de la segunda pendiente hasta la parte más alta del fotobiorreactor, que es el inicio de la primera pendiente, donde existe una canal distribuidora formada por tantas compuertas como canales de un metro de ancho tenga el fotobiorreactor, semejante canal existe al inicio de la segunda pendiente.
•Durante el día se evita la entrada de la suspensión al tanque, cerrando la válvula que comunica el tanque con las bombas, de esta forma se establece la recirculación de la suspensión de cultivo por las canales garantizando un flujo de 4 L·s-1 por canal y una profundidad de 0,007 m, con el objetivo de aprovechar la luz solar como fuente energética para el proceso de fotosíntesis. El fotobiorreactor maneja 9,3 L de suspensión de cultivo por metro cuadrado de superficie. Durante la noche se deja entrar la suspensión al tanque donde es aireada para favorecer la respiración de los microorganismos.
•El propósito de este trabajo es presentar y validar un modelo matemático que permite estimar los parámetros de operación en el fotobiorreactor de 3500 m2, que utiliza el residual líquido porcino como única fuente de materia orgánica y nutrientes, para ello se tienen en cuenta las interacciones entre las especies químicas y biológicas presentes en el sistema, las variaciones transitorias de los factores medioambientales, las fluctuaciones de la carga orgánica, la temperatura y la influencia de la irradiación solar incidente y la concentración de microorganismos. Una correcta apreciación de los parámetros dinámicas en el fotobiorreactor de capa fina llega a ser un requisito importante en la operación y diseño exitoso de este proceso y permite optimizar los parámetros operacionales: concentración inicial de microorganismos y adición de residual al sistema.
•Materiales y métodos
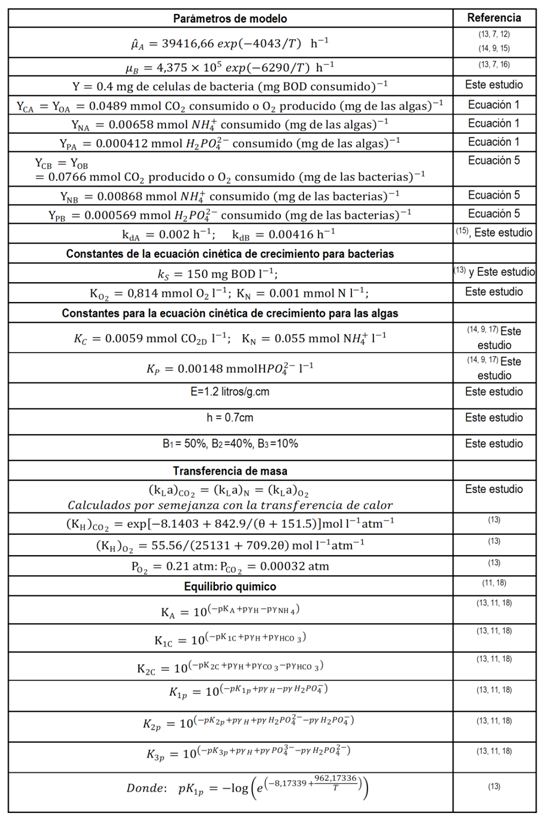
Un modelo dinámico del crecimiento de algas-bacterias en un fotobiorreactor de capa fina, no es más que una serie de ecuaciones que describen las interrelaciones entre las especies químicas y biológicas presentes. Con este propósito se utiliza un modelo de flujo pistón y se considera un elemento de fluido pequeño en el cual, las concentraciones de todas las especies presentes son uniformes y se examina la cinética de crecimiento de las microalgas y bacterias, la temperatura, el equilibrio químico y el balance de materias transportadas dentro y fuera del elemento de fluido escogido. Las ecuaciones resultantes se reflejan en la figura 2. En la tabla 1 están presentes los valores numéricos de los parámetros empleados para los cálculos en el modelo matemático.
Crecimiento de las algas
La microalga Chlorella vulgaris, requiere de los macronutrientes C, H, O, N, P, K y Mg para su crecimiento, y otros micro elementos. La ecuación estequiometria propuesta por 7 describe este proceso:
La cinética de crecimiento biológico de las microalgas es descrita por la función de Monod, 8 que relaciona la velocidad del crecimiento específico y la concentración limitante de sustrato.
En condiciones donde exista la luz adecuada, el crecimiento de las algas estará limitado por la cantidad de: carbono inorgánico y sus especies químicas en el equilibrio, nitrógeno inorgánico y sus especies químicas en el equilibrio y el fósforo y sus especies químicas en el equilibrio. Existía cierta incertidumbre en cuanto a; cual especie del carbono inorgánico debe ser considerada como sustrato en la ecuación de Monod. Algunos investigadores sugieren que el carbono total, mientras que otros argumentan que el dióxido de carbono disuelto es el más apropiado. 9 15 El mismo autor justifica emplear las concentraciones del ion amonio ( • NH • 4 • + • ) y el ion fosfato • 𝐻𝑃𝑂 • 4 • 2− • .
Dependiendo del pH del medio de cultivo la concentración de iones amonio ( • 𝑁𝐻 • 4 • + • ) y el iones fosfato • 𝐻𝑃𝑂 • 4 • 2− • , pueden o no ser limitantes del crecimiento. Para considerar el nitrógeno y el fósforo como factores limitantes, la velocidad de crecimiento será expresada como el producto de tres tipos de funciones de Monod, una para cada uno de los nutrientes limitantes. La ecuación de la velocidad del crecimiento de las algas será:
Limitación de luz
Una restricción más para el crecimiento de las algas que debe ser considerada, es la disponibilidad de la luz. A medida que la irradiación solar penetra la superficie líquida, su intensidad se reduce exponencialmente con la profundidad, de acuerdo a la ley de Lambert -Beer.
Basado en los argumentos anteriores se sugiere en este trabajo que el problema de la limitación de la luz, sea resuelto utilizando la ecuación (4).
I -1 1 23o-2Crecimiento de las bacterias aeróbicas
La acción de las bacterias heterótrofas en un cultivo de algas bacterias es similar a la de un proceso de lodos activados en el cual los microorganismos descomponen la materia orgánica en presencia de oxígeno. Asumiendo una fórmula empírica de C5H7NO2P0.066 para el protoplasma de las bacterias, y un rendimiento de bacteria de 0.4 g material celular por g O2 consumido, 7 la estequiometria de los procesos aeróbicos, está dada por:
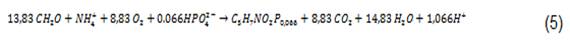 La velocidad de crecimiento de las bacterias, puede ser expresada como el producto de un número de expresiones de tipo Monod, representando limitaciones en sustrato orgánico (S), oxígeno (O2) y nitrógeno (NT).
La velocidad de crecimiento de las bacterias, puede ser expresada como el producto de un número de expresiones de tipo Monod, representando limitaciones en sustrato orgánico (S), oxígeno (O2) y nitrógeno (NT).
En este estudio, los fenómenos de nitrificación y desnitrificación, que se espera ocurran en el fotobiorreactor de capa fina, han sido descartados. La inclusión de estos fenómenos en el estudio sería más realista y daría lugar al surgimiento de pequeñas diferencias en las condiciones de operación con respecto a las reportadas aquí, tales como el ligero incremento de la demanda del oxígeno de la nitrificación durante el día, y la reducción en sustrato durante la desnitrificación en la noche., al igual que las variaciones mínimas en pH.16,17,18 19
Solución del equilibrio
Las interrelaciones entre las especies del carbono inorgánico, amoniaco, orto-fosfatos solubles y otros cationes no reaccionantes y los aniones son complejos, sin embargo, son bien analizadas y documentadas. 10,11 Aplicando constantes de equilibrio apropiadas, coeficientes de actividad, y el principio de neutralidad de carga, es posible determinar el pH de la solución y la distribución resultante de sub-especies individuales. Las relaciones requeridas para este propósito están recogidas en la figura 2 y la tabla 1. El valor de la concentración de ion H+ y por tanto el pH se calcula a partir de la ecuación (6) utilizando el método de Newton Raphson.
Balance de materiales
Un balance total dinámico de masa para un elemento de fluido puede ser desarrollado teniendo en cuenta que: la acumulación de material en el elemento está dada por la diferencia entre el flujo del material que entra y sale, el que se genera y consume por reacciones y el transferido hacia dentro o hacia fuera por difusión a través de los límites del sistema. La figura 2 muestra las ecuaciones de balance de masa resultantes para las especies presentes en el sistema.
Calculo de los coeficientes de transferencia de masa para el oxígeno y dióxido de carbono
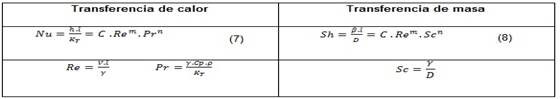
Para problemas especiales de transferencia de calor y masa, pueden utilizarse las ecuaciones siguientes. Ver tabla 2.
El valor del exponente n, según el estado de la corriente, puede tomar valores comprendidos entre cero y uno. (20
Por la relación que existe entre la transferencia de calor por convección y la transferencia de masa se puede dividir la ecuación (7) por la ecuación (8) se obtiene la relación entre el coeficiente de transferencia de calor y masa. Como la naturaleza de la corriente de aire es laminar pura, el valor del exponente n es cero.(20 Por tanto:
Simulación del Comportamiento del fotobiorreactor de capa fina
Las ecuaciones en la figura 2 representan las interacciones que ocurrirían en un pequeño elemento de fluido. Se demuestra que en la sección transversal ocurre un mezclado total en el régimen de flujo turbulento (Reynolds > 2100) y que el fotobiorreactor de capa fina, es un sistema de flujo pistón.
Resultados y discusión
Validación de Modelo
Las variaciones en las concentraciones de algas y bacterias, materia orgánica en términos de demanda bioquímica de oxígeno (DBO), oxígeno disuelto, nitrógeno amoniacal disuelto, orto fosfatos disueltos, dióxido de carbono disuelto, pH y temperatura en un fotobiorreactor de capa fina de 3500 m2 utilizado para el cultivo en residuales líquidos porcinos de la microalga Chlorella vulgaris fueron reportadas por 1,2,4 5. La calidad del modelo matemático puede ser evaluada, comparando sus predicciones teóricas con estos datos.
La simulación dinámica del fotobiorreactor de capa fina fue realizada durante las 24 horas del día, se utilizó tiempo de residencia de 1 día y un tiempo de recirculación sobre la superficie de cultivo de 10 h. El residual líquido porcino, utilizado como única fuente de materia orgánica y nutrientes, fue añadido de forma continua durante las 9 primeras horas del día.
La luz fue considerada, encendida para las 10 h de recirculación diurna y apagada para las 14 h en las que la suspensión de cultivo está en el tanque durante la noche.
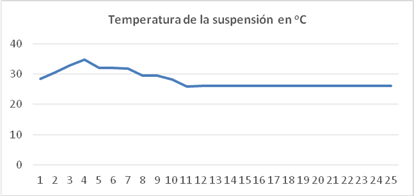
Variación de la temperatura en la suspensión de cultivo
La temperatura en la suspensión de cultivo se mantuvo entre 27 y 36 oC. Durante el día la temperatura asciende desde 27 oC a las 7 a.m. a 36 oC a la 12 a.m. luego desciende hasta 27 oC al finalizar la tarde, durante la noche la temperatura se mantiene estable (figura 3).
En todos los gráficos, el eje de las ordenadas representa las horas del día, el número 0 corresponde a las 7.00 a.m. y el 25 las 7.00 a.m. del día siguiente.
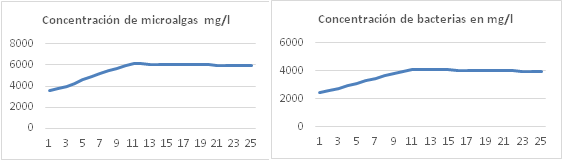
Variación de la concentración algas y bacterias
Las variaciones en las concentraciones de algas y bacterias obtenidas con el modelo fueron comparadas con las reportadas en los experimentos, el error nunca supera el 3% (figura 4). Según el modelo, la velocidad de crecimiento de los microorganismos se ve afectada por: la temperatura de la suspensión de cultivo, la concentración inicial de microorganismos, la velocidad de alimentación del residual líquido porcino y el pH de la suspensión de cultivo.
La temperatura de la suspensión de cultivo depende de la irradiación solar incidente, la velocidad del viento, la humedad relativa y la inclinación del canal de cultivo. Valores superiores a 33 oC pueden reducir la productividad por unidad de área de cultivo hasta un 5%, valor que coincide con las estimaciones de los modelos propuestos por 6,7,12.
La concentración inicial de microorganismos (algas + bacterias) es un factor muy importante y puede reducir la productividad por unidad de área de cultivo en un 40%, por ejemplo, a concentraciones de microorganismos superiores a 5000 mg/L se puede alcanzar una productividad cercana a 40000 mg/m2d, sin embargo, a una concentración inicial de 3000 mg/L solo es posible una productividad de 24000 mg/m2.d.
A concentraciones de microorganismos (algas + bacterias) superiores a 5000 mg/l e inferiores a 7500 mg/L la cantidad de materia orgánica requerida en términos de DBO es de 40000 mg/m2.d, a razón de 4444 mg/h, velocidades inferiores de alimentación reducen la velocidad de crecimiento microbiana por limitación de dióxido de carbono y oxígeno disuelto, velocidades superiores de alimentación provocan incremento del pH, por ejemplo, a velocidad de 5555 mg/h de materia orgánica el pH puede subir hasta 8,6 y a 6666 mg/h el pH sube hasta 8,75, esto reduce la velocidad de crecimiento de las algas ya que se limita el dióxido de carbono disuelto y aumenta la concentración del ion bicarbonato [ • 𝐻𝐶𝑂 • 3 • − • ]. Velocidades de alimentación de materia orgánica superiores a 6666 mg/h provocan colapso del sistema.
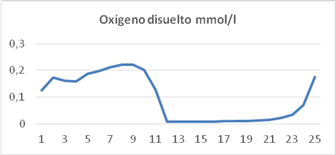
Variación de la concentración de oxígeno disuelto
Las concentraciones de oxígeno disuelto reportadas en los experimentos fueron estimadas por el modelo con un error inferior al 6 % en todos los casos. En las primeras horas de la mañana la concentración de oxígeno disuelto en la suspensión de cultivo sube hasta alcanzar 0,21 mmol/L, por la elevada actividad de las algas, se mantiene entre 0,15 m mol/L y 0,19 m mol/L durante todo el día. Durante la noche la concentración de oxígeno disuelto en la suspensión de cultivo es muy baja, alrededor de 0,008 mmol/L, las algas están inactivas y las bacterias continúan degradando la materia orgánica residual del día (figura 5). Valores similares han sido reportados para estanques de algas alta tasa de crecimiento. 6,7,12
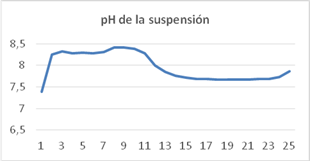
Variación del pH en la suspensión de cultivo
Los valores de pH predichos por el modelo coinciden con los conseguidos en los experimentos, el error nunca supera el 3,6 %. Estos valores son similares a los obtenidos cuando se utiliza el modelo propuesto en referencias anteriores. (6,7,12 No sucede lo mismo si se emplea el modelo propuesto por 13 ya que el error puede superar el 12,5 % y por tanto no se ajusta a los resultados experimentales obtenidos.
Si se utiliza el modelo propuesto se puede ver el comportamiento del pH en función de la alimentación de nutrientes al sistema, si la alimentación es continua el pH sigue un comportamiento similar al simulado en la figura 6, sin embargo, cuando la alimentación es discontinua el pH sube cuando se alimentan los nutrientes y baja con el consumo de nutrientes, por ende, tiene picos durante el día.
A medida que el CO2 es consumido por las algas, el pH aumenta debido a consideraciones de equilibrio al igual que el oxígeno disuelto que incrementa en las primeras horas y posteriormente se equilibra en un valor constante y más bajo. En contraste, cuando el substrato orgánico es consumido, el nivel de oxígeno disuelto baja y el pH disminuye debido a la producción de CO2. Por lo tanto, se anticipa que las dos variables se muevan en la misma dirección, si la tendencia es ascendente, las reacciones de las algas son dominantes, si es descendente, las reacciones bacterias son predominantes.
La simulación demuestra que después arrancar las bombas, las reacciones de las algas son claramente más rápidas y el pH aumenta, mientras la concentración de CO2 disuelto en la suspensión se reduce. Cuando el pH alcanza cerca de 8.5, la velocidad de crecimiento de las algas es severamente limitada debido a la no disponibilidad progresiva de CO2. La velocidad con la cual el pH aumenta se reduce y la producción de oxígeno se retarda. El pH, no obstante, se mantiene alto, porque el CO2 disponible es utilizado por las algas.
Al medio día, el pH y oxígeno disuelto se mantienen altos, con algunas fluctuaciones. El pH alto causa pérdidas de NH3 a la atmósfera. Durante la noche las reacciones bacterianas son predominantes, la concentración de oxígeno en la suspensión de cultivo y el pH bajan, este último se estabiliza en valores próximos a 7,6. En la figura 6 se presenta el pH de la suspensión de cultivo.
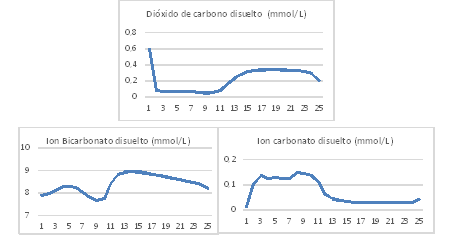
Variación de la concentración de dióxido de carbono disuelto
Las concentraciones de dióxido de carbono disuelto en los experimentos fueron estimadas por el modelo con un error inferior al 5 % en todos los casos. La concentración de dióxido de carbono disuelto disminuye durante el día ya que las reacciones de las algas son predominantes y aumentan en la noche cuando las reacciones de las bacterias son predominantes. Sin embargo, las concentraciones de ion bicarbonato permanecen estable durante el día y las de ion carbonato aumentan durante el día y disminuyen en la noche tal y como lo hace el pH de la suspensión de cultivo (figura 7). Valores similares han sido reportados por 6,7,12) en un estanque de algas de alta tasa de crecimiento.
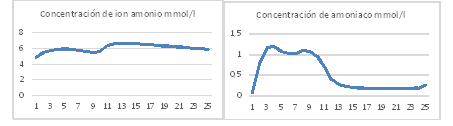
Variación de la concentración de nitrógeno amoniacal disuelto
Las concentraciones de nitrógeno amoniacal experimental fueron estimadas por el modelo con un error inferior al 7 %. Durante el día la concentración de amoniaco en la suspensión de cultivo permanece alta, esto facilita el desprendimiento de este gas a la atmosfera, y durante la noche baja. Las concentraciones de ion amonio permanecen altas durante todo el día y se mueven entre 4,4 y 6 m mol/L esto garantiza el nitrógeno necesario para el crecimiento de algas y bacterias (figura 8). Valores similares han sido reportados por 6,7,12) en un estanque de algas de alta tasa de crecimiento.
Características generales de operación
En la tabla 3 se comparan los resultados del modelo con los reportados.
Tabla 3 Resultados experimentales y del modelo
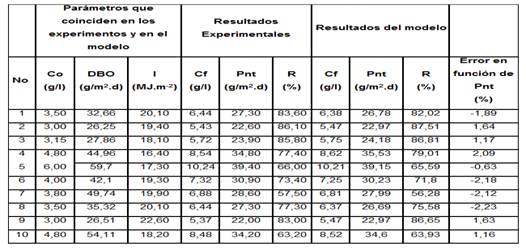
Co - es la concentración inicial de microorganismos (algas + bacterias) y Cf la concentración final en (g/L).
Pnt - es la productividad neta notal en (g/m2.d) y DBO es la DBO5 añadida por metro cuadrado de superficie de cultivo en (g/m2.d).
% R- Porciento de remoción de la materia orgánica en (%).
I - Irradiación incidente en (MJ.m-2).
Los resultados del modelo coinciden con los reportados. Por tanto, con el modelo es posible simular un fotobiorreactor de capa fina para el cultivo de algas + bacterias y definir sus parámetros típicos de operación.
Conclusiones
El modelo matemático dinámico desarrollado describe el crecimiento de algas y bacterias en un fotobiorreactor de capa fina de 3500 m2, que utiliza el residual líquido porcino como única fuente de materia orgánica y nutrientes, al comparar la productividad neta total diaria estimada, con los resultados experimentales, el error nunca excede + -2,5%.
Las variaciones en las concentraciones de dióxido de carbono, nitrógeno amoniacal y ortofosfatos disueltos en la suspensión de cultivo se ajustan a las obtenidas experimentalmente y el error de estimación es menor de un 8%.
Para la estimación del pH resulta indispensable tener en cuenta la concentración total de carbono inorgánico, nitrógeno amoniacal, ortofosfatos disueltos e iones inertes.
El valor del pH obtenido en el modelo se ajusta a los datos experimentales y permite la distribución resultante de las sub-especies químicas individuales, lo que facilita utilizar la concentración de CO2 en la suspensión de cultivo como factor limitante del crecimiento de las algas y por tanto regular la velocidad de crecimiento en función del pH.
La cantidad de materia orgánica en el residual añadido, en términos de DBO, está en función de la concentración de microorganismos y nunca debe ser superior a 45 g/m2.d, lo que garantiza buena productividad por unidad de área de cultivo y remoción de la materia orgánica superior al 90%.
A continuación en la figura 9 se presenta la nomenclatura utilizada en el trabajo