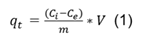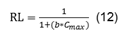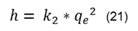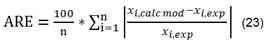Introducción
La descarga de efluentes industriales coloreados incide en la contaminación de las fuentes de agua, se manifiesta con afectaciones, a la biota acuática, 1,2) al deterioro visual del entorno,3 y los productos de su degradación pueden tener características carcinogénicas y toxicas.4,5) Se estima que una producción anual de 7x105a 1x106 toneladas.6) Se utilizan en procesos textiles, de papel, cuero, plásticos, alimentos, medicamentos, cosméticos.5,7) Son difíciles de decolorar debido a su compleja estructura y a su origen sintético.8)
El azul de metileno, es un colorante de naturaleza catiónica, utilizado principalmente en la tinción de algodón, madera y seda.4) Es considerado un compuesto con efectos secundarios perjudiciales para la salud, dada sus características de toxicidad debido a que incrementa el ritmo cardíaco, produce alteraciones gástricas y nerviosas, así como también puede inducir la aparición de enfermedades cutáneas como la cianosis e ictericia.3
Diversos tratamientos han sido aplicados para la remoción de color de las aguas residuales: degradación fotocatalítica, coagulación y floculación, separación con membranas y degradación electroquímica, limitándose su uso a gran escala debido a su alto costo.7) La adsorción, es una opción de tratamiento que, separa sustancias al poner en contacto un fluido con un sólido adsorbente, este es un fenómeno mediante el cual el adsorbato queda retenido en la superficie exterior y en los poros interiores del sólido, 6 con los adsorbentes convencionales, como el carbón activado se presenta la desventaja del alto costo.
En los últimos años se ha divulgado la adsorción de azul de metileno utilizando adsorbentes de bajo costo como residuos de agricultura, desechos sólidos industriales, entre los que se encuentra bagazo de Agave salmiana, sorgo y avena,8) cascarillas de arroz,3) biomasa cáscara de yuca (Manihotesculenta) modificada químicamente con ácido oxálico,9) también se reporta paja de sorgo para eliminación de cromo VI 10 y de bagazo de caña y cáscara de cacaopara remover plomo y cadmio de aguas residuales mineras.11
La identificación de los diferentes mecanismos de adsorción que ocurren durante la remoción de azul de metileno en disolución acuosa con residuos agrícolas de sorgo y bagazo de caña de azúcar es propósito de esta investigación que presenta el equilibrio y estudio cinético correspondiente a esos sistemas. Se muestran los modelos de mejor ajuste considerando los coeficientes de correlación, R2, suma de cuadrados del error (SSE) y error relativo promedio (ARE).
Materiales y métodos
Preparación del adsorbato
La solución patrón de azul de metileno se prepara a una concentración másica de 1 g/L. A partir de ella se hacen las diluciones volumétricas, para los diferentes análisis. Se realizaun barrido de exploración de 320 nm a 700 nm para escoger la longitud de onda de máxima de absorción mediante espectroscopiaUV-Vis, empleando espectrofotómetro marca Rayleígh VIS-7236 UV-Vis, China.
Preparación de la biomasa
Los residuos agrícolas de sorgo (RAS) se obtienen de los cultivos de campesino del municipio de Santa Clara y fueron recolectados días posteriores a la cosecha; mientras que el bagazo de caña de azúcar (BCA) procede de productores del municipio Cruces.
La preparación se inicia con la molienda, empleando un molino MF10 Basic, Alemania; seguida de tamizado, en tamiz Marui con tamices de diámetros de 2 mm; 1 mm; 0,84 mm; 0,63 mm; 0,355 mm; posteriormente se lavan con abundante agua para eliminar impurezas y sus fracciones solubles; continua el secado (estufa Binder, Alemania) a temperatura de 50 °C por 48 h.
Estudio de equilibrio
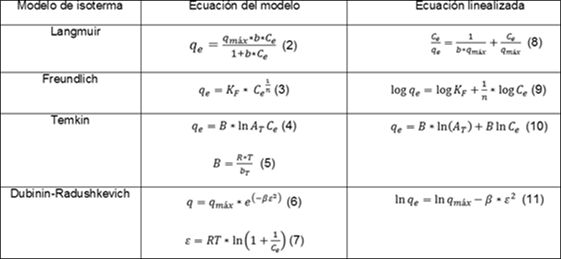
Este análisis se lleva a cabo estableciendo isotermas a tres temperaturas diferentes para cada biosorbente, con la relación biomasa solución de 10 g/L en diferentes soluciones de azul de metileno desde 10 mg/L hasta 100 mg/L, manteniendo agitación constante en 80 rpm, pH de 5,5 u y tamaño de partícula (0,35 - 0,63) mm. Transcurrida 1 h, tiempo establecido para el estudio, se calcula la cantidad de colorante adsorbida en el tiempo, (qt)mediante la ecuación 1. Los modelos de isotermas de adsorción seleccionados para interpretar el proceso fisicoquímico fueron Langmuir, Freundlich; 2,9,12) Temkin y Dubinin-Radushkevich.13) En la tabla 1 aparecen las ecuaciones que los representan (ecuaciones 2, 3, 4 y 6), y suforma lineal (ecuaciones 8, 9, 10, y 11).
donde:
qt, es la cantidad de AM retenido por unidad de masa de adsorbente, mg/g
Ci y Ce:, representan la concentración inicial y concentración equilibrio respectivamente, mg/L
m, es la masa de adsorbente, g
V,simboliza el volumen de la solución, L.
donde:
qe, es el equilibrio alcanzado del adsorbato en el adsorbente, mg/g
qmax, es la máxima capacidad de adsorción, mg/g
Ce, es la adsorción en equilibrio del adsorbato en solución, mg/L
b, energía relativa de adsorción, L/mg
KF, capacidad de adsorción, (mg/g)*(L/mg) 1/n
n, intensidad de adsorción
A t , es la constante de equilibrio de la isoterma de Temkin, L/g
B, es la constante relacionada con el calor de adsorción, J/mol
R, es la constante universal de los gases, 8.314 J/mol K
Beta: β, es la constante del modelo Dubinin-Radushkevich,mol2/kJ2
Épsilon: ε, potencial de Polanyi el cual se relaciona con la concentración de equilibrio.
El parámetro de equilibrio o factor de separación adimensional, RL, permite definir el nivel de afinidad en el proceso de adsorción, se obtiene a partir de la isoterma de Langmuir:
Estudio cinético
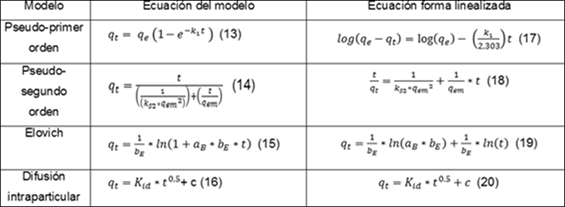
Los ensayos se realizan para diferentes tiempos en los intervalos de 0 a 300 min, concentración de azul de metileno de 300 mg/L, pH de 5,5 u , concentración de biomasa de 10 g/L, agitación de 80 rpm a 30 oC de temperatura, la capacidad de sorción en el tiempo (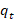 ) se determina usando la ecuación (1). Los parámetros cinéticos, para los modelos seleccionados:pseudo primer orden, pseudo segundo orden, 2,9) Elovich, 12,14 difusión intraparticular,14,15) seobtienen a partir de las ecuaciones específicas que representan a cada modelo, ecuación (13) a ecuación ((16) después de graficar según las correspondientes ecuaciones linealizadas (17) a (20). En la tabla 2 aparecen estas expresiones.
) se determina usando la ecuación (1). Los parámetros cinéticos, para los modelos seleccionados:pseudo primer orden, pseudo segundo orden, 2,9) Elovich, 12,14 difusión intraparticular,14,15) seobtienen a partir de las ecuaciones específicas que representan a cada modelo, ecuación (13) a ecuación ((16) después de graficar según las correspondientes ecuaciones linealizadas (17) a (20). En la tabla 2 aparecen estas expresiones.
donde:
qey qt, son la capacidad de sorción en el equilibrio y a cualquier tiempo t, respectivamente, mg/g
k1, es la constante de velocidad de pseudo-primer orden, min -1
ks2,simboliza la constante de velocidad de pseudo-segundo orden, g/mg*min
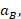 representa la velocidad de sorción inicial, mg/g*min
representa la velocidad de sorción inicial, mg/g*min
bE, está relacionado con la extensión de la superficie ocupada, g/mg
t, es el tiempo, min
Kid, significa la constante de velocidad de difusión intraparticular, mg/g · min-1/2
c, constante que brinda información sobre el espesor de la capa límite, mg/g
Aplicando el modelo de segundo orden puede obtenerse la velocidad de sorción inicial, h (mg/g*min), mediante la ecuación (21):
Análisis del error
Con el propósito de encontrar el modelo de mejor ajuste a los datos experimentales se consideraron los errores estadísticos suma de cuadrados del error,(SSE) yerror relativo promedio, (ARE), se describen matemáticamente mediante las Ecuaciones (22) y (23) respectivamente.
donde:
xi, exp son los valores obtenidos experimentalmente
xicalcmod son los valores calculados por la ecuación que representa cada modelo
Desde: i = 1 hasta i=n, representa el número de comprobaciones.
Resultados y discusión
Estudio de equilibrio
En la representación de las isotermas experimentales y correspondientes a cada modelo para RAS y BCA (figuras 1 y 2), se observa la diferencia en las formas para los dos biosorbentes. Al considerar la clasificación de Giles et al, referida por 13) (16la adsorción con los RAS corresponde a isoterma tipo S o sigmoidal, este tipo se produce cuando existe una moderada atracción intermolecular entre el adsorbato y el adsorbente, en una primera etapa hay poca afinidad,se incrementa de forma proporcional a la concentración; mientras que la adsorción con BCA ocurre según isoterma tipo L sin meseta definida,esta característica sugiere que la cantidad adsorbida aumenta más lentamente, a medida que se incrementa la concentración del adsorbente, en el equilibrio, en la fase líquida.
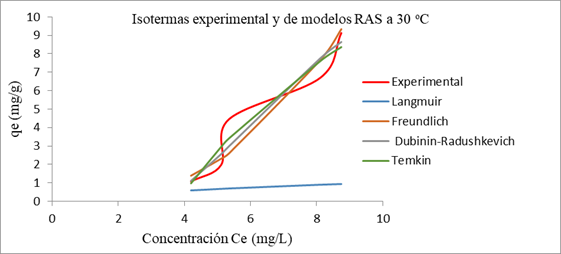
Fig. 1 Isoterma de adsorción de azul de metileno en disolución en RAS experimental y para modelos a temperatura 30 oC, concentración de biomasa de 10 g/L, agitación de 80 rpm, pH de 5,5 u y tamaño de partícula (0,35 - 0,63) mm.
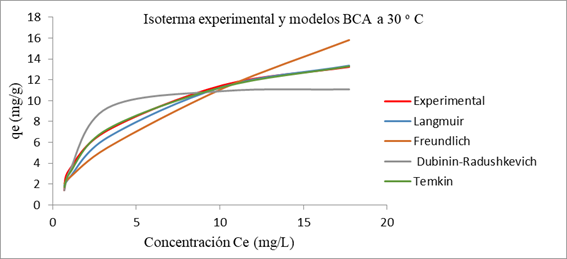
Fig.2 Isoterma de adsorción de azul de metileno en disolución en BCA experimental y para modelos a temperatura 30 oC, concentración de biomasa de 10 g/L, agitación de 80 rpm, pH de 5,5 u y tamaño de partícula (0,35 - 0,63) mm
En la tabla 3 se muestran los parámetros que definen cada modelo, con los valores de los respectivos coeficientes de correlación y errores estadísticos. El mejor ajuste, por los tres criterios, para ambos residuos, se presenta por el modelo de Temkin que se caracteriza por la distribución uniforme de energía hasta alcanzar la máxima energía de unión y supone una reducción proporcional del calor de adsorción con el grado de recubrimiento. Éste modelo plantea la hipótesis la disminución de la entalpía de adsorción al aumentar el grado de recubrimiento sobre el adsorbente.
Tabla 3 Parámetros para los modelos de isotermas Langmuir, Freundlich, Temkin y DubininRadushkevich para los RAS y BCA a concentración de biomasa de 10 g/L, agitación de 80 rpm, pH de 5,5 u y tamaño de partícula (0,35 - 0,63) mm.
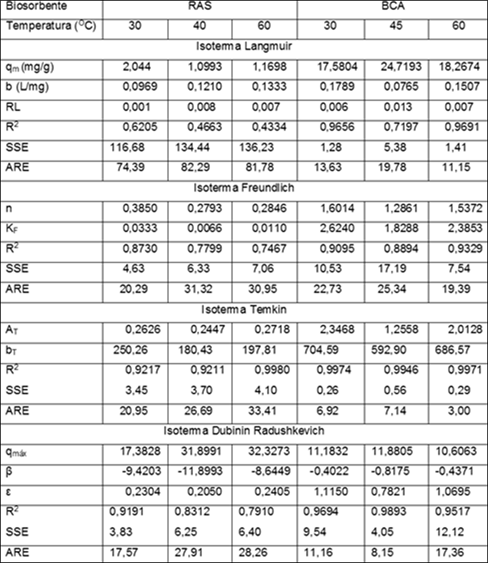
El valor del parámetro de equilibrio, obtenido a partir de la isoterma de Langmuir, para los dos sistemas a las tres temperaturas indica que la adsorción es favorable, al cumplirse que los valores se encuentran entre 0 y 1.
Estudio cinético
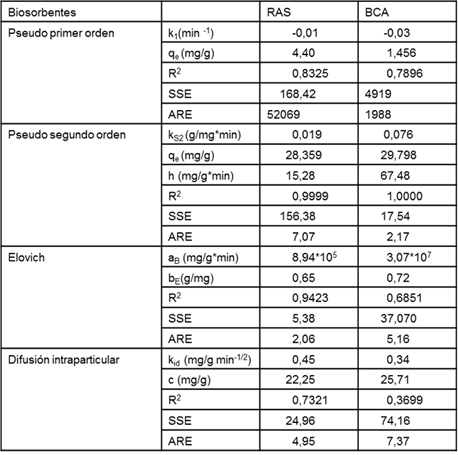
Los parámetros que definen a cada modelo cinético con sus coeficientes de correlación y errores SSE y ARE se detallan en la tabla 4. El modelo pseudo segundo orden presenta un coeficiente de correlación lineal, R2 superior a 0,99 en todos los casos y con valores de capacidad de adsorción en el equilibrio calculados a partir del modelo análogos a los obtenidos experimentalmente. Estos resultadossugieren que el proceso de adsorción de azul de metileno con BCA y RASestá controlado por la adsorción química o quimisorción, involucrando fuerzas de atracción debidas a las valencias o intercambio de electrones entre el azul de metileno y los grupos funcionales presentes en esas superficies.
Existe coincidencia en el mejor ajuste al modelo de pseudo segundo orden con criterios de error SSE y ARpara el BCA, sin embargo, para RAS corresponden al modelo Elovich que también reproduce de forma aceptable los resultados con 0,942 3 de R2.
La velocidad de sorción inicial es cuatro veces superior para BCA.
Resultados similares han obtenidopara la adsorción de AM sobre pericarpio de Zea mays, residuo de Medicago sativa y bagazo de Agave tequilana, 6 utilizando cáscara de yuca modificada con ácido oxálico para remover azul de metileno en disolución 9 y en la adsorción del colorante DB-86 sobre carbón activado de la cáscara de yuca.5
Los parámetros que se presentan en la tabla 4, corresponden a los modelos cineticos. pseudo primer orden, pseudo segundo orden, Elovich y difusión intraparticular para los estudios en discontinuo correspondiente al proceso de biosorción para azul de metileno con RAS y BCA a temperatura 30°C para tiempo de contacto hasta 300 min, concentración de azul de metileno de 300 g/L, concentración de biomasa de 10 g/L, agitación de 80 rpm, pH de 5,5 u y tamaño de partícula (0,35 -0,63) mm.
Conclusiones
Los datos obtenidos del equilibrio de biosorción a diferentes temperaturas se ajustanmejor al modelo de isotermas de Temkin, por eso los procesos de adsorción de azul de metileno con RAS y BCA pueden describirse bien como sistemas que presentan distribución uniforme de energía hasta alcanzar la máxima energía de unión con una reducción proporcional del calor de adsorción con el grado de recubrimiento.
La constante de equilibrio y la constante relacionada con el calor de adsorción del modelo Temkinson muy superiores para el BCA, lo que podría sugerir mejores propiedades adsorbentes.
El modelo cinético de pseudo segundo orden representa de forma excelente la adsorción de azul de metileno con RAS y BCA, considerando los criterios coeficiente de correlación y error relativo promedio, lo que indicaque estos procesos están controlados por la adsorción química o quimisorción.
El modelo pseudo segundo orden evidencia que la velocidad de sorción inicial para los BCA es superior a los RAS, sin embargo, las capacidades máximas de adsorciónson análogas.