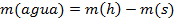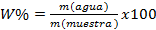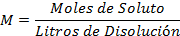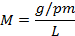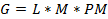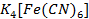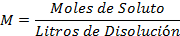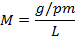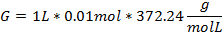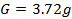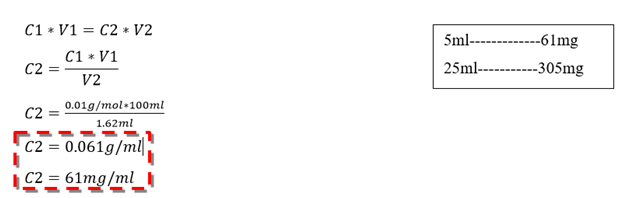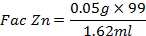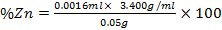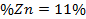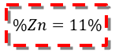INTRODUCCIÓN
El Zinc es conocido por la humanidad desde épocas antiguas, antes de que fueran conocidas sus propiedades elementales. Objetos de latón de hasta 87 % de zinc han sido encontrados en la antigua región de Transilvania. Fue el científico suizo Paracelso en el siglo XVI quien propuso que se trataba de un metal con propiedades propias, a pesar de que se lo confundía a menudo con el bismuto. El zinc fue aislado por primera vez en 1742 y 1746 por Anton von Swab y Andreas Marggraf respectivamente, a partir del calentado de la calamina. El tratado escrito por Marggraf fue tan específico que se lo considera el descubridor de este metal. (Skoog, West, Holler, & Crouch, 2014).
Es un metal plateado o grisáceo, maleable, dúctil y moderadamente duro, por lo que puede enrollarse y tensarse con facilidad. Es un excelente conductor del calor y la electricidad, no es ferromagnético y tiene punto de fusión de 419,5 °C y punto ebullición de 907 °C. Tiene una densidad de 7,13 g/cm3, que es mayor a la del agua (0,998g/cm3). Por otro lado, a una temperatura de 0,91°K (grados Kelvin) se comporta como un superconductor eléctrico, no es un metal tóxico, pero sí lo son algunos de sus compuestos como el óxido y el sulfuro de zinc. (Skoog, West, Holler, & Crouch, 2014)
Casi siempre es divalente en sus compuestos, reacciona con ácidos liberando átomos de hidrógeno y formando cationes (Zn2+). Por otra parte, es soluble en soluciones fuertemente alcalinas para formar tetrahidroxozincatos (Zn [OH]). En presencia de aire es combustible con dificultad, produce una llama azul verdosa y libera un humo de óxido de zinc. Si el aire está libre de humedad casi no reacciona con el zinc, pero si está húmedo, lo oxida. (ZnO) (Skoog, West, Holler, & Crouch, 2014).
El zinc fue reconocido por primera vez como esencial para un sistema biológico en 1869, cuando se realizaron estudios con Aspergillus niger. En 1926 se determinó que era esencial para plantas superiores y en 1934 se demostró su importante influencia en el crecimiento de las ratas. En 1955 se relacionó la paraqueratosis en cerdos con la deficiencia de zinc; posteriormente se conoció su importancia para el crecimiento de las gallinas.
En humanos, las primeras referencias datan de 1956, cuando se estudió su metabolismo en individuos cirróticos. (Obiagwu, Eleje, & Obiechina, 2023).
Aún al inicio de los años 70 del pasado siglo se creía que la deficiencia de zinc nunca podía ocurrir en humanos, ya que su presencia era ubicua y el análisis de los alimentos mostraba adecuada cantidad del mineral en la dieta humana. Sin embargo, en 1961 se describió lo que hoy se conoce como síndrome de deficiencia de zinc. (Obiagwu, Eleje, & Obiechina, 2023).
La importancia del zinc como un nutriente esencial para la salud humana es de amplio conocimiento. Ahora se conoce que más de 100 enzimas necesitan zinc para su función catalítica. A diferencia de otros elementos traza, se pueden encontrar ejemplos de enzimas que requieren zinc en las seis clases de enzimas (oxidorreductasas, transferasas, hidrolasas, lisasas, isomerasas y ligasas). (Sahebnasagh, Aksi, & Eslami, 2023).
Por ende, el zinc participa en una gama de procesos bioquímicos relacionados con el metabolismo humano y no es extraño que múltiples funciones fisiológicas y metabólicas se vean alteradas cuando ocurre su deficiencia que tiene consecuencias sobre el desempeño del sistema nervioso, ya que causa desórdenes emocionales, pérdida de memoria o disminución de la concentración. Además, se le asocia a la pérdida de cabello, debilidad en las uñas, cansancio general e incluso inapetencia sexual. (Saragoza Villanueva, 2023).
El zinc tiene funciones catalíticas, estructurales y reguladoras. La anhidrasa carbónica, carboxipeptidasas, fosfatasa alcalina y la β-lactamasa son algunas enzimas en las que el rol catalítico del zinc es necesario para su función biológica. En su rol estructural el zinc estabiliza la estructura terciaria de enzimas, dándoles una forma conocida como “dedos de zinc”, las cuales se unen al ADN para la transcripción y expresión génica. Se ha estimado que el 3% de los genes codifican proteínas que contienen dedos de zinc. Ejemplos de factores de transcripción de dedos de zinc son los receptores del ácido retinoico y del 1,25-dihidroxicalciferol. (Saragoza Villanueva, 2023).
Finalmente, los iones de zinc intracelulares cumplen una función reguladora activando o inhibiendo ciertos factores que son responsables de regular la expresión genética. El zinc se encuentra presente en todos los órganos, tejidos, fluidos y secreciones del cuerpo humano. Aproximadamente el 83% del zinc en el cuerpo está en músculo y hueso y el 95% se encuentra a nivel intracelular. No existe un lugar anatómico específico que funcione como reserva de zinc y por ende no hay reservas convencionales en tejidos que puedan ser liberadas o almacenadas en respuesta a variaciones en la dieta. (Shah, Gupta, & Meena, 2023).
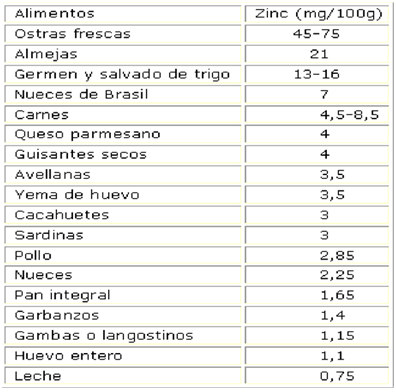
Las proteínas animales son una buena fuente de zinc. Las carnes de res, cerdo y cordero contienen mayor cantidad de zinc que el pescado. La carne oscura de un pollo contiene más cantidad de zinc que la carne blanca. Otras fuentes buenas de zinc son las nueces, los granos enteros, las legumbres y la levadura. Las frutas y las verduras no son buenas fuentes, porque el zinc en los alimentos vegetales no está tan disponible para el consumo humano como el zinc de las fuentes animales. (Amini & Farsani, 2023).
Por lo tanto, las dietas bajas en proteínas y las dietas vegetarianas tienden a ser bajas en zinc. El zinc está en la mayoría de los multivitamínicos y suplementos minerales. Estos suplementos pueden contener gluconato, sulfato o acetato de zinc. No se sabe si una forma es mejor que las otras. El zinc también se encuentra en algunos medicamentos de venta libre, como pastillas, aerosoles nasales y geles nasales para resfriados. (Amini & Farsani, 2023) (Figura 1)
El fruto del S. saman es una vaina que inicia su desarrollo inmediatamente después de la polinización, pero después de alcanzar una longitud de 3 a 4 cm, comenzando de un período de 8 meses de latencia. Finaliza su crecimiento al final de la estación lluviosa, alcanzando la madurez con la estación seca. La maduración del fruto se presenta de febrero a mayo, aunque la máxima producción se presenta de abril a mayo. La vaina es indehiscente, leñosa, aplanada, de 10 a 25 cm de largo, recta o curvada, de 2.5 a 3.5 cm de ancho y casi 1 cm de grosor. Un par de valvas leñosas con prominentes suturas dorso ventrales forman el pericarpio del fruto. (Mílian Domínguez, Iglesisas Monroy, Valdéz Marquez, & Sanjudo Ramos, 2017).
El epicarpio es rojizo pardo o pardo brillante y ligeramente excavado en la superficie lateral; el mesocarpio está pobremente desarrollado y no se puede distinguir; el endocarpio es opaco y forma una pulpa pegajosa que puede ser blancuzca, cremosa o ligeramente parda. Las semillas están separadas del endocarpio, son oblongas, lateralmente comprimidas, de 1.0 cm de largo y 0.7 cm de ancho, con 0.5 cm de grosor. La producción de semilla viable por fruto es de cerca del 20 %; 15 % son semillas abortivas, y las remanentes sufren daños de gorgojos o diferentes larvas de insectos. Las vainas deben recolectarse de febrero a abril y ser colocadas en sacos abiertos. Las semillas se extraen manualmente. Éstas deben removerse de las vainas inmediatamente y lavarse en agua corriente; después de lavadas se exponen a pleno sol por varias horas. (Mílian Domínguez, Iglesisas Monroy, Valdéz Marquez, & Sanjudo Ramos, 2017). (Esquema 1). El objetivo de esta investigación es identificar cualitativamente y cualitativamente la presencia de Zinc en la vaina del fruto seco de S. saman.
MATERIALES Y MÉTODOS
Selección y Características del área de estudio.
El área de estudio seleccionada fue la finca agroecológica: El Algarrobo, área que dispone más de 50 Algarrobos en diferentes estadios de desarrollo, lo que nos permite tener una buena fuente segura de materia prima para la investigación, además de la cercanía de Finca a local de investigación lo que permite que las vainas sean recolectadas y estudiadas en el menor tiempo posible.
Toma muestras de las vainas del fruto seco de S. saman
Se empleó el uso directo de la vaina del fruto seco de S.saman, se tomó de árboles en pie, con edades comprendidas entre 10 y 15 años, edad en la cual se considera arboles joven debido a que es una especie forestal de crecimiento esta corta edad nos permite obtener más cantidad de vainas y de mayor tamaño, la recolección se realizó en el mes de marzo de 2023 periodo del año en que las vainas se encuentran secas y lista para ser recogidas. El muestreo se realizó de forma aleatoria, tomando vainas secas de 3 árboles con las edades antes mencionadas. Su identificación fue confirmada por el departamento de Botánica de la Universidad de Pinar del Río.
Procesamiento de las muestras
Las vainas secas se recolectaron en horas de la mañana y se trasladó al laboratorio de investigación, se le realizó un estudio de pH y de humedad al suelo con el objetivo de medir los parámetros químico-físicos, el suelo tenía un pH igual a 7,21 y un porciento de humedad de 9,5%. Las vainas se desinfectan primeramente con hipoclorito de sodio al 1% y agua destilada posteriormente, dentro de un periodo de 8 días se voltearon las vainas secas para conseguir un estado homogéneo de la muestra.
Determinación de los parámetros de calidad de las muestras
Determinación de la humedad
Para determinar la humedad se emplearon los criterios que la definen como la diferencia entre la masa húmeda y la masa seca por cien. (Álvarez Godoy & Pérez Meléndez, 2005)
Para la realización de las pruebas, se empleó una balanza analítica digital Sartorius MC 1, AC 210s, estufa Baxun (china) y Ziehenalemana.
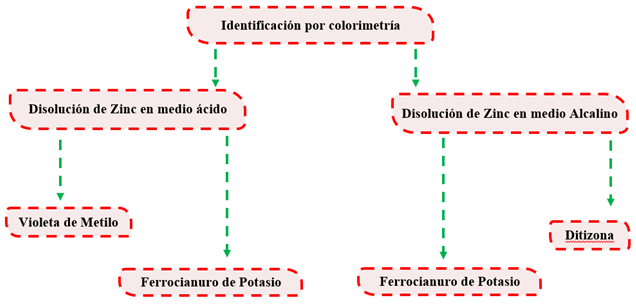
Identificación de Zinc por colorimetría
Los ensayos colorimétricos utilizan reactivos que experimentan un cambio de color medible en presencia del analito. Son ampliamente utilizados en bioquímica para probar la presencia de enzimas, compuestos específicos, anticuerpos, hormonas y muchos más analitos (Alexéiv, 1975). Por ejemplo:
-El paranitrofenilfosfato se convierte en un producto amarillo por la enzima fosfatasa alcalina. (Alexéiv, 1975).
-Coomassie Blue una vez que se une a las proteínas provoca un cambio de espectro, lo que permite la dosificación cuantitativa. Un ensayo colorimétrico similar, el ensayo de ácido bicinconínico, usa una reacción química para determinar la concentración de proteína. (Alexéiv, 1975).
-Los inmuno ensayos ligados a enzimas utilizan anticuerpos con enzimas para detectar antígenos. La unión del anticuerpo a menudo se deduce del cambio de color de reactivos como TMB. (Alexéiv, 1975).
En física y química analítica, la colorimetría es una técnica utilizada para determinar la concentración de compuestos coloreados en solución". Un colorímetro es un dispositivo utilizado para probar la concentración de una solución al medir su absorbancia de una longitud de onda específica de la luz (no debe confundirse con el colorímetro triestímulo usado para medir los colores en general) (Alexéiv, 1975) (Esquema 2).
Técnicas de identificación de Zinc en medio ácido
Disolventes del Zinc
El Zinc se disuelve en ácidos clorhídrico y sulfúrico desprendiendo hidrógeno, con el agua sólo reaccionan superficialmente, al formarse una capa de hidróxido. Un análisis basado en los potenciales estándar de reducción a temperatura ambiente, certifica la reactividad de ácidos minerales sobre el Zinc, ya que este metal posee un potencial bastante bajo igual a 0,76 V, siendo idóneo a la acción de ácidos e inclusive al agua. (Shriver & Atkins, 2006).
Según los valores de entalpía y energía libre de Gibbs, los valores de ambas magnitudes para cada reacción, son negativos lo que indica el carácter espontáneo y exotérmico de cada una de ellas. El ácido nítrico es el oxidante más potente, de tal manera que es el que reacciona de forma más espontánea frente al Zinc. (Shriver & Atkins, 2006) (Figura 2).
Si agregamos zinc en polvo al hidróxido de sodio, la solución se tornó grisácea, quedando un precipitado gris en el fondo del tubo al dejar reposar. (Shriver & Atkins, 2006).
Los valores termodinámicos deducen que la reacción es espontánea, exotérmica y se favorece la formación de los productos. El Zinc metálico a diferencia del cadmio y el mercurio, se disuelve también en soluciones alcalinas (carácter anfótero) debido a su tendencia a formar iones cincato. (Shriver & Atkins, 2006) (Figura 3).
Preparación del medio ácido
Una muestra pesada de vaina seca molida (2 g) se disuelve en 20 ml de HCI (ac) concentrado y un volumen de 400ml de agua destilada la cual se agita durante 15 minutos en un agitador magnético, una vez transcurrido el tiempo se calienta la disolución en un baño maría durante 15 minutos más y posteriormente se vierte en un matraz aforado de 1000ml el cual se lleva con agua destilada hasta su aforo para después agitar, seguidamente se filtra al vacío la disolución. (A.P & Yaroslávtsev, 1982).
Se toma una alícuota de 5ml de la disolución (ácida o alcalina) a la cual se le añade 3ml de 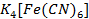 al 10%. La técnica es positiva si se observa una coloración marrón (medio alcalino) o una coloración amarillenta (medio ácido) (Alexéiv, 1975).
al 10%. La técnica es positiva si se observa una coloración marrón (medio alcalino) o una coloración amarillenta (medio ácido) (Alexéiv, 1975).
Violeta de metilo
A 2 ml de agua se añade 5 gotas de una solución saturada de ácido tartárico, una gota de solución de HCl (de 1.12 g/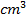 de densidad) dos gotas de una solución al 20% de
de densidad) dos gotas de una solución al 20% de 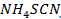 Y una gota de solución al 0.06% de violeta de metilo. Separando en dos partes iguales la solución que bajo la acción de
Y una gota de solución al 0.06% de violeta de metilo. Separando en dos partes iguales la solución que bajo la acción de 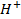 toma una coloración verde celeste, una parte se deja para la comprobación mientras que la otra se añade una o dos gotas de la solución que se ensaya al
toma una coloración verde celeste, una parte se deja para la comprobación mientras que la otra se añade una o dos gotas de la solución que se ensaya al 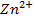 y todo se agita. El paso de la coloración violeta (o azul en caso de baja concentración de zinc) señala la presencia de
y todo se agita. El paso de la coloración violeta (o azul en caso de baja concentración de zinc) señala la presencia de 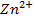 . El exceso de ácido perjudica la reacción. Por eso las soluciones ácidas se neutralizan con la mayor precisión antes de iniciar la prueba. Debe atenerse con mucha exactitud a las dosis y concentraciones de todos los reactivos que se aprovechan, en caso contrario el resultado del ensayo puede resultar erróneo. (Alexéiv, 1975).
. El exceso de ácido perjudica la reacción. Por eso las soluciones ácidas se neutralizan con la mayor precisión antes de iniciar la prueba. Debe atenerse con mucha exactitud a las dosis y concentraciones de todos los reactivos que se aprovechan, en caso contrario el resultado del ensayo puede resultar erróneo. (Alexéiv, 1975).
Preparación del medio alcalino
Una muestra pesada de vaina seca molida (2 g) se disuelve en 20 ml de NaOH (ac) al 100% y un volumen de 400ml de agua destilada la cual se agita durante 15 minutos en un agitador magnético, una vez transcurrido el tiempo se calienta la disolución en un baño maría durante 15 minutos más y posteriormente se vierte en un matraz aforado de 1000ml el cual se lleva con agua destilada hasta su aforo para después agitar, seguidamente se filtra al vacío la disolución. (A.P & Yaroslávtsev, 1982).
Se toma una alícuota de 5ml de la disolución (ácida o alcalina) a la cual se le añade 3ml de 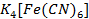 al 10%. La técnica es positiva si se observa una coloración marrón (medio alcalino) o una coloración amarillenta (medio ácido) (Alexéiv, 1975).
al 10%. La técnica es positiva si se observa una coloración marrón (medio alcalino) o una coloración amarillenta (medio ácido) (Alexéiv, 1975).
Ditizona
Se toma una alícuota de 5ml de la disolución de Zinc a la que se le añade 2 ml del indicador Ditizona al 10%. La aparición de un color rojo-carmesí demuestra la presencia de  . En ausencia de
. En ausencia de 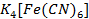 se forma una coloración anaranjada propio de la Ditizona en un medio alcalino. (Alexéiv, 1975).
se forma una coloración anaranjada propio de la Ditizona en un medio alcalino. (Alexéiv, 1975).
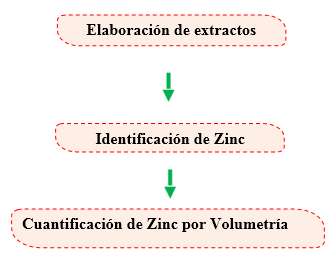
Cuantificación de Zinc por Volumetría
La esencia de análisis volumétrico consiste en lo siguiente: a una disolución preparada a partir de una muestra pesada de una sustancia que se somete al análisis (o una parte determinada del volumen de esta disolución) se añade paulatinamente la disolución de concentración exactamente conocida hasta que las sustancias que interaccionan se combinen completamente. (A.P & Yaroslávtsev, 1982).
Entonces a base de la medición exacta del volumen del reactivo se calcula el contenido del componente a determinar en la muestra que se analiza. El momento en que la reacción llega al final, o sea, cuando la sustancia interacciónate se consume por completo se denomina punto de equivalencia. (A.P & Yaroslávtsev, 1982).
Valoración de Zinc con EDTA
Técnica Operatoria (A.P & Yaroslávtsev, 1982)
Se pesa en una balanza analítica 0.05 g de la vaina seca molida del Samanea Saman la cual se vierte en un vaso precipitado
Se añaden 10 gotas de HCL (ac) estas se redisuelven en 10 ml de agua destilada y se agita en un agitador magnético durante 15 minutos seguidamente.
La disolución se lleva a un matraz aforado de 25 ml, con ayuda de agua destilada se lleva hasta la línea de aforo y se vuelve a agitar.
Se transfieren los 25 ml de la muestra a un vaso precipitado para pipetear 5 ml de la muestra y verterlo en otro vaso precipitado.
A los 5ml de la muestra se le agregan 2 ml de una solución buffer de amonio, esta permite mantener el pH de la muestra constante, comprobamos el pH el cual debe de estar entre 9 y 10.
Se añade el indicador el cual servirá para determinar el volumen del punto de equivalencia, en este caso usamos negro de eriocromo del cual añadiremos pequeñas porciones hasta observar que la disolución tome un color violeta intenso.
A continuación, valoramos con ayuda de una bureta de 100ml la disolución de EDTA preparada al 0.01 M, añadimos gota a gota la disolución de EDTA a la muestra analizada y agitamos hasta que esta cambie de color violeta a azul, anotamos el volumen de EDTA gastado y procedemos a los cálculos.
Se realizaron 4 repeticiones y se promedió el EDTA gastado.
Los mejores resultados se logran al utilizar la disolución valorante de EDTA establecida, el zinc forma con el amoníaco un amoniacato complejo, esto no altera la exactitud de la determinación puesto que él 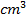 del amoniacato es igual a 10.6, mientras que el
del amoniacato es igual a 10.6, mientras que el  del complejo formado por el EDTA es 16.5, es decir, en el curso de la valoración con el EDTA será valorado todo el Zinc (A.P & Yaroslávtsev, 1982) (Figura 4).
del complejo formado por el EDTA es 16.5, es decir, en el curso de la valoración con el EDTA será valorado todo el Zinc (A.P & Yaroslávtsev, 1982) (Figura 4).
Utensilios de trabajo:
-Vaso precipitado 200ml
-Agitador magnético
-Matraz aforado de 25ml
-Soporte Universal
-Pinzas para Bureta
-Bureta de 100ml
Cálculos empleados para la Valoración
Cálculos para la preparación del EDTA 0.01M. (A.P & Yaroslávtsev, 1982)
Fórmula de la molaridad (1):
Sustituyendo las unidades de medidas (2):
Despejando (2) para calcular los gramos a disolver:
L: Litros M: Molaridad PM: Peso molar del EDTA
Cálculos para la determinación de la concentración de Zinc en la muestra analizada (A.P & Yaroslávtsev, 1982)
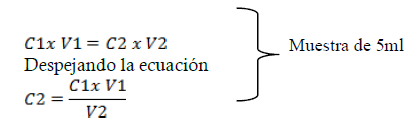
C1: Concentración del EDTA
V1: Volumen total del EDTA empleado
V2: Volumen gastado de EDTA
C2: Concentración de Zinc en la muestra
Regla de tres para determinar la concentración de Zinc en la disolución (25ml):
5-------------x
25-----------y
RESULTADOS Y DISCUSIÓN
Determinación de los parámetros de calidad
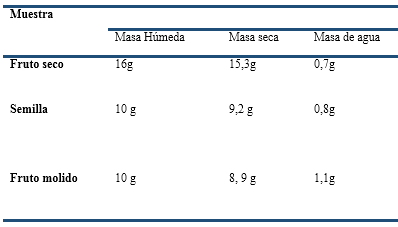
La determinación de los parámetros de calidad se realizó según lo descrito en el epígrafe anterior y ofrecieron los resultados siguientes (Tabla 1).
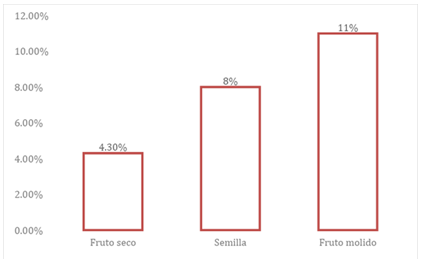
Al apreciar los datos de la tabla anterior donde se expresan los parámetros para calcular la humedad, se puede apreciar que el fruto seco es el que mejor se comporta, aunque presenta la mayor masa húmeda tiende a perder esa masa con mayor facilidad mostrando una diferencia de 0.7g,por su parte la semilla y el fruto seco se comportan con indicadores similares aunque se aprecia pequeñas diferencia en ellos, estos resultados condiciona el porcentaje de humedad obtenido, por lo que al observar la figura 9 podemos decir que el fruto seco y la semilla presentan 4,3% y 8 % respectivamente, parámetros aceptados por la FAO que indica un valor de hasta 8%. Este dato implica que pueden ser conservados una vez recolectados y limpios por un periodo de tiempo mayor. No así el fruto molido que presenta un porcentaje desfavorable por lo que su utilización debe ser en un período más corto debido a que puede sufrir putrefacción y perder sus propiedades en un tiempo más rápido. (Gráfico 1).
Identificación de Zinc en el fruto seco de S. saman
Se realizó siguiendo los pasos propuestos en el epígrafe 2.4 aplicando la técnica de colorimetría propuesta por (A.P & Yaroslávtsev, 1982) (Tabla 2).
Tabla 2 Determinación de Zinc por técnica colorimétrica en medio ácido y básico.

Leyenda:( + Poca presencia; ++ Mediana presencia; +++ Alta presencia)
En el medio ácido se emplearon dos técnicas para la identificación de Zinc, primeramente, podemos observar que la técnica donde se utilizó el indicador violeta de metilo nos indica que existe una presencia del metal en la vaina seca del Samanea. Esta presencia nos es total (++), basándonos en lo indicado en la técnica cuando nos dice: la coloración violeta señala la presencia de Zinc mientras que una coloración azul indica una baja concentración del metal. Por lo observado en el laboratorio esta coloración no es totalmente violeta, sino que tiende a tornarse más azul (Figura 5).
Por otra parte, la técnica de ferrocianuro de potasio nos indica también que existe una presencia del metal en la vaina seca del S. saman, pero a diferencia de la técnica anterior esta indica que existe una alta presencia (+++), basándose en lo planteado por la técnica: una coloración marrón o amarillenta indica una presencia positiva, lo que se pudo constatar en el laboratorio la presencia amarillenta mencionada en la técnica.
Por otra parte, la técnica de ferrocianuro de potasio nos indica también que existe una presencia del metal en la vaina seca del S. saman, pero a diferencia de la técnica anterior esta indica que existe una alta presencia (+++), basándose en lo planteado por la técnica: una coloración marrón o amarillenta indica una presencia positiva, lo que se pudo constatar en el laboratorio la presencia amarillenta mencionada en la técnica (Figura 6).
Es evidente que existe un antagonismo moderado entre las dos técnicas empleadas esto se debe a que la técnica donde se emplea violeta de metilo puede estar interfiriendo el 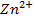 donde es conocido de su existencia en la vaina seca de Samanea Saman por estudios realizados anteriormente por (Alonso, 2021).
donde es conocido de su existencia en la vaina seca de Samanea Saman por estudios realizados anteriormente por (Alonso, 2021).
En el medio básico se emplearon también dos técnicas para la identificación del Zinc donde coincide en ambos medios la de ferrocianuro de potasio ya que esta tiene un carácter anfótropo, también este ensayo nos muestra una alta presencia del metal en el medio básico (+++), corroborado por la técnica donde plantea: una coloración marrón o amarillenta indica una presencia positiva, la cual se pudo corroborar en el laboratorio la presencia de una coloración marrón (Figura 7).
La Ditizona al 10% nos muestra también una alta presencia del metal en la vaina del fruto seco de Samanea, donde se pudo comprobar por lo planteado en la técnica: que la aparición de un color rojo-carmesí demuestra la presencia de 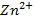 . En ausencia de
. En ausencia de  toma una coloración anaranjada propio de la Ditizona en un medio alcalino. En el laboratorio se comprobó la coloración rojo carmesí, se tomó una disolución alcalina en ausencia de Zinc la cual sirvió para comparar las coloraciones (Figura 8).
toma una coloración anaranjada propio de la Ditizona en un medio alcalino. En el laboratorio se comprobó la coloración rojo carmesí, se tomó una disolución alcalina en ausencia de Zinc la cual sirvió para comparar las coloraciones (Figura 8).
Cálculos
Cálculos para la preparación del EDTA 0.01M
Fórmula de la molaridad (1):
Sustituyendo las unidades de medidas (2):
Despejando (2) para calcular los gramos a disolver:
L: Litros M: Molaridad PM: Peso molar del EDTA
Para preparar la sustancia patrón de EDTA al 0.01M hay que disolver 3.72g en 1L de agua destilada (Figura 9).
Cálculos para la determinación del % de Zinc en la muestra analizada
Se puedo comprobar mediante cálculos que la vaina del fruto seco de S. saman presenta una construcción de 305 mg en 25 ml de la disolución estudiada cantidad que representa un 55 % del mineral, esto afirma la veracidad del análisis cualitativo y potencia la vaina seca como fruto de un alto contenido de Zinc.
Requerimiento de Zinc en la salud humana
Los requerimientos de zinc normalmente son estimados como el requerimiento fisiológico promedio, el cual se define como la cantidad de zinc que debe ser absorbido para contrarrestar la cantidad de zinc que se pierde tanto a nivel intestinal como de otros sitios (orina, pérdidas por piel, cabello, uñas y sudor, y en adolescentes y adultos, semen y menstruación). En niños también hay que añadir la cantidad de zinc usada para el crecimiento (Ramu, Neild, Naish, & Syndercombe Court, 2019) (Tabla 4)
Según (Mason & Booth, 2020), las recomendaciones de zinc, así como de otros nutrientes, son proporcionadas en el Consumo de Referencia Alimenticio (DRI, por sus siglas en inglés) desarrollado por el Comité de Nutrición y Alimentos en las Academias Nacionales de Ciencias, Ingeniería y Medicina. DRI es una sigla para un conjunto de consumos de referencia que se usan para planear y evaluar la ingesta de nutrientes de las personas saludables. Estos valores, los cuales varían según la edad y el sexo, incluyen:
-Ración Diaria Recomendada (RDA, por sus siglas en inglés) -- El nivel diario promedio de consumo que es suficiente para cubrir las necesidades de nutrientes de casi todas (97% a 98%) las personas saludables. Una RDA es un nivel de consumo basado en datos obtenidos de investigaciones científicas.
-Consumo Adecuado (AI, por sus siglas en inglés) -- Este nivel se establece cuando no existen suficientes datos científicos para desarrollar una RDA. Se establece un nivel que se piensa asegura suficiente nutrición.
CONCLUSIONES
Los análisis cualitativos por colorimetría de los extractos en medio ácido y medio básico del fruto seco de S. saman dieron como resultado cambios de coloración indicando la presencia de Zinc. La aplicación de las técnicas para determinar cuantitativamente la presencia del Zinc en las vainas secas del S. saman demostraron una construcción de 305 mg en 25 ml de la disolución estudiada cantidad que representa un 55 % del mineral. En la bibliografía consultante encontramos que el requerimiento de Zinc en la salud humana oscila entre 2 y 13 mg en diferentes etapas; la presencia del metal con una concentración de 305 mg que representa en un 55 % de presencia en la vaina pudiera ser una alternativa viable para el diseño de un fármaco que se pueda usar para suplir el déficit de este en cuerpo humano.